吸烟对男性精液质量、精子DNA 完整性及Chk1基因表达的影响
李强,崔向荣,井宣,王振强,义建伟,武学清*
(1.山西省妇幼保健院生殖医学中心,太原 030000;2.山西省人民医院检验科,太原 030000;3.太原市中心医院辅助生殖医学中心,太原 030000)
精子DNA 损伤会降低精子受精能力和胚胎发育潜能,从而降低妊娠率,同时还会使流产率增高。据文献报道[1],吸烟不仅可引发男性精子浓度及活力的降低,还可导致精液中活性氧(ROS)水平的显著升高,进而产生氧化应激,引起精子细胞膜的改变,甚至引发精子DNA 的损伤。研究发现[2],细胞周期检测点激酶1(Chk1)表达的下降可引发细胞损伤后修复功能的缺失,进而导致DNA 损伤检测点失去作用。然而吸烟患者精液质量下降及精子DNA 损伤增加是否与Chk1的下调相关,目前尚无报道。本研究通过测定吸烟者与不吸烟者的Chk1基因表达差异,探讨吸烟对男性精液质量的影响与DNA 完整性及损伤后修复相关基因Chk1 表达的相关性。
资料与方法
一、研究对象与分组
选择2014年2月至2015年2月于山西省妇幼保健院生殖医学中心就诊的男性患者1 128例为研究对象,平均年龄(34.18±3.79)岁,其中吸烟组841例,不吸烟组287例。无外伤及遗传性疾病家族史,性功能正常,体检无明显睾丸、附睾及输精管异常,无感染及其它全身性疾病。除外生活或工作环境有污染、酗酒、精索静脉曲张及无精子症的患者。
根据世界卫生组织对吸烟情况的标准化建议,将研究对象分为不吸烟组(从未吸烟男性)和吸烟组(经常吸烟者:每天吸烟1支以上,且连续或累计吸烟6个月以上)。依据每天吸烟支数,将吸烟组患者划分为:轻度吸烟组(230例):日吸烟量≤9支,中度吸烟组(345例):日吸烟量10~≤19支,重度吸烟组(266例):日吸烟量≥20支;同时依据吸烟年限将吸烟组患者划分为:短烟龄组(238例):吸烟年限≤5年,中烟龄组(269例):吸烟年限5~10年,长烟龄组(334例):吸烟年限≥10年[3]。同时对患者一般情况(年龄、职业、烟、酒习惯)进行详细询问。研究对象均取得本人同意且签署知情同意书,并由医院伦理委员会讨论通过。
二、研究方法
1.精液标本收集:研究对象行精液检查前禁欲2~7d,手淫法取精,装入无菌、干燥、清洁、无毒取精杯中,用去皮称重法计算精液量,置37℃水浴锅内液化,经30~60min液化后,肉眼观察精液颜色、粘稠度,用pH 试纸检测pH 值,采用西班牙SCA全自动精液质量分析系统进行精液参数分析。另分别取1ml进行精浆锌、顶体酶和精子DNA 完整性检测。
2.精液常规分析:采用西班牙SCA 全自动精液质量分析系统,按照《WHO 人类精液检查与处理实验室手册》(2011年,第5版)标准,对吸烟组与不吸烟组进行精液浓度、精子活率、活力进行检测,同时采用改良巴氏染色法对患者精液进行形态学检测。
3.吖啶橙染色法检测精子DNA 完整性:按照精子核染色试剂盒(深圳华康生物医学工程)的检测方法,对DNA 完整性进行检测。步骤简述如下:待精液液化后,取1.0ml精液离心10min(1 000g)去除精浆。加入1 ml洗涤液,混匀后离心5 min(1 000g),去上清。洗涤两次后,弃上清,调整精子浓度为50×106/ml。取悬浮液涂片,晾干,固定10min。吖啶橙工作液染色5 min后,于荧光显微镜高倍镜下观察。计数200条精子,其中绿色代表DNA 双链精子,红色代表DNA 单链精子,橙黄色代表DNA 双链不稳定凿开精子。计算双链DNA精子百分率。
4.精子Chk1基因mRNA 相对表达量的检测:取精液标本于13 000r/min条件下离心15min,去上清,随后PBS洗涤3次,置于1ml Trizol提取液中,提取精子总RNA,逆转录为cDNA 后于-80℃冰箱中储存备用。采用实时荧光定量PCR(RT-QPCR)法,对逆转录的cDNA 浓度进行PCR扩增。以β-actin作为内参,并优化反应条件,使目的基因与内参的扩增效率近似相等且接近100%,Ct值代表基因的起始拷贝数,可根据Ct值比较基因的表达量。ΔΔCt=(Ct目的基因Ct内参基因)(Ct阴性对照Ct内参基因),以2-ΔΔCt计算各组mRNA的相对表达量。基因引物序列如下:Chk1上游引物:5TGAAGCCGGCCGTAGACT3,下游引物:5TCCACAGGACCAAACATC3;β-actin上游引物:5TGTACGTTGCTATCCAGGCT3,下游引物:5CTCCTTAATGTCACGCACGA3,所有引物均由上海Invitrogen生物工程有限公司合成。
三、统计学分析
本数据资料运用SPSS 17.0统计软件分析,计量资料用±s表示,两组间均数比较,采用t检验和秩和检验;率的比较采用χ2检验;相关性分析采用Spearman,结果用相关系数r 表示相关性分析。P<0.05为差异有统计学意义。
结 果
一、一般情况比较
本研究中不吸烟组共287 例,平均年龄为(34.32±3.43)岁,吸烟组841例,平均年龄为(33.98±3.99)岁,两组年龄无统计学差异(P>0.05),可排除年龄对相关指标的影响。
二、不吸烟组与吸烟组及日不同吸烟量组间精液常规参数比较
吸烟组与不吸烟组及日吸烟量各组相比,精液量、精液浓度及精子总数均无显著差异(P>0.05);吸烟组的前向运动精子率较不吸烟组显著下降(P<0.05),其中轻度吸烟组与不吸烟组相比,前向运动精子率无显著差异(P>0.05),中度及重度吸烟组与不吸烟组相比,前向运动精子率显著降低(P<0.05)(表1)。
三、不吸烟组与不同吸烟年限组间精液常规参数的比较
长烟龄组精液量、浓度、总数及前向运动精子率低于不吸烟组,差异具有统计学意义(P<0.05)。短烟龄组与不吸烟组相比,各精液常规检测项目无统计学差异(P>0.05)。中烟龄组较不吸烟组,前向运动精子率显著下降,差异具有统计学意义(P<0.05),其余各项与不吸烟组相比,无显著性差异(P>0.05)(表2)。
四、不吸烟组与吸烟组及日不同吸烟量组间精子形态学比较
经巴氏染色后,于显微镜下计数200条精子,计算各组正常精子率及头、体、尾各段异常精子率。其中不吸烟组的正常精子率及各段异常精子率与总吸烟组及轻、中度吸烟组相比无显著性差异(P >0.05),而重度吸烟组的头部精子缺陷率显著高于不吸烟组(P<0.05)(表3)。
表1 不吸烟组与吸烟组及日不同吸烟量组间精液常规参数比较(±s)

表1 不吸烟组与吸烟组及日不同吸烟量组间精液常规参数比较(±s)
注:与不吸烟组比较,*P<0.05
组 别 例数 精液量(ml) 精液浓度(×106/ml) 精子总数(×106) 前向运动精子率(%)不吸烟组 287 3.62±1.38 45.37±26.83 49.29±30.29 26.97±11.66吸烟组 841 3.45±1.17 41.47±22.94 45.62±32.94 18.16±10.48* 轻度吸烟组 230 3.52±1.08 44.39±23.42 47.27±29.95 26.52±11.63 中度吸烟组 345 3.39±1.21 42.61±28.26 45.74±31.44 19.48±10.24* 重度吸烟组 266 3.46±1.33 40.03±26.73 43.28±30.61 15.29±9.27*
表2 不吸烟组与不同吸烟年限组间精液常规参数的比较(±s)

表2 不吸烟组与不同吸烟年限组间精液常规参数的比较(±s)
注:与不吸烟组比较,*P<0.05
组 别 例数 精液量(ml) 精液浓度(×106/ml) 精子总数(×106) 前向运动精子率(%)不吸烟组 287 3.62±1.38 45.37±26.83 49.29±30.29 26.97±11.66短烟龄组 238 3.58±1.14 43.55±21.39 48.37±22.56 25.69±10.18中烟龄组 269 3.42±1.62 41.69±24.11 44.74±21.39 18.79±11.24*长烟龄组 334 2.19±1.03* 28.95±23.22* 38.67±18.22* 13.29±10.43*
表3 不吸烟组与吸烟组及日不同吸烟量组间精子形态学比较(±s)
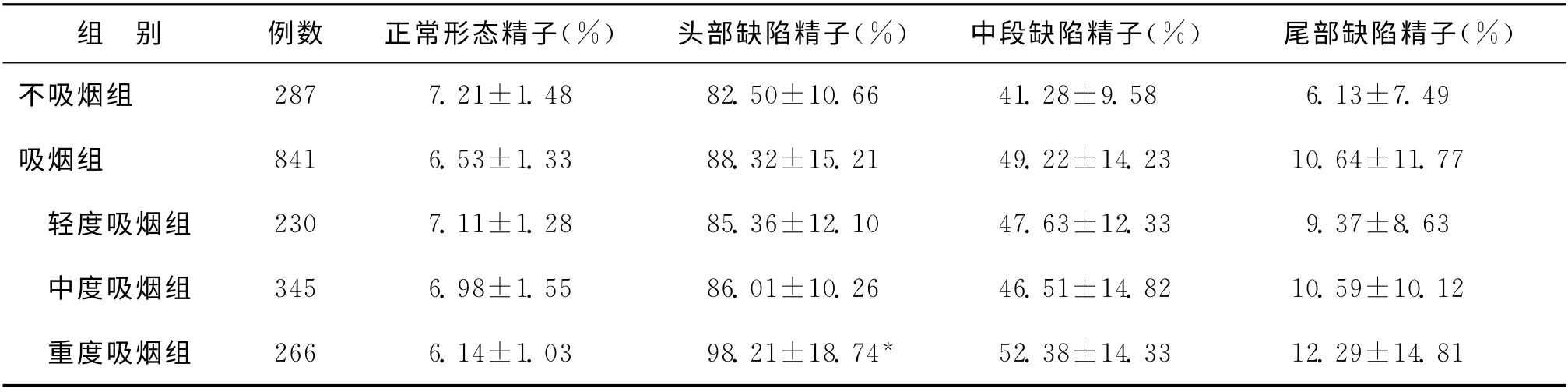
表3 不吸烟组与吸烟组及日不同吸烟量组间精子形态学比较(±s)
注:与不吸烟组比较,*P<0.05
组 别 例数 正常形态精子(%) 头部缺陷精子(%) 中段缺陷精子(%) 尾部缺陷精子(%)不吸烟组 287 7.21±1.48 82.50±10.66 41.28±9.58 6.13±7.49吸烟组 841 6.53±1.33 88.32±15.21 49.22±14.23 10.64±11.77 轻度吸烟组 230 7.11±1.28 85.36±12.10 47.63±12.33 9.37±8.63 中度吸烟组 345 6.98±1.55 86.01±10.26 46.51±14.82 10.59±10.12 重度吸烟组 266 6.14±1.03 98.21±18.74*52.38±14.33 12.29±14.81
五、不吸烟组与不同吸烟年限组间精子形态学比较
不吸烟组的正常精子率及各段异常精子率与短烟龄组及中、长烟龄组相比无显著性差异(P >0.05),而长烟龄组的头部精子缺陷率显著高于不吸烟组(P<0.05)(表4)。
六、吸烟组与不吸烟组精子DNA 完整性比较
随机选取200例男性患者,进行精子DNA 完整性检测,其中不吸烟者98例,吸烟者102例。吸烟组中DNA 完整精子比例为34%,显著低于不吸烟组(77%)(P<0.05)(图1)。
七、精子DNA 完整性与精液浓度及活力的相关性
精子DNA 完整性与男性精液浓度及前向运动精子率之间存在一定程度的相关性(P <0.05)(表5)。
表4 不吸烟组与不同吸烟年限组间精子形态学比较(±s)

表4 不吸烟组与不同吸烟年限组间精子形态学比较(±s)
注:与不吸烟组比较,*P<0.05
组 别 例数 正常形态精子(%) 头部缺陷精子(%) 中段缺陷精子(%) 尾部缺陷精子(%)不吸烟组 287 7.21±1.48 82.50±10.66 41.28±9.58 6.13±7.49短烟龄组 238 7.42±1.22 80.91±14.75 47.88±8.96 11.59±9.61中烟龄组 269 6.49±1.16 88.17±11.77 51.94±10.26 9.27±11.17长烟龄组 334 5.19±1.27 99.43±16.38*52.50±9.73 11.31±12.09
表5 精子DNA 双链精子百分率与精液浓度及活力的相关性(±s)
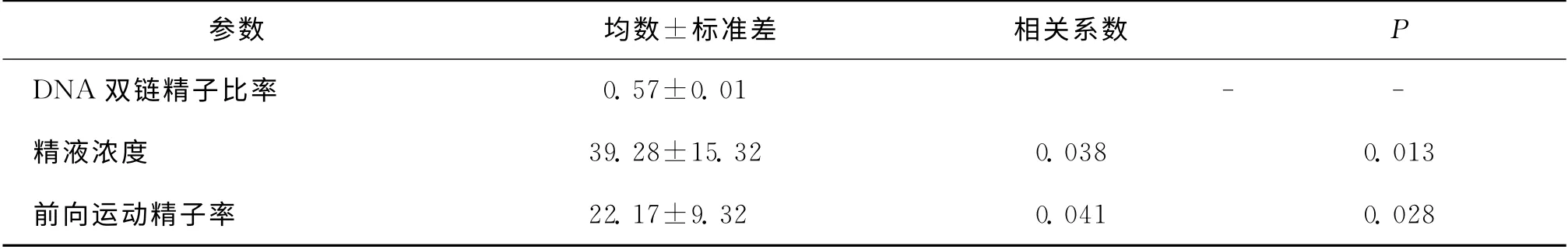
表5 精子DNA 双链精子百分率与精液浓度及活力的相关性(±s)
参数 均数±标准差 相关系数P DNA 双链精子比率0.57±0.01 - -精液浓度 39.28±15.32 0.038 0.013前向运动精子率22.17±9.32 0.041 0.028

图1 吸烟组与不吸烟组精子DNA 完整性比较
八、精子Chk1 基因mRNA 相对表达量的检测
行Chk1基因mRNA 相对表达量检测,其中不吸烟者98例,吸烟者102例。吸烟组患者较不吸烟组患者Chk1基因mRNA 相对表达量低,差异具有统计学意义(P<0.05)(图2)。
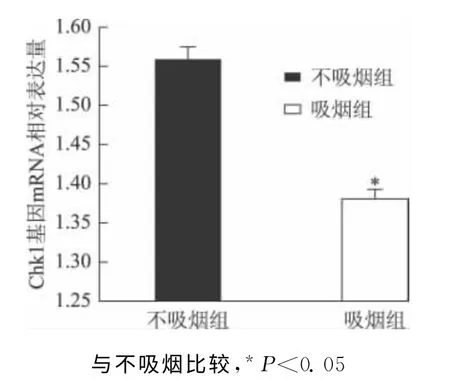
图2 吸烟组与不吸烟组Chk1基因mRNA 相对表达量
九、精子Chk1基因mRNA 相对表达量与精液浓度及活力的相关性
精子Chk1 基因mRNA 相对表达量与男性精液浓度及前向运动精子率间存在正相关(P<0.05)(表6)。
表6 精子Chk1基因mRNA 相对表达量与精液浓度及活力的相关性(±s)

表6 精子Chk1基因mRNA 相对表达量与精液浓度及活力的相关性(±s)
参 数 均数±标准差 相关系数P Chk1基因mRNA 相对表达量1.42±0.18 - -精液浓度 39.28±15.32 0.048 0.027前向运动精子率22.17±9.32 0.039 0.015
讨 论
吸烟是重要的环境危险因素,不仅可诱发肺癌、导致心血管疾病[4-5],还可引起女性生育能力降低,同时由于香烟烟雾中含有多种有毒化学物质,极易对睾丸正常的生精过程造成干扰,导致精液质量的下降,进而造成精子致孕力降低[6-7]。
现已证实,香烟中的尼古丁及有毒化合物可导致ROS在精浆内过量积聚。过量ROS一方面可直接导致DNA 损伤,另一方面还可引发DNA 双链断裂或通过DNA 链、遗传物质重塑、细胞退化等机制,最终导致DNA 损伤[8]。对精子细胞而言,DNA的完整性不仅保证了遗传信息的完整性,同时也对精子细胞的结构和形态有着重要的影响。本研究通过对吸烟及不吸烟患者精液常规参数比较及精子DNA 完整性与精液常规参数之间的相关性分析发现吸烟可引起男性精液质量下降,且随着吸烟时间的延长及日吸烟量的增加,精液质量下降更为显著。同时,通过相关性分析发现吸烟引发的精液质量下降与精子DNA 完整性存在一定的相关性,这表明DNA 完整性异常可能是导致吸烟男性精液质量下降的危险因素之一。因此,DNA 损伤后修复作为DNA 完整性的调控因素,在吸烟所致精液质量下降的机制过程中显得至关重要。
Chk1蛋白是生物进化过程中非常保守的蛋白激酶,其主要功能在于参与DNA 损伤引起的细胞周期检测点的调节[9-11]。Chk1参与细胞周期检查点的主要机制是通过与其上游蛋白激酶ATR 组成的信号通路在DNA 复制检查点及DNA 损伤检查点中发挥作用[12]。而DNA 损伤检查点可保证基因组DNA 损伤时,细胞可进行及时响应、延迟,甚至停滞细胞周期进程,同时还可相应的启动DNA 损伤的修复[13]。Chk1是G2-DNA 损伤校验的核心,并通过Cdc25C的磷酸化对DNA 损伤进行应答,进而对受损的DNA 进行有效修复,修复成功则继续进入细胞周期[2]。肿瘤研究中发现,Chk1基因的表达下降或失活将导致细胞损伤修复的缺失,进而引发DNA 损伤检测点失去作用[14]。然而吸烟男性精液质量降低是否与Chk1的调节修复机制相关,目前尚未见报道。
在本研究中发现吸烟组患者较不吸烟组患者Chk1基因mRNA 相对表达量降低且精子Chk1基因mRNA 相对表达量与男性精液浓度及前向运动精子率间存在一定程度的相关性。这一研究结果表明,在精子的调控中可能存在Chk1调控通路,即通过Chk1对精子损伤的DNA 进行检测修复。长期大量吸烟可能引发精子细胞内Chk1基因表达减少或缺失,进而导致DNA 受损伤的精子不能实现G2M 期停滞,进而不能得到有效的修复,引发精液质量的下降。
综上所述,Chk1基因表达下调与吸烟男性精液质量的相关性研究将为揭示吸烟引发男性生育能力降低的研究拓展又一新的方向。然而吸烟引发Chk1基因缺失或抑制的机理及Chk1基因的DNA修复功能尚需进一步研究。本研究利用分子生物学技术揭示吸烟男性精液质量下降的相关因素,为深入探讨吸烟引起的精子DNA 损伤在分子生物学水平的研究奠定基础。
[1] De Bantel A,Fleury-Feith J,Poirot C,et al.Simultaneous vitality and DNA-fragmentation measurement in spermatozoa of smokers and non-smokers[J].Cytometry B Clin Cytom.2015,88:120-124.
[2] Al-Kaabi MM,Alshareeda AT,Jerjees DA,et al.Checkpoint kinase1(CHK1)is an important biomarker in breast cancer having a role in chemotherapy response[J].Br J Cancer.2015,112:901-911.
[3] 江莉.吸烟对男性精液参数影响的临床研究与吸烟男性精子基因组甲基化变异分析[D]:广西医科大学;2013.
[4] 贾贡献,余金明,林凡礼,等.高血压患者吸烟状况与心血管危险分层的关系[J].中华高血压杂志.2013,21:340-345.
[5] 陆丕能,孙宁玲,陆鋆,等.吸烟量与冠心病关系的病例对照研究[J].中华流行病学杂志.2002,23:60-63.
[6] Sobinoff AP,Sutherland JM,Beckett EL,et al.Damaging legacy: maternal cigarette smoking has long-term consequences for male offspring fertility[J].Hum Reprod.2014,29:2719-2735.
[7] Tian M,Bao H,Martin FL,et al.Association of DNA methylation and mitochondrial DNA copy number with human semen quality[J].Biol Reprod.2014,91:101-108.
[8] La Maestra S,De Flora S,Micale RT.Effect of cigarette smoke on DNA damage,oxidative stress,and morphological alterations in mouse testis and spermatozoa[J].Int J Hyg Environ Health.2015,218:117-122.
[9] Kawasumi M,Bradner JE,Tolliday N,et al.Identification of ATR-Chk1pathway inhibitors that selectively target p53-deficient cells without directly suppressing ATR catalytic activity[J].Cancer Res.2014,74:7534-7545.
[10] Kim MK,James J,Annunziata CM.Topotecan synergizes with CHEK1(CHK1)inhibitor to induce apoptosis in ovarian cancer cells[J].BMC Cancer.2015,15:196-206.
[11] Koganti S,Hui-Yuen J,McAllister S,et al.STAT 3interrupts ATR-Chk1signaling to allow oncovirus-mediated cell proliferation[J].Proc Natl Acad Sci USA.2014,111:4946-4951.
[12] Zuazua-Villar P,Rodriguez R,Gagou ME,et al.DNA replication stress in CHK1-depleted tumour cells triggers premature(S-phase)mitosis through inappropriate activation of Aurora kinase B[J].Cell Death Dis.2014,5:e1253-1264.
[13] Yue M,Zeng L,Singh A,et al.Rad4 mainly functions in Chk1-mediated DNA damage checkpoint pathway as a scaffold protein in the fission yeast Schizosaccharomyces pombe[J].PloS one,2014,9:e92936-92949.
[14] Lunardi A,Varmeh S,Chen M,et al.Suppression of CHK1 by ETS family members promotes DNA damage response bypass and tumorigenesis[J].Cancer Discov,2015,5:550-563.

