盐析法纯化新鲜蓝藻中藻蓝蛋白工艺条件的研究
张发宇,赵冰冰,蔡静,袁梦媛,盛晶梦,汪家权*
盐析法纯化新鲜蓝藻中藻蓝蛋白工艺条件的研究
张发宇1,赵冰冰1,蔡静2,袁梦媛1,盛晶梦1,汪家权1*
1.合肥工业大学资源与环境工程学院,安徽合肥230009 2.合肥工业大学生物与食品工程学院,安徽合肥230009
以水华暴发的新鲜蓝藻为处理对象,采取冻融破壁的方式获取藻蓝蛋白的粗提液。在一步盐析与二步盐析单因素试验的基础上,基于正交试验综合考虑盐析时间、藻蓝蛋白的浓度、pH和(NH4)2SO4饱和度对纯化藻蓝蛋白的影响。结果表明,一步盐析中最优工艺条件是,(NH4)2SO4饱和度为17%、藻蓝蛋白粗提液浓度为1.45 g/L、pH为6.4、盐析时间为15 min;二步盐析中最优工艺条件是,(NH4)2SO4饱和度为35%、pH为4.0、盐析时间为15min。最终能得到纯度为2.04的藻蓝蛋白,有利于藻蓝蛋白的进一步纯化。
盐析;纯化;藻蓝蛋白;正交试验
张发宇,赵冰冰,蔡静,等.盐析法纯化新鲜蓝藻中藻蓝蛋白工艺条件的研究[J].环境工程技术学报,2015,5(6):499-503.
ZHANG F Y,ZHAO B B,CAIJ,et al.Research on technology conditions of purifying phycocyanin from fresh algae using salt precipitation[J].Journal of Environmental Engineering Technology,2015,5(6):499-503.
富营养化是指由于人类的活动,水体中营养物(一般是氮、磷的化合物)增加,引起浮游植物过量生长和整个水体生态平衡的改变,因而造成危害的一种污染现象[1]。其结果是引起水质恶化、溶解氧耗竭、透明度降低、渔业减产、阻塞航道,对人和动物产生毒性等。这种现象在江河湖泊中称为水华[2]。
湖泊水华的直接表现是浮游植物即蓝藻的大面积暴发。针对蓝藻暴发,一般采取机械和人工的方式进行打捞,但打捞后的蓝藻如果处置不当会造成二次污染,因此,针对打捞后的蓝藻进行资源化研究具有重要意义。目前,蓝藻资源化利用方式主要以产沼气和肥料为主[3-6],产品附加值较低,经济效益不高。研究表明,蓝藻中含有一种天然色素蛋白——藻蓝蛋白;该蛋白具有良好的功效,如抗炎性[7]、抗癌性[8]、抗衰老性[9]、抗氧化性[10-11]、免疫荧光性[12-13]等;该蛋白纯度越高价值越大。因此,从蓝藻中提取藻蓝蛋白,是蓝藻高附加值资源化利用的方向,也更符合目前经济社会发展需求。研究[14]表明,藻蓝蛋白纯度达到0.7以上,可作为食品级使用;纯度达到2以上,可作为药品级使用;纯度达到4以上,可作为试剂级使用。可见,从水华暴发的蓝藻中纯化藻蓝蛋白既能达到消除污染的目的,又可实现高附加值资源化利用。
纯化藻蓝蛋白的研究较多[15-19],笔者选择以反复冻融破壁的方式获得藻蓝蛋白粗提液,重点研究盐析法纯化藻蓝蛋白的基本工艺条件。选取盐析法纯化藻蓝蛋白是因为该法具有应用成熟、材料来源广泛、易于工业化等优点。国内研究盐析工艺一般都基于较粗放的不同饱和度(NH4)2SO4的单因素试验[20],对运用0.618法精确选取合适(NH4)2SO4饱和度范围以及两步盐析中各因素之间关系的研究较少。另外,对影响盐析的各要素之间关系的研究也很少。因此,笔者在一步和二步盐析单因素试验中运用0.618法精确选取合适(NH4)2SO4饱和度范围的基础上,建立起两步盐析中相关因素的正交试验,得到盐析法纯化藻蓝蛋白的优化条件,并通过盐析法获得纯度较高的藻蓝蛋白,以期为后期进一步的纯化提供基础。
1 材料与方法
1.1材料与试剂
新鲜蓝藻采自巢湖西湖区水华暴发表层20 cm水体,含水率为96.2%,采样日期为2014年8月9日,采样期间天气晴朗,室外气温37~38℃。蓝藻采集后运回实验室放入冰柜(BC/BD-718DTF型)内储存备用,存储温度为-18℃。
硫酸铵((NH4)2SO4)、硫酸(H2SO4)、氢氧化钠(NaOH)均为国产分析纯试剂,自配浓度为0.002 5 mol/L的磷酸盐缓冲液(PBS)。
1.2试验方法
1.2.1提取藻蓝蛋白粗提液
取冷冻保存的巢湖新鲜水华蓝藻,反复冻融3次。将解冻后的蓝藻于高速冷冻离心机(KDC-160HR型)中离心20 min,上清液过4层普通纱布,即可得到藻蓝蛋白粗提液。
1.2.2两步盐析及正交试验
在(NH4)2SO4饱和度为10%~60%范围内,根据0.618法的原理进行一步盐析,步骤如下:在已取得的藻蓝蛋白粗提液中缓慢加入(NH4)2SO4,用恒温搅拌器(85-2A型)进行搅拌,以防止溶液局部浓度过高导致蛋白质变性。(NH4)2SO4饱和度分别调至17%、19%、20%、21%、22%、24%、29%和41%,共8组。(NH4)2SO4经搅拌溶解后,在4℃、8 00 0 r/min高速冷冻离心机中离心10 min,倒出上清液,用紫外-可见分光光度仪(UV/VIS-1950型)测定藻蓝蛋白纯度,并计算得率。
在第一步盐析试验基础上,综合考虑(NH4)2SO4饱和度、藻蓝蛋白的初始浓度、pH和盐析时间的影响,优选一步盐析中因素与水平,建立正交试验。
同样,在(NH4)2SO4饱和度为21%~70%范围内,根据0.618法的原理进行二步盐析,步骤如下:将藻蓝蛋白粗提液在一步盐析的(NH4)2SO4最优饱和度下盐析后,取适量上清液,向其中追加(NH4)2SO4,至其饱和度分别达到 28.16%、29.28%、29.80%、30.40%、30.92%、32.56%、35.32%、39.72% 和 51.28%,共 9组。加 入(NH4)2SO4后,经恒温搅拌器搅拌溶解,在4℃、8 000 r/min高速冷冻离心机中离心10 min,获得沉淀,沉淀用磷酸缓冲溶液(0.002 5 mol/L的PBS)溶解后,用紫外-可见分光光度仪测定藻蓝蛋白纯度,并计算得率。
在二步盐析试验基础上,综合考虑(NH4)2SO4饱和度、pH和盐析时间的影响,优选二步盐析中因素与水平,建立正交试验。
1.3分析方法
藻蓝蛋白在620 nm处有特征吸收峰,蛋白在280 nm处有最大吸收峰,藻蓝蛋白的纯度测量参考A.Herrera等[21]推荐的公式。藻蓝蛋白浓度、得率参考B.Soni等[22]推荐的公式。
藻蓝蛋白纯度(P)=A620/A280
藻蓝蛋白浓度(C)=(A620-0.7×A650)/7.38
藻蓝蛋白得率=(C×V×k1)/(m×k2×1 000)×100
式中:A280、A620、A650分别为波长280、620和650 nm处的吸光度;C为蛋白浓度,g/L;V为藻蓝蛋白体积;m为藻泥质量;k1为藻蓝蛋白稀释倍数;k2为藻泥中蓝藻干物质所占比例。
2 结果与讨论
2.1一步盐析(NH4)2SO4饱和度单因素试验
将1.2.1节中所取得的藻蓝蛋白粗提液(初始纯度为0.426),在室温(25℃)下,按1.2.2节步骤并依据0.618法选点原理进行试验,在(NH4)2SO4饱和度为17%、19%、20%、21%、22%、24%、29%、41%下,分别测定上清液中藻蓝蛋白纯度和得率,结果如图1所示。

图1 一步盐析(NH4)2SO4饱和度对藻蓝蛋白纯度与得率的影响Fig.1 Effect of different(NH4)2SO4saturation on phycocyanin purity and yield of the first salt precipitation(25℃)
由图1可见,在(NH4)2SO4饱和度为21%时,藻蓝蛋白纯度达到最大,为0.519。在(NH4)2SO4饱和度为17%~24%时,得率变化不明显。但当(NH4)2SO4饱和度大于29%后,纯度与得率均有较大程度下降。因此,一步盐析中选取(NH4)2SO4饱和度最优点为21%,一步盐析(NH4)2SO4饱和度为17%~24%较合适。
2.2一步盐析正交试验
在一步盐析(NH4)2SO4饱和度单因素试验的基础上,综合考虑(NH4)2SO4饱和度、藻蓝蛋白浓度、pH和盐析时间的影响,按照L9(43)建立正交试验。影响因素及水平见表1。将正交试验的极差分析结果见表2。

表1 一步盐析正交试验影响因素及水平Table1 Factors and levels of orthogonal experimentof the first salt precipitation

表2 一步盐析正交试验极差分析结果Table 2 Results of orthogonal experiment of the first salt precipitation
由表2可知,各影响因素对纯度的重要性依次为pH>盐析时间>(NH4)2SO4饱和度>藻蓝蛋白浓度。pH影响最大,酸性和碱性环境对一步盐析中藻蓝蛋白的纯化均有影响,在一定程度上会导致上清液中藻蓝蛋白纯度下降,原水环境(pH=6.4)是一步盐析纯化藻蓝蛋白最优环境。在(NH4)2SO4饱和度为17%~25%时,盐析时间、(NH4)2SO4饱和度影响较弱,如果(NH4)2SO4饱和度较高,盐析时间可减少,也会有良好的纯化效果。藻蓝蛋白浓度影响最弱,在低浓度的藻蓝蛋白溶液下,基本上可以不考虑其浓度变化的影响。综合表2可知,在室温(25℃)下,一步盐析最优的工艺条件:(NH4)2SO4饱和度为17%,藻蓝蛋白浓度为1.45 g/L,pH为6.4(即原水pH),盐析时间为15 min。
2.3二步盐析(NH4)2SO4饱和度单因素试验
根据一步盐析试验结果,在室温25℃下,精细追加(NH4)2SO4,至其饱和度分别为 28.16%、29.28%、29.80%、30.40%、30.92%、32.56%、35.32%、39.72%和51.28%,得到的藻蓝蛋白沉淀经溶解后测藻蓝蛋白纯度和得率见图2。
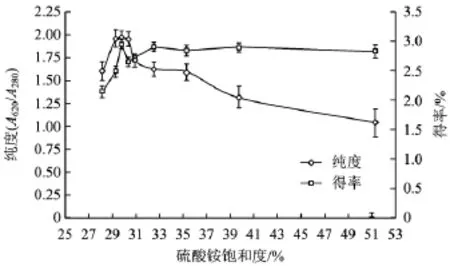
图2 二步盐析不同饱和度(NH4)2SO4对藻蓝蛋白纯度与得率的影响Fig.2 Effect of different(NH4)2SO4saturation on phycocyanin purity and yield of the second salt precipitation
由图2可见,二步盐析时,当(NH4)2SO4饱和度为28.16%~29.80%,沉淀中藻蓝蛋白的纯度和得率均呈上升趋势,在(NH4)2SO4饱和度为29.80%时,沉淀中藻蓝蛋白的纯度和得率分别达到最大值,为1.969和2.95%。当(NH4)2SO4饱和度大于29.80%时,纯度开始下降,当(NH4)2SO4饱和度大于30.92%时,纯度下降开始明显,但得率变化并不明显。因此,二步盐析中选取(NH4)2SO4的饱和度最优值为 29.80%,(NH4)2SO4饱和度为29.28%~35.32%较合适。
2.4二步盐析正交试验
在第二步盐析单因素试验与一步盐析正交试验的基础上,进行二步盐析的正交试验。考虑到藻蓝蛋白浓度影响最小,并且在实际中调节不便,因此二步盐析正交试验重点考虑(NH4)2SO4饱和度、pH和盐析时间的影响,不考虑藻蓝蛋白浓度因素。按照L9(43)建立正交试验,影响因素及水平如表3所示。正交试验的极差分析结果见表4。

表3 二步盐析正交试验影响因素及水平Table 3 Factors and levels of orthogonal experiment of the second salt precipitation
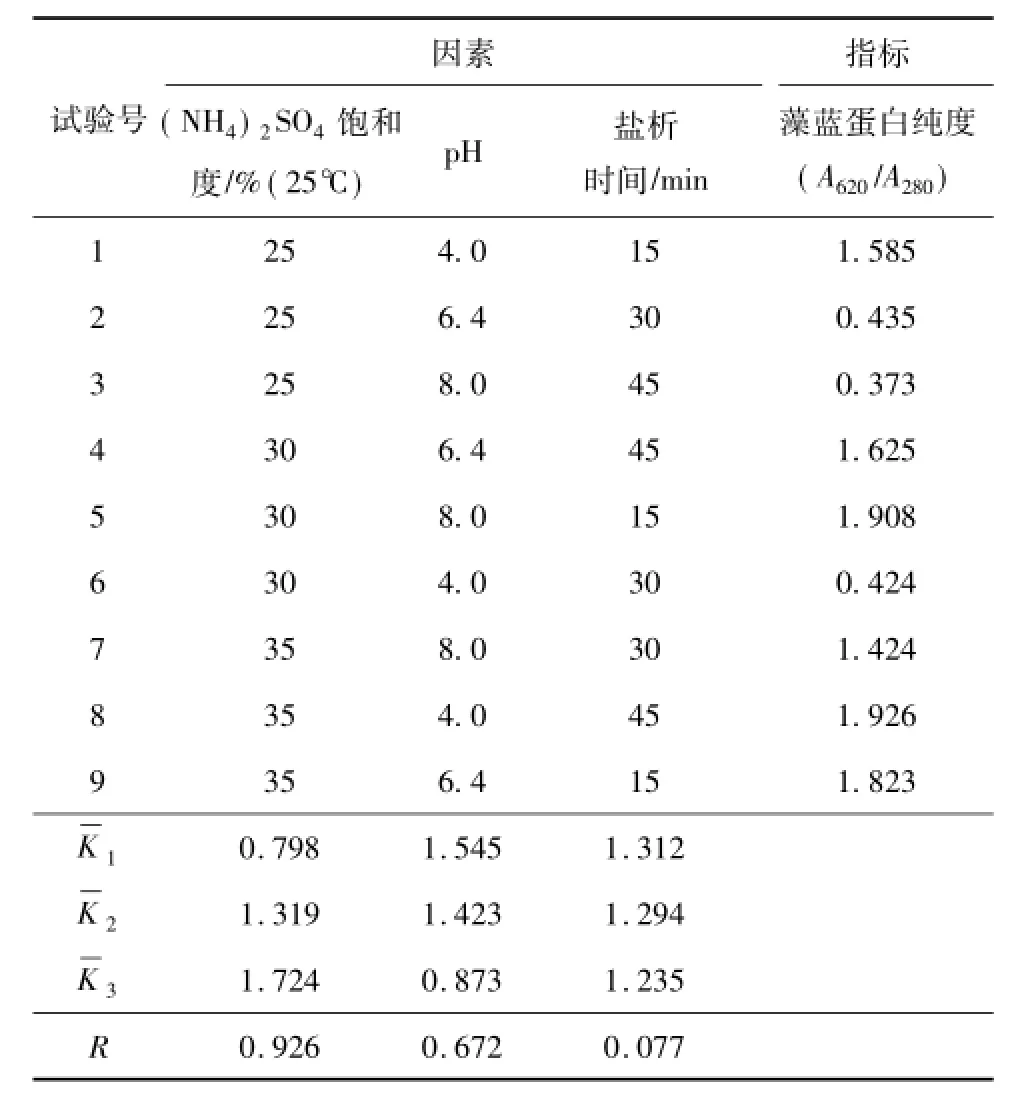
表4 二步盐析正交试验的极差分析结果Table 4 Results of orthogonal experiment of the first salt precipitation
由表4可以看出,各影响因素对纯度的重要性为(NH4)2SO4饱和度 >pH>盐析时间。在(NH4)2SO4饱和度为25%~35%时,(NH4)2SO4饱和度影响最大,随着(NH4)2SO4饱和度的增加,沉淀中藻蓝蛋白纯度增大。pH影响次之,酸性环境明显优于原水和碱性环境,这是因为藻蓝蛋白的等电点在弱酸性(pH为4)附近,该环境利于藻蓝蛋白沉淀析出。盐析时间影响最弱,可以不考虑其影响,只需保证二步盐析中(NH4)2SO4完全溶解即可,因此选定盐析时间为15 min。综合表4可知,在室温(25℃)下,二步盐析最优工艺条件:(NH4)2SO4饱和度为35%,pH为4,盐析时间为15 min。
2.5两步盐析最优工艺条件试验
在一步与两步盐析的正交试验基础上,进行最优工艺条件试验:在一步盐析中选取(NH4)2SO4饱和度为17%,藻蓝蛋白浓度为1.45 g/L,pH为6.8(即盐析时间为 15 min;在二步盐析中选取(NH4)2SO4饱和度为35%,pH为6.8(工程应用上尽量不调节pH),盐析时间为15 min时,藻蓝蛋白纯度达到2.04。
3 结论
(1)盐析法用于纯化藻蓝蛋白有良好的效果,一般需要进行两步盐析组合试验,一步盐析时较低(NH4)2SO4饱和度利于除去杂质,二步盐析时较高(NH4)2SO4饱和度利于沉淀更多的藻蓝蛋白。
(2)一步盐析中(NH4)2SO4饱和度合适区间为17%~24%,二步盐析中(NH4)2SO4饱和度合适区间为29.28%~35.32%。
(3)一步盐析最优工艺条件是,(NH4)2SO4饱和度为17%,藻蓝蛋白浓度为1.45 g/L,pH为6.4,盐析时间为15 min;二步盐析最优工艺条件是,(NH4)2SO4饱和度为35%,pH为4,盐析时间为15 min。
(4)在最优工艺条件下试验,最终可得纯度大于2的藻蓝蛋白,为后期进一步纯化提供了基础。
[1]刘建康.高级水生生物学[M].北京:科学出版社,1999:326-330.
[2]孔繁翔,宋立荣.蓝藻水华形成过程及其环境特征研究[M].北京:科学出版社,2011:2-50.
[3]韩士群,严少华,王震宇,等.太湖蓝藻无害化处理资源化利用[J].自然资源学报,2009,24(3):431-437.
[4]朱守诚,苗春光,武艳,等.蓝藻有机肥的制备及其对水稻生长的影响[J].安徽农业科学,2013,41(4):1513-1514.
[5]彭书传,侯成虎,王进,等.玉米秸秆与巢湖蓝藻混合厌氧发酵的产沼气性能[J].农业工程学报,2012,28(15):173-178.
[6]徐富,李学尧.蓝藻厌氧消化产沼气技术研究[J].环境科学与管理,2013,38(1):90-94.
[7]ROMAY C,GONZALEZ R,LEDON N,et al.C-phycocyanin:a biliprotein with antioxidant,anti-inflammatory and neuroprotective effects[J].Current Protein and Peptide Science,2003,4(3):207-216.
[8]王勇,钱峰,钱凯先.藻蓝蛋白抗癌活性研究[J].浙江大学学报,2001,35(6):672-675.
[9]赵艳景,汤云成.条斑紫菜藻蓝蛋白的分离纯化及其抗衰老作用研究[J].食品科学,2012,33(17):94-97.
[10]汪兴平,谢笔均,潘思轶,等.葛仙米藻蓝蛋白抗氧化作用研究[J].食品科学,2007,28(12):458-461.
[11]杨立红,王晓洁,钟旭升,等.鱼腥藻藻蓝蛋白的抗氧化作用[J].食品科学,2006,27(12):208-212.
[12]李济平.藻蓝蛋白对免疫系统的活性的研究[J].中国公共卫生,2000,16(7):647-648.
[13]吴萍.藻胆蛋白与荧光免疫分析[J].生理科学进展,2000,31(1):82-84.
[14] PATILG,CHETHANA S,SRIDEVIA S,et al.Method to obtain C-Phycocyanin of high purity[J].Journal of Chromatography A,2006,1127(1):76-81.
[15]胡一兵,胡鸿钧,李夜光,等.从一种富含藻胆蛋白的螺旋藻中大量提取和纯化藻蓝蛋白的研究[J].武汉植物学研究,2002,20(4):299-302.
[16]温少虹,赵呈龙,张莉萍.紫球藻B-藻红蛋白的分离纯化[J].中国海洋药物,2002,82(3):33-35.
[17] CAMREN S S,TERESA P N,ROXANA O R,et al.Extraction and purifieation of phycocyanin from Calothrix sp.[J].Process Biochemistry,2004,39(12):2047-2052.
[18] MINKOVA K,TCHORBADJIEVA M,TCHEMOY A,et al. Improved procedure for separation and purification of Arihronema africanum phycobili proteins[J].Biotechnology Letters,2007,29(4):647-651.
[19] BENAVIDES J,RITO-PALOMARES M.Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentumn[J].Joumal of Chromatography B,2006,844(1):39-44.
[20]韩士群,李辉东,严少华,等.太湖蓝藻藻蓝蛋白的提取及纯化[J].江苏农业学报,2012,28(4):777-782.
[21]HERRERA A,BOUSSIBA S,NAPOLENONE V,et al.Recovery of phycocyanin from the cyanobacterium Spirulina maxima[J]. Journal of Applied Phycology,1989,1(1):325-331.
[22] SONI B,KALAVADIA B,TRIVEDI U,et al.Extraction,purification and characterization of phycocyanin form Oscillatoria quadripunctulata-isolate form the rocky shores of Bet-Dwarka,Gujarat,India[J].Process Biochemistry,2006,41(9):2017-2023.◁
Research on Technology Conditions of Purifying Phycocyanin from Fresh A lgae Using Salt Precipitation
ZHANG Fa-yu1,ZHAO Bing-bing1,CAI Jing2,YUAN Meng-yuan1,SHENG Jing-meng1,WANG Jia-quan1
1.School of Resources and Environmental Engineering,Hefei University of Technology,Hefei230009,China 2.School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei230009,China
The fresh blue-green algae in algae bloom were used for treatment and the crude extracts of phycocyanin were obtained by freeze-thaw method.On the basis of single-factor experiment of salt precipitation in the first and second steps,salt precipitation time,the impacts of phycocyanin concentration,pH and(NH4)2SO4saturation on the purifying phycocyanin were comprehensively considered using the orthogonal experiment.The results showed that the optimum conditions in the first step were 17%of(NH4)2SO4saturation,1.45 g/L of crude phycocyanin extract,pH 6.4 and 15 min of reaction time.In the second step,the optimum(NH4)2SO4saturation was 35%,with pH 4.0 and 15min of reaction time.The purity of phycocyanin was2.04 at last,which would facilitate further purification.
salt precipitation;purification;phycocyanin;orthogonal experiment
X703
1674-991X(2015)06-0499-05doi:10.3969/j.issn.1674-991X.2015.06.078
2015-06-21
国家“十二五”科技重大专项资助项目(2012ZX07103-004)
张发宇(1983—),男,讲师,博士,主要研究方向为水处理技术,13655551436@139.com
*责任作者:汪家权(1957—),男,教授,博士,主要从事环境系统仿真与污染控制、环境规划管理及水资源利用与保护,jiaquan.wang@163.com

