志贺氏菌实时荧光单引物等温扩增方法的建立及应用
王建昌,胡连霞,段永生,李 静,王金凤
(河北出入境检验检疫局检验检疫技术中心,河北石家庄050051)
志贺氏菌实时荧光单引物等温扩增方法的建立及应用
王建昌,胡连霞,段永生,李 静,王金凤*
(河北出入境检验检疫局检验检疫技术中心,河北石家庄050051)
以志贺氏菌ipaH基因特异序列为靶序列,设计RNA-DNA组合引物和链终止序列,优化反应体系,建立实时荧光单引物等温扩增检测志贺氏菌的方法,反应时间为44 min。通过对4株不同群志贺氏菌和12株其他食源性致病菌进行实时荧光单引物等温扩增检测,结果表明,除4株志贺氏菌外,其他细菌均未扩增出荧光曲线。进一步研究表明,采用普通热裂解法提取DNA,实时荧光检测福氏志贺氏菌DNA的灵敏度为1.16 fg/μL,纯培养菌液的灵敏度为1.3 CFU/mL;对牛奶模拟样品中福氏志贺氏菌的检出限是1.8 CFU/mL。研究结果表明,实时荧光单引物等温扩增检测志贺氏菌灵敏度高、特异性强、耗时短、方法简便。
实时荧光单引物等温扩增;志贺氏菌;ipaH基因
志贺氏菌(Shigella)是人类细菌性痢疾最为常见的病原菌,通称痢疾杆菌,是一类具有高度传染性和危害严重的革兰氏阴性杆菌,长约2~3 μm,不形成芽孢,无荚膜,无鞭毛,有菌毛。志贺氏菌病常为食物爆发型或经水传播[1],人类对志贺氏菌普遍易感,每年全球有1.6亿人患病,约有110万人死亡,绝大多数为5岁以下儿童[2],10~100 CFU/mL细菌即可致病[3]。在发展中国家,由福氏志贺氏菌引起的感染性腹泻疾病高居首位[4]。中国自2005年开始,在全国范围内开展菌痢的监测,该病的报告病例数一直高居全国甲乙类法定传染病的前5位[5]。
目前,食品中志贺氏菌的传统检测方法主要依据国家标准GB 4789.5—2012[6],需要厌氧培养、分离、筛选和生化鉴定,检测结果虽准确,但操作烦琐、检测周期长,满足不了快速检测的需求。分子生物学技术因具有检测灵敏度高、特异性强、操作简便等优点,在食源性致病菌的检测中发挥了巨大的作用,也被应用于志贺氏菌的检测。随着食品安全检测标准的提高,寻找更加快速、准确、便捷的检测技术显得至关重要。
志贺氏菌属分为痢疾志贺氏菌(S.dysenteriae)、福氏志贺氏菌(S.flexneri)、鲍氏志贺氏菌(S.boy dii)和宋内氏志贺氏菌(S.sonnei)4个群。编码侵袭性质粒相关抗原H的片段基因(ipaH),决定志贺氏菌对大肠黏膜的上皮细胞侵袭能力,同时,多拷贝存在于染色体和侵袭性大质粒上,不随传代而丢失。以志贺氏菌ipaH基因保守序列为靶基因可将其与其他致病菌种属区分开,又可以全部检测出志贺氏菌4个群。
单引物等温扩增技术(single primer isothermal amplification,SPIA)是近年报道的一种新型线性核酸等温扩增技术。该技术主要是通过一条3'端是DNA片段、5'端是RNA片段的组合引物、RNase H及具有强链置换活性的DNA聚合酶实现DNA的体外线性等温扩增,经过RNA降解、新引物结合、链置换的循环过程,实现模板互补序列的快速扩增,最终扩增出大量的具有高度忠实性的cDNA单链[7-8]。
目前,国内外关于SPIA方法的报道比较少,利用实时荧光PCR仪进行实时监测,建立实时荧光SPIA检测志贺氏菌方法,更未见到报道。Potash等[9]曾应用逆转录SPIA技术研究从生物样品中扩增全基因组cDNA,并对重组病毒EcoHIV感染小鼠后感染应激基因进行了成功表达。Whitworth等[10]在分析猪胚胎不同发育阶段基因表达差异时,应用美国NuGEN公司开发的Ribo-SPIA试剂盒进行了mRNA的扩增和转录。该Ribo-SPIA试剂盒能够从低至1ng的总RNA模板中扩增出106的cDNA产物。而本研究运用SPIA技术基本原理,针对志贺氏菌ipaH基因保守序列设计特异性的RNA/DNA组合引物和终止序列Blocker,并在反应体系中加入特异性结合单链DNA的SybergreenⅡ荧光染料,建立检测志贺氏菌的实时荧光单引物等温扩增(realtime SPIA)方法,与实时荧光PCR方法相比,该方法灵敏度高,对模板质量要求不高,扩增时间短,适合于食品中致病菌现场快速筛选。
1 材料和方法
1.1 材料
1.1.1 实验菌株
本实验所用菌株见表1。

表1 实验用菌株Tab. 1 Strains in this study
1.1.2 主要试剂
BstDNA聚合酶、RNase H、RNA酶抑制剂、MgCl2、dNTPs、SYBER GreenⅡ等,购自上海生工生物工程有限公司;基因组DNA提取试剂盒,购自北京天根生化科技有限公司;实验中所有培养基均购自北京陆桥有限责任公司;实验中所用到的牛奶样品购自当地超市。
1.1.3 主要设备
ABI7500型扩增仪,美国AB公司;Whatman T Gradient基因扩增仪,德国Biometra公司;Biophotometer plus核酸蛋白分析仪,德国Eppendorf公司。
1.1.4 RNA/DNA组合引物和Blocker的设计和合成
根据Genebank中志贺氏菌ipaH基因(EU340151)已知序列,对其进行同源性分析,确定其保守序列,用Primer Premier 5.0设计组合引物和相应链终止序列,如表2。所有组合引物和Blocker均由大连Takara公司合成。
1.2 实验方法
1.2.1 志贺氏菌的培养
取保藏的福氏志贺氏菌、宋内志贺氏菌、鲍氏志贺氏菌、痢疾志贺氏菌在XLD琼脂培养基中进行划线,培养箱36℃培养12 h,传代培养2次。挑取传代培养菌落接种至新鲜无菌的营养肉汤培养基中,36℃过夜培养。
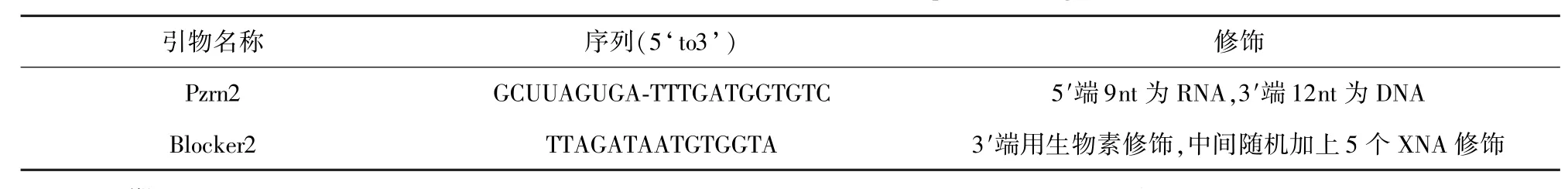
表2 实时荧光SPIA设计的引物Tab.2 Real-time fluorescence SPIA primer design
1.2.2 基因组DNA的提取
1)普通热裂解法。取1 mL菌液5 000~8 000 r/min,离心5 min,弃上清液。加入200 uL无菌DEPC水,振荡混匀,5 000~8 000 r/min,离心5 min,弃上清,重复操作一次。加入100 μL无菌DEPC水,振荡混匀,100℃水浴10 min,12 000 r/min离心10 min,取上清液,-20℃保存备用。
2)天根试剂盒法。按试剂盒说明书进行基因组DNA的提取,并测定DNA浓度。
1.2.3 志贺氏菌实时荧光SPIA检测方法的建立
建立志贺氏菌实时荧光SPIA反应体系,总体积为25 μL,对反应体系中RNA/DNA组合引物、Blocker、Bst DNA polymerase、RNaseH、dNTPs、MgCl2、RNase Inhibitor和SYBER GreenⅡ的使用浓度进行优化,确定各组分的最佳工作浓度,建立志贺氏菌实时荧光SPIA优化反应体系。
将志贺氏菌基因组DNA模板、组合引物、Blocker及反应缓冲液的混合液经99℃,90 s处理后降温至60℃,迅速加入RNase H和Bst DNA聚合酶,在ABI7500实时荧光PCR仪上55~65℃,反应30~60 min,反应过程中实时监测荧光信号,以期确定最佳反应温度,建立志贺氏菌实时荧光SPIA检测方法。
1.2.4 志贺氏菌实时荧光SPIA检测方法的特异性分析
取表1中19株过夜培养菌悬液1 mL,用热裂解法提取基因组DNA作为模板,根据1.2.3中所建立的反应体系和条件进行检测,对所建立的实时荧光SPIA方法进行特异性分析。
1.2.5 两种基因组DNA提取方法对实时荧光SPIA检测结果的影响
使用1.2.2中两种方法提取4株不同群志贺氏菌基因组DNA,每种方法各3个平行,作为模板进行实时荧光SPIA检测,分析不同的DNA提取方法对检测结果的影响。
1.2.6 志贺氏菌实时荧光SPIA检测方法的灵敏性分析
以福氏志贺氏菌为检测对象,对1.2.3中所建立方法的灵敏性进行分析。挑取营养琼脂上36℃培养12 h的福氏志贺氏菌单菌落,制备成一定浓度菌悬液。用生理盐水进行10倍系列稀释,采用稀释平板法,测定其纯培养物活菌数为1.3×108CFU/mL;同时取1 mL纯培养物采用试剂盒法提取福氏志贺氏菌基因组DNA,测得DNA质量浓度为116 mg/L,用灭菌DEPC水进行10倍系列稀释,进行志贺氏菌实时荧光SPIA方法的灵敏性试验。
1.2.7 志贺氏菌实时荧光SPIA检测方法在模拟样品中检出限分析
在牛奶中添加福氏志贺氏菌作为模拟污染样品进行检出限分析。进行添加前,牛奶样品已按GB 4789.5—2012[6]常规检验法证实志贺氏菌阴性。挑取在营养琼脂36℃培养12 h的福氏志贺氏菌单菌落,制备成一定浓度菌悬液,用生理盐水进行10倍系列稀释后,选取系列稀释浓度菌悬液1 mL分别添加到99 mL牛奶样品中,混匀,分别取1 mL模拟样品,采用稀释平板法,测定其活菌添加范围为1.8×105~1.8×10-2CFU/mL,直接用热裂解法提取志贺氏菌基因组DNA,进行志贺氏菌实时荧光SPIA方法对模拟污染牛奶样品的检出限分析。本实验重复3次。
2 结果与分析
2.1 志贺氏菌实时荧光SPIA反应体系和反应条件的建立
通过对反应体系、反应条件、组合引物及Blocker(Pzrn 2+Blocker 2)的优化,志贺氏菌出现典型的扩增曲线,如图1。最终确定反应条件为59.0℃,1 s;58.0℃,32 s;80个循环,反应时间为44 min。反应体系为RNA/DNA组合Primer 5.6 μmol/L、Blocker 0.36 μmol/L、10×Bst Buffer 2.5 μL、Bst DNA polymerase 20 U、10×RNaseH Buffer 2.5 μL、RNaseH 5 U、dNTPs 0.2 mmol/L、MgCl23.5 mmol/L、RNase Inhibitor 16 U、DNA模板1 μL、SYBER GreenⅡ0.3 μL(300×稀释),其余用灭菌DEPC水补足体系。

图1 Pzrn 2和Blocker 2的实时荧光SPIA反应结果Fig.1 Results of real-time fluorescence SPIA with Pzrn 2 Primer and Blocker 2
2.2 志贺氏菌实时荧光SPIA检测方法的特异性分析
建立的志贺氏菌实时荧光SPIA检测方法具有良好的特异性,检测结果如图2。由图2可见,4株志贺氏菌均出现典型的荧光扩增曲线,其他细菌检测均未产生扩增曲线。

图2 志贺氏菌实时荧光SPIA引物特异性检测结果Fig.2 Specificity of real-time fluorescence SPIA for Shigella
2.3 不同模板DNA提取方法对志贺氏菌实时荧光SPIA检测结果的影响
分别用热裂解法、试剂盒法提取志贺氏菌模板DNA,应用实时荧光SPIA检测,每种方法各做3个平行实验,均出现典型的扩增曲线,Ct值没有明显差异,结果如表3。表3表明,实时荧光SPIA方法检测志贺氏菌对模板质量要求不苛刻,能适应广大的基层和现场检测。

表3 不同模板DNA提取方法对志贺氏菌实时荧光SPIA检测结果的影响Tab.3 Effects of different DNA extraction methods on results of real-time SPIA for Shigella
2.4 志贺氏菌实时荧光SPIA检测方法的灵敏度分析
根据2.1建立的实时荧光SPIA检测方法,进行志贺氏菌实时荧光SPIA检测方法的灵敏性实验,结果如图3。由图3可见,当DNA模板用量为1.16×103~1.16 fg/μL时,即志贺氏菌浓度为1.3×103~1.3 CFU/mL时,均出现典型的扩增曲线;当模板用量为0.116 fg/μL,即志贺氏菌浓度为0.13 CFU/mL时,则无扩增曲线。因此,志贺氏菌DNA的检测灵敏度为1.16 fg/μL,对志贺氏菌菌液的检测灵敏度为1.3 CFU/mL。
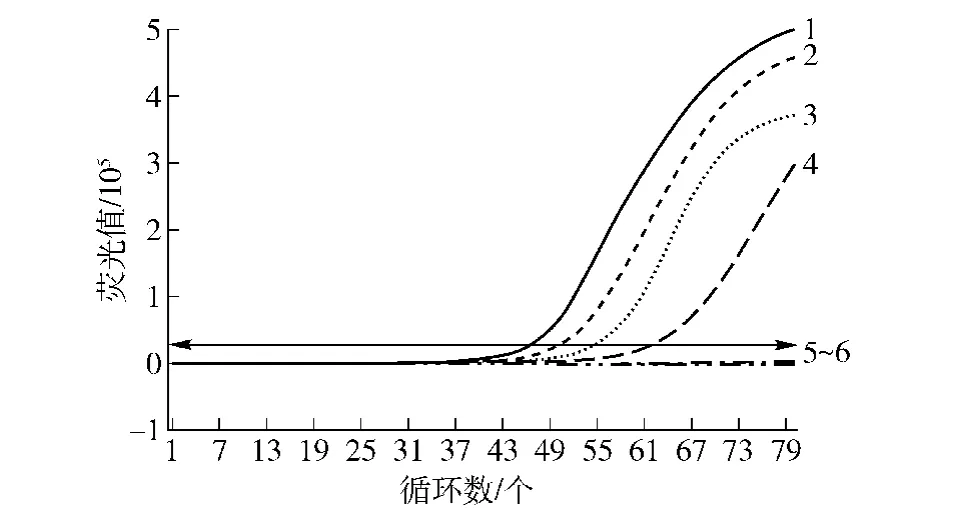
图3 志贺氏菌实时荧光SPIA检测方法的灵敏性实验结果Fig.3 Sensitivity of real-time fluorescence SPIA detection of Shigella
2.5 志贺氏菌实时荧光SPIA检测方法在牛奶模拟样品中的检出限分析
根据2.1建立的实时荧光SPIA检测方法,进行牛奶模拟样品的检出限分析,结果如图4。由图4可见,当牛奶样品中志贺氏菌浓度为1.8 CFU/mL时,出现典型的扩增曲线;当牛奶样品中志贺氏菌浓度为0.18 CFU/mL时,则无扩增曲线。因此,志贺氏菌实时荧光SPIA检测方法在牛奶模拟样品中检出限为1.8 CFU/mL。3次重复实验结果一致。

图4 志贺氏菌实时荧光SPIA检测方法对模拟样品中志贺氏菌的检出限分析结果Fig.4 Detection limit of real-time fluorescence SPIA detection of Shigella in simulated sample
3 结 论
志贺氏菌属的菌群分布在各地之间存在差异,在同一地区的不同年份其菌群分布也不尽相同。国外在20世纪40年代以前是A群占优势,50年代以B群为主,而1965年后D群为主要菌群。自2005年以来,我国大部分省市分离的志贺氏菌以福氏志贺氏菌为主,而从2010—2011年的监测数据来看,宋内志贺氏菌成了优势菌群,检出率分别为70.59%和67.86%,远远超过福氏志贺氏菌[11]。以志贺氏菌属ipaH基因4个群保守序列,设计组合引物和链终止序列,建立的实时荧光SPIA检测方法对志贺氏菌属的4个群均能检出,检测灵敏度较高,同时对模板DNA要求较低,能够满足各个地区和国家普及和推广。
Igor等[12]研究发现,10~100 CFU/mL的志贺氏菌就可引发严重的炎症反应,引起幼儿急性中毒性菌痢,而且死亡率高。我国吴平芳等[13]建立的改良分子信标-实时PCR反应体系,对志贺氏菌DNA灵敏度为93 fg/μL,对其菌液灵敏度为64 CFU/mL。胡建华等[14]对培养液中及牛奶阳性样品中的志贺氏菌采用常规PCR和实时定量PCR相结合进行检测,在20 h内检测敏感度可达到2 CFU/mL。曾桂芬等[15]所建立的志贺氏菌LAMP检测方法,对细菌纯培养物和模拟食品的灵敏度分别为53,68 CFU/mL。本研究所建立的志贺氏菌实时荧光SPIA方法,对志贺氏菌纯培养的灵敏度为1.3 CFU/mL,对牛奶模拟污染样品的检出限是1.8 CFU/mL。因此,灵敏性和检出限要高于实时荧光PCR和LAMP方法。
本研究依据SPIA的原理,在普通SPIA的基础上,采用加入特异性结合单链DNA的荧光染料SYBER GreenⅡ,利用荧光PCR仪进行实时监测扩增情况,建立了实时荧光SPIA检测方法。本方法省去烦琐的聚丙烯酰胺凝胶电泳检测过程,比普通SPIA技术和PCR技术省时省力,成为可以替代PCR的核酸扩增新技术。本研究所建立的实时荧光SPIA方法反应时间仅为44 min,对志贺氏菌纯培养的灵敏度为1.3 CFU/mL,在检测牛奶模拟污染样品时其检出限是1.8 CFU/mL,比LAMP法对志贺氏菌灵敏度和检出限高1个数量级,且对模板DNA质量要求不高,所以易于在基层和现场快速检测。
随着对SPIA技术研究的不断深入,我们将不断完善、发展这种新型的技术,使之在食源性致病菌检测方面发挥更大优势,得到更全面的应用。单引物等温扩增技术在食源性致病菌的快速检测方面将具有广阔的应用前景。
[1] Fan He,Ke Han,Lunguang Liu,et al.Shigellosis outbreak associated with contaminated well water in a rural elementary school:Sichuan Province,China,June 7-16,2009[J].PLoS One,2012,7(10):e47239.
[2] Ashkenazi S.Shigella infections in children:new insights[J].Seminars in Pediatric Infectious Diseases,2004,15(4):246-252.
[3] Kotloff K L,Winickoff J P,Ivanoff B,et al.Global burden of Shigella infections:implications for vaccine development and implementation of control strategies[J].Bull World Health Organ,1999,77(8):651-666.
[4] Bhattattacharya D,Suqunan A P,Bhattacharjee H,et al.Antimicrobial resistance in Shigella-rapid increase&widening of spectrum in Andaman Islands,India[J].Indian Joural of Medical Research,2012,135(3):365-370.
[5] 隋吉林,张静,孙军玲,等.2009年中国细菌性痢疾监测分析[J].疾病监测,2010,25(12):947-950.
[6] 中华人民共和国卫生部.GB 4789.5—2012食品微生物学检验志贺氏菌检验[S].北京:中国标准出版社,2012.
[7] Kurn N,Chen P,Heath J D,et al.Novel isothermal,linear nucleic acid amplification system for highly multiplexed applications[J].Clinical Chemistry,2005,51(10):1973-1981.
[8] Gill P,Ghaemi A.Nucleic acid isothermal amplification technologies:a review[J].Nucleosides,Nucleotides and Nucleic Acids,2008,27(3):224-243.
[9] Potash M J,Chao W,Bentsman G,et al.A mouse model for study of systemic HIV-1 immume responses and neuroinvasiveness[J].Proceeding of the National Academy of Science of the United States of America,2005,102(10):3760-3765.
[10] Whitworth K M,Agca C,Kim J G,et al.Transcriptional profiling of pig embryogenesis by using a 15K member unigene set specific for pig reproductive tissues and embryos[J].Biol Reprod,2005,72(6):1437-1451.
[11] 张华一,王素萍,石燕.青海省2005—2009年细菌性痢疾监测结果分析[J].疾病预防控制,2012,39(8):2052-2059.
[12] Igor G,Anders S,Alexander M,et al.A method for allelic replacement in Francisella tularensis[J].FEMS microbiology letters,2003,222(2):273-280.
[13] 吴平芳,石晓路,郑琳琳,等.改良分子信标-实时PCR快速检测志贺菌[J].中国卫生检验杂志,2006,16(4):394-395.
[14] 胡建华,李洁莉,马兆飞,等.牛奶样品中志贺氏菌的快速PCR检测技术研究[J].食品科学,2007,28(8):433-437.
[15] 曾桂芬,龙北国,姜容,等.LAMP和PCR法检测痢疾志贺菌的特异性和灵敏性比较[J].热带医学杂志,2012,12(5):547-549.
Establishment and Application of Real-time Fluorescence Single Primer Isothermal Amplification for Shigella
WANG Jianchang, HU Lianxia, DUAN Yongsheng, LI Jing, WANG Jinfeng*
(Technical Center of Inspection and Quarantine,Hebei Entry-Exit Inspection and Quarantine Bureau,Shijiazhuang 050051,China)
Based on the Shigella ipaH gene,the RNA-DNA primers and Blockers were designed and synthetized,and the real-time fluorescence single primer isothermal amplification(real-time fluorescence SPIA)for the detection of Shigella was established.The reaction time of the method was 44 min.After detection of the 4 different Shigella group strains and 12 other food borne bacteria by the real-time fluorescent SPIA,the results showed that only the Shigella could be detected and showed the typical fluorescence curve.Further studies show that the sensitivity of the detection method for Shigella flexneri in pure culture was 1.16 fg/μL and 1.3 CFU/mL.The detection limit of Shigella flexneri in milk was 1.8 CFU/mL.The results demonstrate that the real-time fluorescence SPIA detection method for Shigella is highly sensitive,strong specific and much more convenient.
real-time fluorescence single primer isothermal amplification;Shigella;ipaH gene
TS207.4;R117
A
(责任编辑:叶红波)
10.3969/j.issn.2095-6002.2015.06.007
2095-6002(2015)06-0040-06
王建昌,胡连霞,段永生,等.志贺氏菌实时荧光单引物等温扩增方法的建立及应用[J].食品科学技术学报,2015,33(6):40-45.
WANG Jianchang,HU Lianxia,DUAN Yongsheng,et al.Establishment and application of real-time fluorescence single primer isothermal amplification for Shigella[J].Journal of Food Science and Technology,2015,33(6):40-45.
2015-03-04
质检公益性科研专项项目(201210128;201310126)。
王建昌,男,兽医师,博士,主要从事食源性微生物、动物疫病病原分子生物学研究;
*王金凤,女,兽医师,硕士,主要从事食源性微生物、动物疫病病原分子生物学研究。通信作者。

