为人体基因“改错”
王震元
红细胞忽变“镰刀” “白日梦”探求成真
1910年的一天,一位黑人青年向医生叙述:自己发烧,并伴有肌肉酸痛的症状。后经血液化验分析,这位患者不但显示贫血的征象,而且他的红细胞变成了奇特的镰刀形。这种病从此就被定名为“镰刀形红细胞贫血症”。
显然,该患者的许多症状都是由于红细胞形状的改变引起的。但是,为什么会发生这种改变呢?几十年来,即使是一流的医生也无法对此作出解答。直到1956年,科学家们运用诺贝尔奖获得者桑格发明的“指纹图”技术,才揭开了其中之谜。原来,红细胞中的主要成份血红蛋白,是由血红素和珠蛋白两部分组成的。正常和异常的血红蛋白中的血红素并无差别,所不同的是珠蛋白部分。对比两种珠蛋白的组成,α链并无不同,而β链上氨基酸的数量虽然相等,但正常β链第6位上所含的谷氨酸,在异常β链上却被缬氨酸所取代。正是这一个氨基酸的改变,使异常血红蛋白很容易在低温条件下相互连接起来,形成细丝状结构,进而聚合成凝胶,使红细胞受到牵拉而变成了镰刀形。
1953年,沃森、克里克等人对遗传物质DNA的划时代发现,使科学家们从基因层面确认:镰刀形红细胞,是DNA相应位置上一个核苷酸“突变”的产物。1958年,在一次血红蛋白结构新发现的研讨会上,刚从美国哈佛大学毕业,并曾聆听过沃森讲课的安德森一针见血地指出:只有放入正常血红蛋白的基因才能够使“镰刀状血红蛋白恢复正常”。但是,当时那位主讲教授却轻蔑地打断他的话说道:“年轻人,如果你想做白日梦,那么慢慢做去吧!”
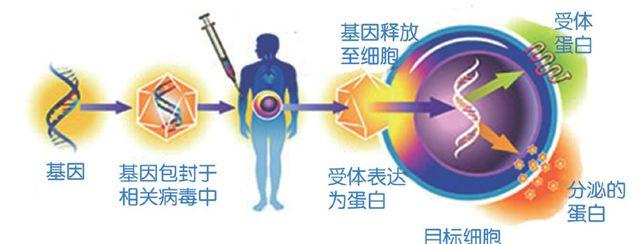
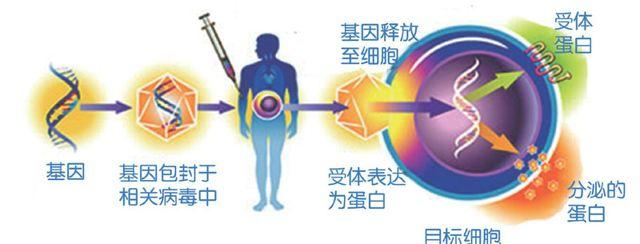
权威的讽刺,并没有动摇安德森的观点。早在1953年进入美国哈佛大学就学前夕,他就立下誓言“要治愈受损的分子”。在1960年,安德森成为DNA的另一位发现者克里克的研究生,后获得剑桥大学硕士学位;1965年,他又以美国哈佛大学博士的身份前往美国国家卫生研究院(简称为NIH),加入解读基因密码的尼伦伯格实验室,此后他更加坚定了自己的信念。但是,安德森也发现,要将修复人体基因的试验付诸行动,确实面临诸多困难。其中最为关键的是,细菌实验十分成功的基因转移技术,对人体细胞却不起任何作用。直到1984年,美国麻省理工学院的科学家穆里根,利用一种“逆转录病毒”,把基因转移到哺乳动物的细胞中,才使安德森的梦想接近现实。穆里根将病毒中掌管繁殖和引起疾病的基因去掉,然后用他想转移的基因取代病毒基因。之后,病毒就会将剩下的新基因组插入细胞。

但是,正当安德森准备运用穆里根的技术治疗基因缺陷病人时,却发现根据美国的法律,他的行为必须得到联邦食品和药品管理局、重组DNA咨询委员会的批准,并确认这种临床试验的安全性。那么,安德森又该怎样保证呢?
“擦边球”药监“绿灯” “隔离罩”冰火人生
1988年,美国国家癌症研究所的医生罗森堡,发现一种免疫系统的细胞会攻击肿瘤。他把这种细胞从患者血液中分离出来,进行“强化”后重新注射回患者体内,但怎样才能知道“强化”后的免疫细胞进入了肿瘤组织呢?罗森堡接受了安德森的建议,将这种免疫细胞加上一个“抗新霉素基因”。“强化”进入人体几天后,他们把小片肿瘤组织放入含有新霉素的培养皿中,根据这些细胞的存活与否,就可判断细胞是否进入了肿瘤组织。由于安德森和罗森堡都坚持声称,在这种改造后的细胞中,基因仅是个“标记”,且只对濒死患者进行试验,因而联邦食品和药品管理局、重组DNA咨询委员会都同意了这次人体试验。1989年5月22日,试验在一位患有皮肤癌的卡车司机身上进行,并收到了预期的效果。从此,揭开了基因治疗的序幕。
紧接着,安德森通过妻子凯西的介绍,结识了儿童免疫系统疾病专家布利兹。他们共同精心选择了一位居住在俄亥俄州克里夫兰市的患者阿善娣·德西瓦。这个3岁小女孩患有一种先天性的严重联合免疫缺陷病。这是由于她位于第20号染色体上的一种腺苷脱氨酶(ADA)基因发生缺陷所致,这一缺陷使其无法合成相应的腺苷脱氨酶,使T细胞被“毒化”而丧失了正常的免疫功能。因而,德西瓦从呱呱坠地之日起,就不得不“与世隔绝”——被安置在空气高度净化的隔离罩中,依靠输液维持生命。
从1990年开始,安德森和布利兹得到了德西瓦父母的同意,并经联邦食品和药品管理局、重组DNA咨询委员会批准后,决定对她实施基因治疗。
1990年9月5日,安德森团队从德西瓦胳膊上抽血并过滤出白细胞后,再将红细胞和血清输送回她的体内。然后,他们把过滤出的白细胞送到实验室,与含有腺苷脱氨酶基因的逆转录病毒混合,再让细胞繁殖10天。
终于到了关键的时刻。同年9月14日,德西瓦4岁生日刚过,在观看床边电视上播出的《芝麻街》节目过程中,她经历了一次载入医学史册的重大事件。半小时之后,大约10亿个她自身的白细胞重新进入了血管。这个过程虽然很像一次常规输液,但安德森团队的科学家们,却渴望并坚信输入的是挽救她生命的ADA基因。
在治疗的初期,这种治疗每个月都要重复进行。为了以防万一,科学家们同时还为德西瓦注射了用聚乙二醇包裹的ADA药物,但注射量却逐步减少。1992年8月,经过11次治疗后,经检验证实,ADA基因已经进入她体内一些寿命很长的白细胞中,它们的后代已经充分取代了有缺陷的白细胞。这说明她的免疫系统正在逐步恢复正常。一年之后,德西瓦终于开始了与正常女孩一样的新生活,她甚至还能滑冰、游泳和跳舞。1995年,安德森在给《科学美国人》杂志编辑部的信中写道:德西瓦已经变成了“什么事情都想干的9岁小孩”。
1991年1月,安德森团队对第2例ADA缺乏症患者卡召尔的治疗,同样获得了成功。于是,人们高度评价安德森团队开创的基因治疗,称其是人类医学史上一次划时代的革命。那么,这项研究的发展是否一帆风顺呢?
兄弟俩千里求医 坎坷路前景壮丽
研究表明,人体存在一类单基因遗传病。父母双方如果都带有一个某种隐性病态基因,本人并不会患病,但他们生下的孩子,这种隐性基因就会表现为显性基因而导致孩子患病。除了镰刀形红细胞贫血症、重症联合免疫缺陷(SCID)外,血友病也属于这类遗传病。这些遗传病的区别在于血友病是“伴性遗传”,一般只遗传给男性。显然,这种先天性疾病,药物或手术都是无法根治的。
1991年4月底,上海长海医院与复旦大学遗传研究所紧密合作,对从北方千里迢迢赶来的刘氏兄弟这两位血友病B患者,进行了基因治疗。血友病B是由于患者的F9基因突变,而使凝血因子IX远低于正常水平所致。患者即便是受到轻微的外伤也会出血不止。传统的疗法只能通过频繁输血或输入血制品中的凝血因子,来维持患者的生命,这种方法不仅疗效短、费用高,而且患者极易受到感染。我国科学家创新的方法是将正常人的凝血因子IX的基因以逆转录病毒为载体,导入患者离体培养的皮肤成纤维细胞中,再以这些大量繁殖的细胞胶原悬液,通过皮下注射回植到体内。刘氏兄弟经过6年治疗后,凝血功能明显好转。
此外,基因治疗对治疗半乳糖血症、肺部囊性纤维化、利伯先天性黑朦(失明)等“不治之症”,也都有了突破性的进展。
目前,科学家们还在探索基因治疗攻克癌症的方法。例如利用逆转录病毒,将一种HSV-TK基因导入离体培养的恶性神经胶质瘤的细胞中,然后回输给患者,再用无毒性的环氧丙苷治疗。这种药物在HSV-TK基因产生的酶的作用下,会转化为有毒物质,使癌细胞“自杀”。而周围的正常细胞则不受影响。
事物总是一分为二的。理想的基因治疗应该是“基因置换”,即将正常基因定点导入靶细胞的缺陷部位,原位替换异常基因,使致病基因永久地更正;抑或是“基因矫正”,即在原位纠正缺陷基因的突变碱基,而不必替换整个基因。前者适用于ADA缺乏症;而后者则适用于镰刀形红细胞贫血症。但是实际上,这两种基因治疗由于技术难度很大,迄今无法实施。目前临床上应用的是“基因增补”,也称为“基因添加”或“基因修饰”。就是将外源性正常基因导入靶细胞并随机整合于基因组中,弥补病态基因的缺陷,并不去除原有的病态基因。
但正是这种由病毒运载基因的“随机性”,产生了一系列的问题:一些病人的免疫系统消灭了病毒,而这些基因“运输卡车”尚未完成任务;另一些患者则对病毒过敏。特别严重的是两次灾难性事件,一次发生在1999年9月17日,一名叫耶西·盖辛格的美国青年,接受了遗传性肝病基因治疗后死亡;另一次发生在2002年,法国两名儿童身患类似德西瓦的免疫系统疾病,经基因治疗后患上了白血病。经研究分析后发现,患者原先的病是治好了,但有的病毒将基因“随机”插入错误位置,激发了一个致癌基因,从而引发了癌症。
由此可见,目前科学家对基因治疗尚有许多未被认识的领域。但是,运用这种新技术攻克一系列传统意义上的“不治之症”的思路,却已被实践证明是正确的,其前景更是光明的!被尊称为“基因疗法之父”的安德森,在晚年入选故乡美国俄克拉何马州名人堂时说道:“这是我的使命!我不会放弃的!”

