饲料中糖源对大黄鱼生长性能及消化酶、糖代谢关键酶活性的影响
李 弋 周飘苹 邱 红 候迎梅 申屠基康 周歧存*
(1.宁波大学海洋学院鱼类营养研究室,宁波 315211;2.宁波市海洋与渔业研究院,宁波 315010)
三大营养物质中,糖类是最廉价的,但鱼类对糖类的利用能力要低于陆生动物,已有的研究表明肉食性鱼类对糖的利用能力低于草食性和杂食性鱼类[1-3]。这是由于草食性和杂食性鱼类的淀粉酶和代谢酶活性要高于肉食性鱼类[4],此外,研究表明肉食性鱼类的胰岛素受体水平要低于草食性和杂食性鱼类,鱼类的胰岛素水平低下被认为是导致鱼类耐糖机能低下的主要原因[3,5]。已有的研究显示,鱼类对脂肪与蛋白质的表观消化率要显著高于糖类[6],而且,结构复杂的多糖要比单糖更容易吸收[7-9],所以饲料中添加适宜的糖源能降低脂肪与蛋白质的消耗。鱼类肝脏存在着糖酵解、糖异生、三羧酸循环、磷酸戊糖等4种主要糖代谢途径。糖酵解是在无氧环境下,产生ATP的一种供能方式,己糖激酶(HK)及其同工酶葡萄糖激酶(GK)、二磷酸果糖激酶(PFK)和丙酮酸激酶(PK)是糖酵解途径的3个主要调控酶。而糖异生途径是指从丙酮酸合成葡萄糖的过程,也有3个限速酶:磷酸稀醇式丙酮酸羧基酶(PEPCK)、1,6-二磷酸果糖酶(FBPase)和6-磷酸葡萄糖酶(G6Pase)[6]。
大黄鱼(Larmichthys crocea Richardson)隶属鲈形目(Perciformes),石首鱼科(Sciaenidae),黄鱼属,为暖温性近海中下层集群洄游性鱼类,主要分布在我国黄海南部、东海、台湾海峡以及南海北部。大黄鱼肉质细嫩、味道鲜美,是我国东海传统四大海洋经济种类之一。然而,近20年来,由于野生大黄鱼资源衰退,不重视海洋生物资源的恢复性保护,野生大黄鱼资源日益短缺。20世纪90年代后期,随着大黄鱼人工育苗的突破,养殖技术的日趋完善,大黄鱼的养殖在福建和浙江等省迅速推广,成为最具中国特色的水产养殖品种之一。然而,传统网箱养殖的主要饵料为鲜杂鱼,随着鲜杂鱼的捕捞量不断缩减,价格上涨,养殖成本日渐增高;此外,传统网箱养殖易产生病害,污染养殖环境,是一种不可持续的发展方式。因此,用人工配合饲料替代鲜杂鱼饵料是大黄鱼养殖业可持续发展的必然趋势,这就要求开发高效廉价的大黄鱼配合饲料以满足养殖生产的需求。因此,本试验拟通过研究不同糖源对大黄鱼生长性能、消化酶及糖代谢关键酶活性的影响,确定大黄鱼饲料中适宜的糖源,为开发资源节约高效环保的大黄鱼配合饲料提供理论依据。
1 材料与方法
1.1 试验饲料
以葡萄糖、蔗糖、糊精、土豆淀粉、玉米淀粉和小麦淀粉分别为糖源,红鱼粉、小麦蛋白粉和豆粕为蛋白质源,以鱼油、豆油和大豆卵磷脂为脂肪源,配制成6种不同糖源(糖添加水平为20%)的试验饲料(表1)。所有饲料原料粉碎后过80目筛,按配方比例混匀后,添加油脂和水(30%)再次混合均匀,用双螺杆挤条机[F(Ⅱ)-26,华南理工大学,广州]加工制成直径分别为2与4 mm的硬颗粒饲料,自然条件下风干至含水量在10%左右,用塑封袋包装好于-20℃冰箱中保存备用。

表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
1.2 饲养管理
试验用大黄鱼苗购于象山港湾水产苗种有限公司,并在浙江省宁波市象山县西沪港湾网箱中进行养殖试验。试验前,将鱼苗放于的大规格网箱(3.0 m×3.0 m×3.0 m)中暂养2周,用商业饲料(天邦牌大黄鱼专用配合饲料,粗蛋白质含量为45%,粗脂肪含量为10%)饱食投喂,使其适应试验投饲环境。暂养结束后,停止投喂,使其饥饿24 h,然后称重,挑选体格健壮、规格一致的鱼苗[初始平均体重为(7.06±0.48)g],分置于18个小规格浮伐式网箱(1.5 m×1.5 m×2.0 m)中,每网箱放养50尾,每种试验饲料随机投喂3个网箱的试验鱼,即每组3个重复,共6个组。每天饱食投喂2次(05:00和17:00),并记录投喂量。及时记录死鱼数量及质量,养殖周期为8周。试验期间,海水温度为26.5~31.5℃,盐度为32~36 g/L,溶解氧含量在7.0 mg/L左右。
1.3 样品采集与指标测定
养殖试验结束后,停止投喂使试验鱼饥饿24 h,然后依次将网箱中的鱼捞出,用丁香酚(上海化学试剂公司产品,1∶10 000)麻醉,称重计数,用于计算生长性能指标。随后每网箱随机选取3尾试验鱼作为全鱼样品,用于鱼体常规营养成分分析。每网箱随机另取8尾,从尾部静脉抽取血液样本,其中4尾鱼血样注入抗凝管,用于分析全血指标;另4尾鱼血样注入1.5 mL离心管,静置于4℃冰箱过夜,3 500 r/min离心8 min制得血清,用于分析血清指标;将部分取过血的大黄鱼肝脏、胃、前肠剥离,放置于2 mL离心管中(取完立即放入液氮中),分别用于检测肝糖原含量及肝脏糖代谢关键酶、胃蛋白酶、肠道淀粉酶和脂肪酶活性;取背鳍肌肉10 g左右,装于密封袋中,用于检测肌糖原含量。
饲料和鱼体常规营养成分的分析参照AOAC(1995)[11]方法。其中,粗蛋白质含量检测采用凯氏定氮法;粗脂肪含量检测采用索氏抽提法;水分含量检测采用105℃烘干恒重法;粗灰分含量检测采用550℃高温灼烧法。血清指标(总蛋白、葡萄糖、甘油三酯、胆固醇含量)由宁波大学医学院附属医院利用全自动生化分析仪(日立7600-110,日本)进行检测。肝糖原与肌糖原含量的检测参照Hassid等[12]的多糖的化学分析法,使用南京建成生物工程研究所生产的试剂盒检测。胃蛋白酶与肠道淀粉酶活性检测采用南京建成生物工程研究所生产的试剂盒检测,肠道脂肪酶活性采用上海乔杜生物科技公司生产的酶联免疫吸附试验(ELISA)试剂盒检测。
肝脏糖代谢关键酶分为糖酵解途径关键酶和糖异生途径关键酶,本试验测定的糖酵解途径关键酶有HK、GK、PFK,糖异生途径关键酶有PEPCK、FBPase和G6Pase,上述酶活性采用南京建成生物工程研究所相关试剂盒检测。
1.4 计算公式
增重率(WGR,%)=100×(Wt-Wi)/Wi;
特定生长率(SGR,%/d)=100×(LnWt-LnWi)/t;
饲料效率(FE)=(Wt-Wi)/F;
蛋白质效率(PER)=(Wt-Wi)/P;
成活率(SR,%)=100×Nt/Ni;
肝体比(HSI,%)=100×Wh/W;
脏体比(VSI,%)=100×Wv/W;
肥满度(CF,g/cm3)=100×W/L3。
式中:Wi为试验鱼初始重(g);Wt为试验鱼末重(g);F为饲料摄入量(g);t为试验天数(d);Nt为试验结束鱼数量(尾);Ni为试验初始鱼数量(尾);P为蛋白质摄入量(g);W为鱼体重(g);L为鱼体长(cm);Wh为鱼肝脏重(g);Wv为内脏重。
1.5 数据统计与分析
所有数据采用SPSS version 16.0软件对数据进行统计学分析,先对数据作单因素方差分析(one-way ANOVA);组间若有显著差异,再进行Duncan氏法多重比较,P<0.05表示差异显著。数据采用平均值±标准差。
2 结果
2.1 饲料中糖源对大黄鱼生长性能的影响
由表2可知,饲料中糖源对大黄鱼成活率的影响不显著(P>0.05);小麦淀粉和玉米淀粉组大黄鱼的增重率、特定生长率、饲料效率和蛋白质效率均显著高于蔗糖和葡萄糖组(P<0.05)。

表2 饲料中糖源对大黄鱼生长性能的影响Table 2 Effects of dietary carbohydrate sources on growth performance of large yellow croaker(n=3)
2.2 饲料中糖源对大黄鱼形态学指标的影响
由表3可知,饲料中糖源对大黄鱼脏体比和肥满度的影响不显著(P>0.05);肝体比以葡萄糖组最高,糊精和蔗糖组较低,葡萄糖组显著高于其他各组(P<0.05)。

表3 饲料中糖源对大黄鱼形态学指标的影响Table 3 Effects of dietary carbohydrate sources on morphological indices of large yellow croaker(n=3)
2.3 饲料中糖源对大黄鱼全鱼常规营养成分的影响
由表4可知,全鱼水分、粗灰分和粗蛋白质含量各组间没有显著差异(P>0.05)。小麦淀粉、土豆淀粉和玉米淀粉组的全鱼粗脂肪含量显著高于其他组(P<0.05)。

表4 饲料中糖源对大黄鱼全鱼常规营养成分的影响Table 4 Effects of dietary carbohydrate sources on whole body routine nutritional components of large yellow croaker(n=3)%
2.4 饲料中糖源对大黄鱼肝糖原和肌糖原含量的影响
由表5可知,葡萄糖组的肝糖原含量显著高于其他组(P<0.05),蔗糖组肝糖原含量最低;葡萄糖组肌糖原含量显著低于其他组(P<0.05),糊精组肌糖原含量最高。
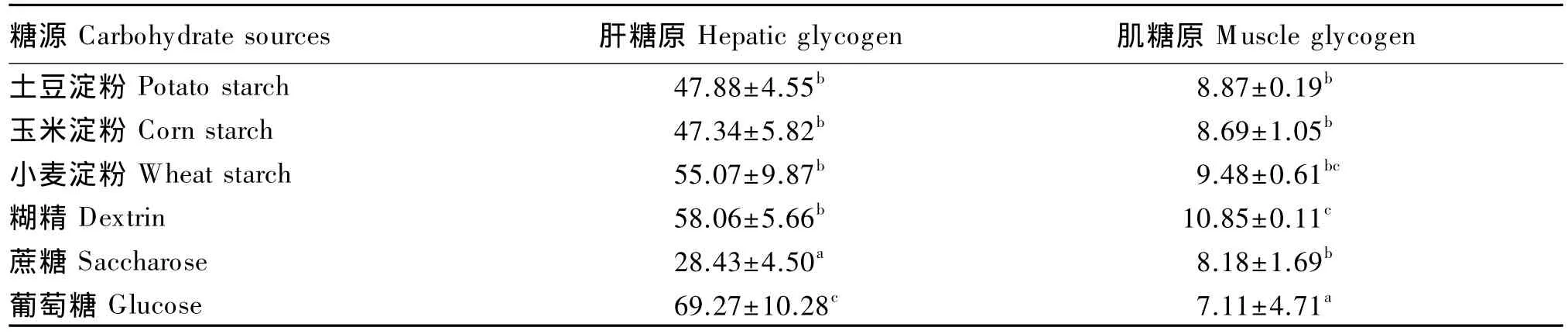
表5 饲料中糖源对大黄鱼肝糖原和肌糖原含量的影响Table 5 Effects of dietary carbohydrate sources on hepatic glycogen and muscle glycogen contents of large yellow croaker(n=3) mg/g
2.5 饲料中糖源对大黄鱼血清指标的影响
由表6可知,饲料中糖源对大黄鱼血清胆固醇、甘油三酯和总蛋白含量均没有显著影响(P>0.05)。土豆淀粉组的血清葡萄糖含量显著高于其他组(P<0.05),而其他各组间无显著差异(P>0.05)。
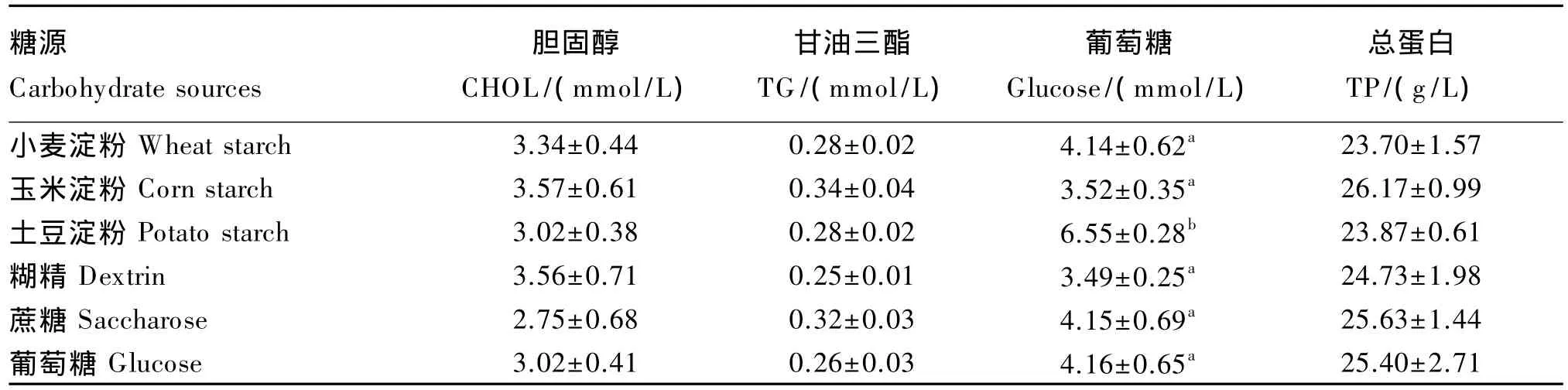
表6 饲料中糖源对大黄鱼血清指标的影响Table 6 Effects of dietary carbohydrate sources on serum indexes of large yellow croaker(n=3)
2.6 饲料中糖源对大黄鱼消化道消化酶活性的影响
由表7可知,玉米淀粉组的胃蛋白酶活性最高,显著高于除土豆淀粉组外的其他各组(P<0.05),糊精和蔗糖组胃蛋白酶活性较低,显著低于其他各组(P<0.05);土豆淀粉、玉米淀粉、小麦淀粉组的肠道淀粉酶、脂肪酶活性相当,这3组均显著高于糊精、蔗糖和葡萄糖组(P<0.05),同时糊精和葡萄糖组的肠道脂肪酶活性还显著高于蔗糖组(P<0.05)。
2.7 饲料中糖源对大黄鱼肝脏糖代谢关键酶活性的影响
由表8可知,GK和FBPase活性各组间差异不显著(P>0.05)。小麦淀粉组的PFK和PK活性最高,显著高于玉米淀粉、糊精和蔗糖组(P<0.05);玉米淀粉组的PEPCK活性最高,显著高于其他各组(P<0.05);糊精组的G6Pase活性最高,显著高于蔗糖组(P<0.05)。
3 讨论
从本试验结果来看,大黄鱼幼鱼在摄食不同糖源饲料后,小麦淀粉与玉米淀粉组的增重率和特定生长率显著高于蔗糖与葡萄糖组,说明大黄鱼的生长性能与饲料糖源的结构复杂程度有关,大黄鱼对多糖(小麦淀粉、玉米淀粉和糊精)的利用能力要高于双糖(蔗糖)和单糖(葡萄糖)。本试验结果同大西洋鲑[13]、鲶鱼[14]、鳕鱼[15]、虹鳟[16]、罗非鱼[17]和军曹鱼[18]和团头鲂[19]糖利用的研究结果相似。然而,一些研究结果表明鱼类对葡萄糖和麦芽糖的利用能力好于糊精和淀粉等多糖[20-23],在对石斑鱼糖利用的研究中发现其对小麦淀粉和葡萄糖的利用效果相似[24]。有学者认为单糖如葡萄糖造成鱼类生长性能下降的主要原因可能是由于葡萄糖比多糖更易于被肠道消化吸收,葡萄糖进入鱼类血液后达到饱和造成的“负生理作用”引起的,这是因为,作为一种单糖,葡萄糖不需要经过消化就能很快被肠道吸收,而淀粉类多糖在被吸收之前必须经过消化道中消化酶的水解,因此,葡萄糖的快速吸收意味着在糖代谢酶活性提高之前,葡萄糖已进入血液,并通过肝脏进入鱼体,这将会限制鱼类对其利用,从而导致鱼类的生长性能变差[18]。鱼类对不同糖源利用的差异与鱼类的食性、消化道结构(尤其是肠道长短)、消化酶活性等内在因素有关,同时投喂方式以及环境因素也会影响到鱼类对糖的利用[18]。
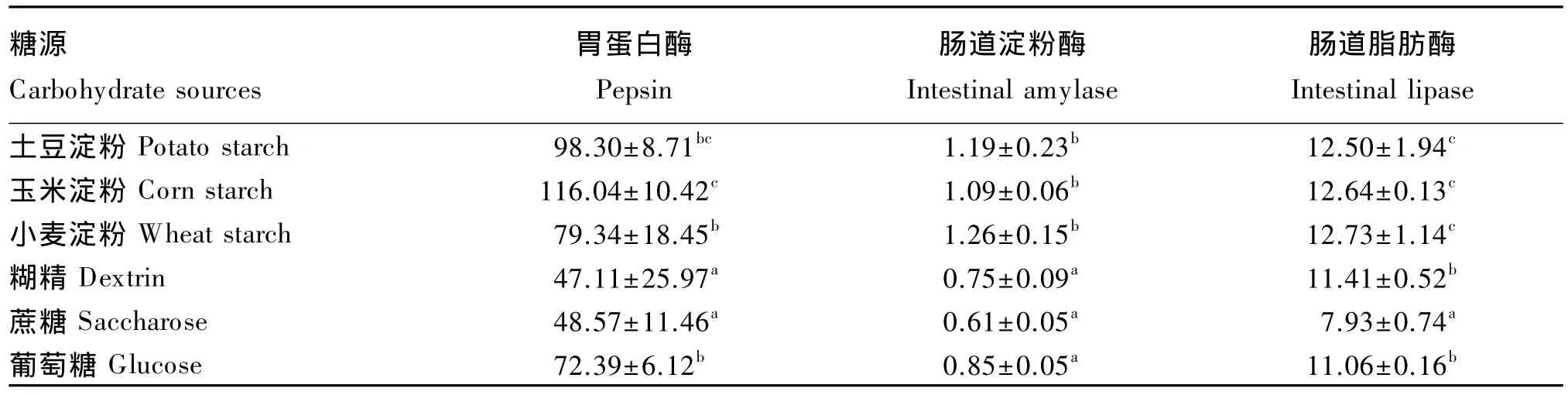
表7 饲料中糖源对大黄鱼消化道消化酶活性的影响Table 7 Effects of dietary carbohydrate sources on digestive enzyme activities in digestive tract of large yellow croaker(n=3) U/g

表8 饲料中糖源对大黄鱼肝脏糖代谢关键酶活性的影响Table 8 Effects of dietary carbohydrate sources on hepatic carbohydrate metabolic key enzyme activities of large yellow croaker(n=3) U/g
本试验中,饲料中糖源对大黄鱼的肝体比有显著影响,葡萄糖组大黄鱼肝体比显著高于其他各组,这同研究者对军曹鱼[18]、条纹鲈[9]和黄鳍鲷[25]的研究结果一致。有研究指出,投喂葡萄糖的鱼类脂肪主要沉积在肝脏,从而导致肝体比升高[24]。本试验中,葡萄糖组肝糖原含量显著高于各多糖组,肌糖元含量却显著低于各多糖组,这一结果同肝体比的升高相符。研究表明,在消化吸收过程中,糖原的合成与分解是同时进行的,化学里称之为底物循环,而葡萄糖无需经过消化可直接被吸收储藏[9]。如果糖原的合成快于分解,大部分糖原会储藏在肝脏;葡萄糖组的肝体比显著高于各多糖组,这说明其肝脏已累计大量肝糖原并致其破裂。全鱼水分、粗灰分和粗蛋白质含量各组间无显著差异,但土豆淀粉、玉米淀粉和小麦淀粉组的粗脂肪含量较高。已有研究表明,淀粉类多糖比单糖更易于鱼类吸收储藏[7,20],而脂肪是动物储藏能量的主要物质,因此淀粉组全鱼粗脂肪含量高于投喂二糖和单糖组。
已有研究表明,草食性与杂食性鱼类的淀粉酶活性要高于肉食性鱼类[26-27],淀粉酶活性主要由遗传因素决定,饲料中的糖水平对其活性没有显著影响[28-29],也有一些研究认为饲料中糖源及添加水平能提高淀粉酶活性[30]。本试验中,饲料中糖源对大黄鱼的淀粉酶活性有显著影响,以土豆淀粉、玉米淀粉和小麦淀粉组大黄鱼淀粉酶活性较高,说明饲料中添加淀粉能够提高淀粉酶活性。有研究认为饲料糖水平能够提高鱼类胃蛋白酶活性[27,31-32],但有研究显示饲料中过高水平的糖可抑制鲈鱼胃蛋白酶的活性[30]。本试验结果表明土豆淀粉、玉米淀粉和小麦淀粉组的胃蛋白酶和肠道脂肪酶活性显著高于其他各组,这可能因为本试验采样在停止投喂24 h后进行,此时鱼的主要能量来自脂肪的分解。
已有的研究表明缺乏GK是鱼类不能很好利用饲料糖的主要原因[33-36],但最近的研究证实鱼类肝脏中存在GK,且饲料中糖的添加水平能够影响GK的活性[37-38]。本试验结果表明,大黄鱼肝脏中存在GK,尽管不同糖源对其影响不显著。土豆淀粉、玉米淀粉、小麦淀粉和糊精组肝脏的PK活性显著高于蔗糖和葡萄糖组。有关糖源及添加水平对鱼类肝脏PK活性的影响结果不一致,Shikata等[39]对鲤鱼的研究表明糊精可降低PK的活性,Tan等[40]对鲤鱼和斑点叉尾 的研究也得到类似的结果,而Enes等[41]对鲈鱼的研究则表明葡萄糖能提高PK的活性,与本试验结果不一致。Lin等[42]认为不同糖源对 PFK活性没有影响,而Shikata等[39]对鲤鱼的研究认为半乳糖能降低PFK活性,本试验中土豆淀粉与小麦淀粉提高了PFK活性。
不同糖源对鱼类肝脏G6Pase活性影响的研究较多,但结果不甚一致。Shimeno等[43]的研究认为葡萄糖、果糖和糊精可降低鲤鱼G6Pase活性,Panserat等[44]对鲤鱼和海鲷的研究也得到类似的结果。但也有研究认为G6Pase的活性不受糖源及添加水平的影响[41,45]。本试验中,土豆淀粉、玉米淀粉、小麦淀粉和糊精组肝脏G6Pase活性显著高于蔗糖与葡萄糖组。研究者对虹鳟、大西洋鲑和鲈鱼的研究认为PEPCK活性不受饲料糖源及添加水平的影响[31],但也有研究认为饲料中糖水平能降低PEPCK活性[40]。本试验不同组之间的PCPCK活性存在显著差异,说明糖源能影响PEPCK活性。目前对FBPase的研究较少,从本试验结果可认为FBPase是一种保守酶,不受糖源的影响。
4 结论
综上所述,大黄鱼对淀粉类多糖如小麦淀粉、玉米淀粉和土豆淀粉等的利用效率要高于蔗糖和葡萄糖,小麦淀粉等结构复杂多糖为大黄鱼饲料中的优质糖源。
[1]WILSON R P.Utilization of dietary carbohydrate by fish [J].Aquaculture,1994,124(1/2/3/4):67-80.
[2]HEMRE G I,MOMMSEN T P,KROGDAHL A.Carbohydrates in fish nutrition:effects on growth,glucose metabolism and hepatic enzymes[J].Aquaculture Nutrition,2002,8(3):175-194.
[3]STONE D A J.Dietary carbohydrate utilization by fish[J].Reviews in Fisheries Science,2003,11(4):337-369.
[4]HIDALGO M C,UREA E,SANZ A.Comparative study of digestive enzymes in fish with different nutritional habits.Proteolytic and amylase activities[J].Aquaculture,1999,170(3/4):267-283.
[5]BAÑOS N,BARÓ J,CASTEJÓN C,et al.Influence of high-carbohydrate enriched diets on plasma insulin levels and insulin and IGF-Ⅰ receptors in trout[J].Regulatory Peptides,1998,77(1/2/3):55-62.
[6]NRC.Nutrient requirements of fish and shrimp[S].Washington,D.C.:National Academies Press,2011:135-162.
[7]FURUICHI M,YONE Y.Availability of carbohydrate in nutrition of carp and red sea bream[J].Nippon Suisan Gakkaishi,1982,48(7):945-948.
[8]WILSON R P.Channel catfish,Ictalurus punctatus[M]//WILSON R P.Handbook of nutrient requirements of finfish.Boca Raton,FL:CRC Press,1991:35-53.
[9]HUTCHINS C G,RAWLES S D,GATLIN D M Ⅲ.Effects of dietary carbohydrate kind and level on growth,body composition and glycemic response of juvenile sunshine bass(Morone chrysops♀×M.saxatilis )[J].Aquaculture,1998,161(1/2/3/4):187-199.
[10]MAI K S,WAN J L,AI Q H,et al.Dietary methionine requirement of large yellow croaker,Pseudosciaena crocea R[J].Aquaculture,2006,253(1/2/3/4):564-572.
[11]AOAC.Official methods of analysis[S].16th ed.Arlington:AOAC International,1995.
[12]HASSID W Z,ABRAHAM S.Chemical procedures for analysis of polysaccharides[J].Methods in Enzymology,1957,3:34-50.
[13]HEMRE G I,SANDNES K,LIE Ø,et al.Carbohydrate nutrition in Atlantic salmon,Salmo salar L.:growth and feed utilization[J].Aquaculture Research,1995,26(3):149-154.
[14]ERFAULAH A K J.Effect of dietary carbohydrate-tolipid ratio on growth and body composition of walking catfish(Clarias batrachus)[J].Aquaculture,1998,161(1/2/3/4):159-168.
[15]ROSENLUND G,KARLSEN Ø,TVEIT K,et al.Effect of feed composition and feeding frequency on growth,feed utilization and nutrient retention in juvenile Atlantic cod,Gadus morhua L.[J].Aquaculture Nutrition,2004,10(6):371-378.
[16]KIM J D,KAUSHIK S J.Contribution of digestible energy from carbohydrates and estimation of protein/energy requirements for growth of rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1992,106(2):161-169.
[17]SHIAU S Y,CHEN M J.Carbohydrate utilization by tilapia(Oreochromis niloticus×O.aureus)as influenced by different chromium sources[J].The Journal of Nutrition,1993,123(10):1747-1753.
[18]CUI X J,ZHOU Q C,LIANG H O,et al.Effects of dietary carbohydrate sources on the growth performance and hepatic carbohydrate metabolic enzyme activities of juvenile cobia(Rachycentron canadum Linnaeus.)[J].Aquaculture Research,2010,42(1):99-107.
[19]REN M C,HABTE-TSION H,XIE J,et al.Effects of dietary carbohydrate source on growth performance,diet digestibility and liver glucose enzyme activity in blunt snout bream,Megalobrama amblycephala[J].Aquaculture,2015,438:75-81.
[20]LIN X Z,LUO Y P,XIE X J.Effects of dietary carbohydrate level on glycolytic enzymes and serum glucose concentrations in the juvenile southern catfish after feeding[J].Acta Hydrobiologica Sinica,2006,30(3):304-310.
[21]HUNG S S O,STOREBAKKEN T.Carbohydrate utilization by rainbow trout is affected by feeding strategy[J].The Journal of Nutrition,1994,124(2):223-230.
[22]TIAN L X,LIU Y J,HUNG S S O.Utilization of glucose and cornstarch by juvenile grass carp[J].North American Journal of Aquaculture,2004,66(2):141-145.
[23]ENES P,PANSERAT S,KAUSHIK S,et al.Growth performance and metabolic utilization of diets with native and waxy starch by gilthead sea bream(Sparus aurata)juveniles[J].Aquaculture,2008,274(1):101-108.
[24]SHIAU S Y,LIN Y H.Carbohydrate utilization and its protein-sparing effect in diets for grouper(Epinephelus malabaricus)[J].Animal Science,2001,73(2):299-304.
[25]WU X Y,LIU Y J,TIAN L X,et al.Utilization of several different carbohydrate sources by juvenile yellowfin sea bream(Sparus latus)[J].Journal of Fisheries of China,2007,31(4):463-471.
[26]FU S J,XIE X J.Nutritional homeostasis in carnivorous southern catfish(Silurus meridionalis):is there a mechanism for increased energy expenditure during carbohydrate overfeeding?[J].ComparativeBiochemistry and Physiology Part A:Molecular&Integrative Physiology,2004,139(3):359-363.
[27]FU S J.The growth performance of southern catfish fed diets with raw,precooked cornstarch and glucose at two levels[J].Aquaculture Nutrition,2005,11(4):257-261.
[28]FANGE R,GROVE D.Digestion[M]//HOAR W S,RANDALL D J,BRETT J T.Fish physiology.Vol.8:bioenergetics and growth.New York:Academic Press,1979:161-260.
[29]UGOLV A M,YEGOROVA V V,KUZMINA V V,et al.Comparative-molecular characterization of membrane digestion in fish and mammals[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1983,76(3):627-635.
[30]MOYANO F J,DÍAZ M,ALARCÓN F J,et al.Characterization of digestive enzyme activity during larval development of gilthead seabream(Sparus aurata)[J].Fish Physiology and Biochemistry,1996,15(2):121-130.
[31]GERMAN D P,HORN M H,GAWLICKA A.Digestive enzyme activities in herbivorous and carnivorous prickleback fishes(Teleostei:Stichaeidae):ontogenetic,dietary,and phylogenetic effects[M].Fullerton,CA:California State University,2005.
[32]CAHU C L,RØNNESTAD I,GRANGIER V,et al.Expression and activities of pancreatic enzymes in developing sea bass larvae(Dicentrarchus labrax)in relation to intact and hydrolyzed dietary protein;involvement of cholecystokinin[J].Aquaculture,2004,238(1/2/3/4):295-308.
[33]HOFER R.Protein digestion and proteolytic activity in the digestive tract of an omnivorous cyprinid[J].Comparative Biochemistry and Physiology Part A:Physiology,1982,72(1):55-63.
[34]KUZMINA V V,GOLOVANOVA I L,IZVEKOVA G I.Influence of temperature and season on some characteristics of intestinal mucosa carbohydrases in six freshwater fishes[J].Comparative Biochemistry and Physiology,1996,113(2):255-260.
[35]NAGAYAMA F,OHSHIMA H.Study on the enzyme system of carbohydrate metabolism in fish.Ⅰ.Properties of liver hexokinase[J].Nippon Suisan Gakkaishi,1974,40:285-290.
[36]COWEY C B,KNOX D,WALTON M J,et al.The regulation of gluconeogenesis by diet and insulin in rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1977,38(3):463-470.
[37]TRANULIS M A,CHRISTOPHERSEN B,BLOM K A.Glucose dehydrogenase,glucose-6-phosphate dehydrogenase and hexokinase in liver of rainbow trout(Salmo gairdneri).Effects of starvation and temperature variations[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry1991,99(4):687-691.
[38]MOON T W,FOSTER G D.Tissue carbohydrate metabolism,gluconeogenesis and hormonal and environmental influences[J].Biochemistry and Molecular Biology of Fishes,1995,4:65-100.
[39]SHIKATA T,IWANAGA S,SHIMENO S.Effects of dietary glucose,fructose,and galactose on hepatopancreatic enzyme activities and body composition in carp[J].Fisheries Science(Tokyo),1994,60(5):613-617.
[40]TAN Q,XIE S,ZHU X,et al.Effect of dietary carbohydrate sources on growth performance and utilization for gibel carp(Carassius auratus gibelio)and Chinese longsnout catfish (Leiocassis longirostris güntherym)[J].Aquaculture Nutrition,2006,12(1):61-70.
[41]ENES P,PANSERAT S,KAUSHIK S,et al.Rapid metabolic adaptation in European sea bass(Dicentrarchus labrax)juveniles fed different carbohydrate sources after heat shock stress[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2006,145(1):73-81.
[42]LIN J H,SHIAU S Y.Hepatic enzyme adaptation to different dietary carbohydrates in juvenile tilapia Oreochromis niloticus×O.aureus[J].Fish Physiology and Biochemistry,1995,14(2):165-170.
[43]SHIMENO S,KHEYYALI D,SHIKATA T.Metabolic response to dietary carbohydrate to protein ratios in carp[J].Fisheries Sciences,1995,61(2):277-281.
[44]PANSERAT S,BLIN C,MÉDALE F,et al.Molecular cloning,tissue distribution and sequence analysis of complete glucokinase cDNAs from gilthead sea bream(Sparesaurata),rainbow trout(Oncorhynchus mykiss)and common carp(Cyprinus carpio)[J].Biochimica et Biophysica Acta:General Subjects,2000,1474(1):61-69.
[45]CASERAS A,METÓN I,VIVES C,et al.Nutritional regulation of glucose-6-phosphatase gene expression in liver of the gilthead sea bream(Sparus aurata)[J].British Journal of Nutrition,2002,88(6):607-614.

