固定化HPR催化降解染料废水中的刚果红
王亚丽等

摘要:研究了以固定化的辣根过氧化酶为催化剂,催化H2O2氧化降解刚果红染料,考察了影响刚果红染料降解率的几个重要因素,包括pH、温度、反应时间、H2O2浓度、染料初始浓度等,确定其最佳条件为pH 3.5,固定化酶用量0.5 g,H2O2浓度1.0 mmol/L,底物浓度0.1 mmol/L,反应温度40 ℃,反应时间30 min,降解率达到91.6%。催化剂重复使用4次后降解产率仍可达到22.0%,同时采用质谱对降解后的产物进行了分析。
关键词:刚果红染料;辣根过氧化物酶;固定化;降解
中图分类号:O643.3 文献标识码:A 文章编号:0439-8114(2015)18-4441-05
DOI:10.14088/j.cnki.issn0439-8114.2015.18.014
染料废水中含有多种具有生物毒性或导致人体病变的有机物,癌症与环境因子有关,致癌物是有毒的有机物,其中包含部分有机染料,如偶氮类染料,它占全球所用染料的80%,因其结构中的偶氮基常与一个或多个芳香环系统相连构成一个共轭体系作为染料的发色体,对人体有极不利的影响。据2004年统计我国每年大约有2×103~3×103 t的染料会直接随着废水排入环境中,而目前我国工业废水的治理率约为87.4%,治理合格率仅为处理总量的63%[1]。含有偶氮类染料的工业废水的特点是色度大,组成复杂,难降解,对环境的污染很大,同时因其化学性质较稳定,生物可降解性低,因此偶氮染料废水是公认的难治理的高浓度有机废水[2-5]。刚果红染料是典型的双偶氮染料,分子式为C32H22N6Na2O6S2,结构式如图1所示,它可以作为一种酸碱指示剂来使用,当pH小于3.5时为蓝紫色,当pH大于5.3时为红色。它也被广泛应用于纺织、造纸和印染等行业[2,3]。
目前,国内外常用的处理染料废水的方法有3大类:物理法、化学法和生物法。其中生物法因其处理方法简单易行,二次污染较少而备受关注[6,7]。生物法主要以酶作催化剂,辣根过氧化物酶(Horseradish Peroxidase,HRP)是血红素类过氧化物酶的一种,因其高效的催化性能已成为重要的生物催化剂。它可以处理一些难生物降解的人工合成染料,如含偶氮基团、多环类有机物、高聚物有机物,也被广泛用于有机合成、生物转化、发光检测、免疫检测、相关酶检测、临床化学、电化学、环境化学等领域。
本实验以海藻酸钠为载体,戊二醛作为交联剂,进行辣根过氧化物酶的固定化,并用固定化后的辣根过氧化物酶催化H2O2对双偶氮染料刚果红进行降解处理,通过紫外分光光度计的检测对降解条件进行优化,通过质谱对降解过程进行分析。
1 实验部分
1.1 试剂和仪器
辣根过氧化物酶(阿拉丁化学试剂有限公司);海藻酸钠(AR,阿拉丁试剂有限公司);无水氯化钙(AR,汕头市西陇化工厂);刚果红(指示剂,AR,阿拉丁试剂有限公司);30%的H2O2(国药集团化学试剂有限公司)。
紫外可见分光光度计(UV-1700型,岛津国际贸易上海有限公司);微量连续可调移液器(10-1 000 μL,上海艾本徳有限公司);液相色谱仪(LC-20AT,日本岛津制作所);电喷雾质谱仪(MS5973,德国布鲁克公司)。
1.2 实验方法
1.2.1 辣根过氧化物酶的固定化 将1.25 g海藻酸钠加热溶解于25.0 mL水中,缓慢加入2.5 mL 浓度为0.097 0 g/mL的辣根过氧化物酶溶液,置于恒温振荡器中振荡10 min,使酶与海藻酸钠溶液混匀,再分别加入10.0 mL浓度为1.0 mol/L的氯化钙溶液,继续在恒温振荡器中振荡20 min,然后取出静置6 h 后,用蒸馏水充分洗涤5次,然后将固定化辣根过氧化物酶转移至5%的戊二醛溶液中,于30 ℃下交联1 h。再用生理盐水洗涤8次,尽可能去除残余的戊二醛[8-11]。将制备好的固定化酶置于4 ℃冰箱中备用[12]。
1.2.2 磷酸盐缓冲溶液的配制 配置0.1 mol/L的pH为1~8的磷酸缓冲溶液备用,因为酶催化降解一般都在某一稳定的pH下进行。
1.2.3 刚果红染料溶液的配制 准确称取0.174 2 g刚果红于50 mL容量瓶中定容,用超纯水配制成浓度为5 mmol/L的染料储备液,以备稀释成所需不同浓度的刚果红染料溶液。溶液均置于阴暗干燥处保存。
1.2.4 刚果红染料特征吸收波长的确定及标准曲线的绘制 在紫外-可见分光光度计上,用1 cm的石英比色皿,以超纯水为参比,在400~540 nm的波长范围内对刚果红染料溶液扫谱,每隔10 nm记录不同波长下的吸光度,绘制吸收曲线,如图2所示,确定其特征吸收波长为488 nm。
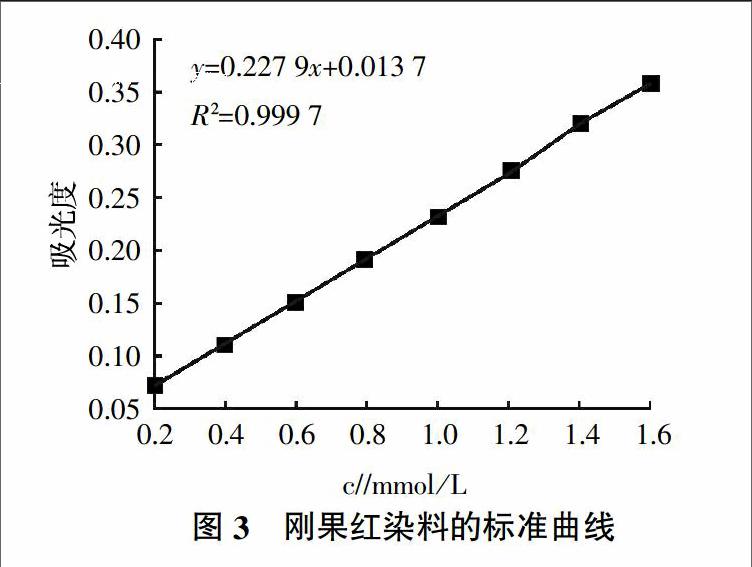
在5.0 mL的离心管中,加入1 800 μL pH为2的磷酸缓冲溶液、200 μL 不同浓度的刚果红染料溶液,30 ℃恒温10 min,取出溶液加入到1.0 cm的石英比色皿中测定不同浓度的刚果红染料溶液在其特征吸收波长488 nm处的吸光度,以吸光度-浓度作图得出刚果红染料的标准曲线,如图3所示,刚果红的初始浓度在0.2~1.6 mmol/L间呈线性关系。因此,把该浓度范围应用于刚果红降解的整个实验中。
1.2.5 脱色率的计算 用紫外可见分光光度计测定刚果红在其特征吸收波长488 nm处的吸光度值,按下面公式计算染料脱色率:
η=(A0-At)/A0×100%
式中,η为刚果红的脱色率,A0为刚果红的初始吸光度,At为t时刻刚果红的吸光度。
2 结果与分析
2.1 固定化HPR用量对染料刚果红降解的影响
将固定好成凝胶状的HPR分别称取0.1、0.3、0.5、0.7、0.9 g加入到200 μL 底物浓度为0.1 mmol/L的刚果红染料溶液中,使反应体系的pH为4,在40 ℃的恒温槽中进行试验,加入1.0 mmol/L H2O2溶液反应。该染料较易被固定化的辣根过氧化物酶降解,反应25 min后不同用量的固定化HPR对染料刚果红的脱色率分别为54.3%、71.2%、82.9%、82.2%、81.8%。当酶用量在0.5 g以上时,随着酶用量的增加,刚果红染料的脱色率基本不变。因此,选择固定化HPR的用量为0.5 g。
2.2 缓冲溶液pH对固定化HPR降解染料刚果红的影响
将不同pH的缓冲溶液加入5 mL离心管中,各加入200 μL 1.0 mmol/L的刚果红溶液,然后分别加入1.0 mmol/L的H2O2溶液,最后加入固定化酶,恒温40 ℃,反应时间为25 min,考察不同pH的磷酸缓冲溶液对染料脱色降解率的影响,结果如图4所示。在pH为3.5时降解率最大,为83.2%,而当pH在2~3时对降解率影响不大,当pH大于4时降解率逐渐下降。所以,最佳pH为3.5。pH越大,降解率越低,这主要因为刚果红是一种酸性染料,pH越大,固定化辣根过氧化物酶对底物的作用能力减弱。
2.3 H2O2浓度对固定化HPR降解染料刚果红的影响
根据上述试验方法,使反应保持pH为3.5、反应温度、反应时间、酶用量等条件同上,考察H2O2浓度对降解率的影响。选取H2O2浓度范围0.2~2.0 mmol/L,结果如图5所示。由图5可知,在H2O2的浓度为1.0 mmol/L时降解率最大,此时降解效果最好,降解率为84.3%,如果H2O2浓度继续增大,对降解率影响不大,所以最佳H2O2的浓度为1.0 mmol/L。
2.4 反应时间对固定化HPR降解染料刚果红的影响
缓冲溶液保持pH为3.5,恒温槽的温度为40 ℃,氧化剂H2O2的浓度为1.0 mmol/L,底物浓度0.1 mmol/L,选取反应时间5~40 min,考察反应时间对染料脱色降解的影响。从图6中可以看出,开始反应时随着时间的延长降解效果越来越好,当反应持续到30 min时降解率达到最大值,此时降解率为85.0%,而当反应继续进行,降解率基本保持不变,所以最佳反应时间为30 min。
2.5 温度对固定化HPR降解刚果红的影响
为了提高降解效率,继续考察反应温度对降解率的影响,缓冲溶液保持pH为3.5,氧化剂H2O2的浓度为1.0 mmol/L,底物浓度0.1 mmol/L,反应时间30 min,选取温度分别为15、20、30、40、50、60、70 ℃,考察反应温度对刚果红染料降解率的影响。由图7可以看出,固定化的HRP在40 ℃时的活性最高,降解率达到89.4%,而随着温度的升高,酶活性逐渐下降,导致降解效果变差,所以选取最佳反应温度为40 ℃。
2.6 染料初始浓度对固定化HPR降解刚果红的影响
对染料的初始浓度进行考察,保持缓冲溶液的pH为3.5,恒温槽的温度为40 ℃,氧化剂H2O2的浓度为1.0 mmol/L,反应时间为30 min,选取不同的底物浓度:0.05、0.1、0.2、0.3、0.4、0.5 mmol/L,考察不同的底物浓度对降解率的影响。由图8可以看出,不同的底物浓度对降解率影响较大,随着底物浓度的增大,降解率逐渐减小,本实验的最佳底物浓度为0.1 mmol/L,降解效率达到91.6%。
通过以上试验得出降解的最佳条件:pH为3.5,固定化酶用量为0.5 g,过氧化氢浓度为1.0 mmol/L,底物浓度为0.1 mmol/L时,在40 ℃的恒温槽中加热反应30 min得到最大降解率为91.6%。
2.7 固定化HPR的最大循环次数
将0.5 g 固定化辣根过氧化物酶和pH为3.5的缓冲溶液加入至200 μL底物浓度为0.1 mmol/L的刚果红染料液中,最后加入浓度为1.0 mmol/L的H2O2溶液,在40 ℃恒温槽中降解反应,30 min后反应结束,计算降解率;然后将反应液进行处理,滤去所有液体,剩下固定化的HPR。并用适量的缓冲液洗涤固定化HPR 4~5次,然后加入相同浓度和体积的刚果红溶液,在相同条件下进行新的实验,如此重复4次。由图9可以看出,随着固定化HPR降解染料次数的增加,染料脱色率逐渐降低。酶重复使用4次后,刚果红染料的脱色率从91.5%下降至22.0%。
2.8 染料降解产物的质谱分析
为确定降解产物,对刚果红染料的降解产物进行质谱分析。反应后的混合液用乙酸乙酯萃取3次,有机相合并后旋转蒸干,用甲醇溶解,质谱分析。结果如图10所示。在正负不同离子模式下的质谱图。
据报道,偶氮染料的氧化降解在文献中提出了2个重要的途径:一个对称的偶氮键断裂和一个不对称的[13,14]偶氮键断裂。Lopez等[15]研究表明,用锰过氧化物酶降解橙黄Ⅱ溶液时2种断裂方式都存在,所用的分析方法为1H NMR和ESI-MS质谱分析。本实验采用ESI-MS质谱分析,对降解产物的推测结果表1所示。
根据表1推测了刚果红降解的一种可能途径。首先,刚果红的2个偶氮双键发生断裂,分解成两分子的1,8-二氨基-3-萘磺酸钠和一分子的4,4-二氨基联苯;接着,分解成的4,4-二氨基联苯中的氨基也会被氧化成为亚硝基,又生成4,4-二亚硝基联苯,又被氧化成硝基,生成4,4-二硝基联苯,如果继续氧化,可能导致联苯断裂,生成苯酚、苯二氮烯等小分子物质。同样,生成的1,8-二氨基-3-萘磺酸钠中的氨基被氧化成亚硝基,生成1,8-二亚硝基-3-萘磺酸钠,亚硝基进一步被氧化成硝基,形成1,8-二硝基-3-萘磺酸钠。当然,刚果红分子本身结构较为复杂,并带有相当多的官能团,因此所推断的产物可能只是其降解过程中生成产物的一部分。降解过程主要利用电子得失,使不饱和键断开,将大分子的发色基团氧化分解成无色无毒或毒性较小的小分子物质,最终达到降解目的。
3 结论
研究结果表明固定化的辣根过氧化物酶完全可以降解刚果红染料,而且固定化的辣根过氧化物酶跟辣根过氧化物酶溶液相比,能够重复使用,这样不仅可以节约成本,而且可以提高降解率。同时本降解途径采用的氧化剂为H2O2,符合绿色降解的要求。对降解产物的质谱分析证实了固定化辣根过氧化物酶催化H2O2氧化偶氮染料刚果红经水解酸化降解成了结构更简单的中间产物。本研究作为探究性实验,其主要目的是用于工业废水的处理,通过实验说明固定化的辣根过氧化物酶确实可以对染料刚果红进行降解。
参考文献:
[1] 杨新玮.近两年我国染料品种的发展[J].染料与染色,2004, 41(1):51-57.
[2] TORRES E D,BUSTOS-JAIMES I. Potential use of oxidative enzymes for the detoxification of organic pollutants[J]. Applied Catalysis B: Environmental,2003,46(1):1-15.
[3] SILVA C G,FARIA J L. Photochemical and photocatalytic degradation of an azo dye in aqueous solution by UV irradiation[J]. Journal of Photochemistry and Photobiology A: Chemistry,2003,155(1-3):133-143.
[4] HAO O J, KIM H, CHIANG P C. Decolarization of wastewater[J]. Critical Reviews in Environmental Science and Technology,2000,30(4):449-505.
[5] BOKARE A D, CHIKATE R C, RODE C V, et al. Iron-nickel bimetallic nanoparticles for reductive degradation of azo dye orange G in aqueous solution[J]. Applied Catalysis B-Environmental,2008,79(3):270-278.
[6] ZHANG J, FENG M Y, JIANG Y C, et al. Efficient decolorization/degradation of aqueous azo dyes using buffered H2O2 oxidation catalyzed by a dosage below ppm level of chloroperoxidase[J]. Chemical Engineering Journal,2012,191(5):236-242.
[7] 陈益宾,王绪绪,付贤智,等.偶氮染料刚果红在水中的光催化降解过程[J].催化学报,2005,26(1):37-42.
[8] ZHANG H Z,JIANG Y C,HU M C,et al.Biotransformation of cyclohexene to value-added oxygenated derivative catalyzed by chloroperoxidase in the presence of small quantities of quaternary ammonium salts[J]. Applied Catalysis,2011,401(1):204-209.
[9] 许松伟,张 杰,杨占平,等.载体对包埋酶微环境的影响分析[J].化学进展,2008,20(1):163-170.
[10] 李 伟,孙建中,周其云.适用于酶包埋的高分子载体材料研究进展[J].功能高分子学报,2001,14(3):365-369.
[11] BRAUN S, RAPPOPORT S,ZUSMAN R,et al. Biochemically active sol-gel glasses: The trapping of enzymes[J]. Materials Letters,1990,10(1-2):1-5.
[12] CUMANA S,SIMONS J,LIESE A,et al. Immobilization of glucose 6-phosphate dehydrogenase in silica-based hydrogels: A comparative study[J]. Journal of Molecular Catalysis B-Enzymatic,2013,85-86(2):220-228.
[13] SPADARO J T, RENGANATHAN V. Peroxidase-catalyzed oxidation of azo dyes:Mechanism of disperse yellow 3 degradation[J]. Archives of Biochemistry and Biophysics,1994, 312(1):301-307.
[14] CHIVUKULA M,SPADARO J T,RENGANATHAN V. Lignin peroxidase-catalyzed oxidation of sulfonated azo dyes generates novel sulfophenyl hydroperoxides[J]. Biochemistry,1995,34(23): 7765-7772.
[15] LOPEZ C,VALADE A G,COMBOURIEUC B,et al. Mechanism of enzymatic degradation of the azo dye orange II determined by ex situ 1H nuclear magnetic resonance and electrospray ionization-ion trap mass spectrometry[J]. Analytical Biochemistry,2004,335(1):135-149.

