麻黄内生真菌的初步研究
于淼等

摘要:从宁夏回族自治区贺兰山高盐碱地区采集的麻黄样本中分离得到7株内生真菌,体外抗氧化活性测定表明,所分离到的内生真菌中有5株具有较高的抑制羟基自由基能力;有5株菌的发酵液具有中等强度的总抗氧化能力。在抗菌活性测定中,所分离到的7株麻黄内生真菌对细菌指示菌大肠杆菌和金黄色葡萄球菌均表现出一定的抑菌作用,但对真菌指示菌炭疽杆菌和黑曲霉均未检测到抑菌活性。
关键词:麻黄(Ephedra sinica);内生真菌;抗菌活性;抗氧化活性
中图分类号:S432 文献标识码:A 文章编号:0439-8114(2015)18-4482-03
DOI:10.14088/j.cnki.issn0439-8114.2015.18.023
自1898年Vogl从黑麦草(Lolium temulentum L.)种子内将第一株内生真菌分离出来至今,已有100多年的历史,但是最近20年才正式开展药用植物内生真菌的研究[1]。1993年美国Montana州大学植物病理系博士Stierle等分离红豆杉韧皮部的内生真菌,得到产生化合产物紫杉醇的内生真菌[2]。该类菌株的发现使得微生物学者的目光都放在植物,特别是药用植物内生真菌的代谢产物研究上。这类研究使得目前致病菌对抗生素的耐药性蔓延起到了至关重要的改善作用。
在自然界存在很多极端环境,如高盐、高碱、高酸、高干旱、高压以至高浓度重金属离子和低营养等环境为一般生物生长和存活的极限,但却能生长着相应的、能适应这些极端环境的植物和微生物。这些生物经长期自然选择,具备了较强且稳定的特殊结构、机能和遗传基因,以应答强烈的限制因子[3]。宁夏回族自治区位于西北地区东部、黄河中上游,地处中温带半干旱、干旱区,降水稀少(平均年降水量292 mm),蒸发强烈(水面蒸发量1 296 mm),当地水资源总量为1 117亿m3,仅占全国水资源总量的0.104%。近年来,引黄灌区的土壤盐渍化问题受到了宁夏自治区的高度关注,银川北部地区盐碱地已占总耕地面积的49%以上[4]。所以,宁夏贺兰山地区的土地盐碱化程度高,本试验选取该地区高盐碱环境下生长的麻黄作为极端环境下的研究样本。
木贼麻黄(E.equisetina Bunge)、草麻黄(E.sinica Stapf)和中麻黄(E.intermedia Schrenk ex Mey)主要被《中国药典》1985年版收载作为药用的麻黄植物。从麻黄的作用和功效上看,其具有利水消肿、宣肺平喘、发汗散寒等功效,在中医医学上受到广泛地利用[5]。本研究以宁夏回族自治区盐碱地生长的草麻黄为样本,对麻黄根、茎、叶分别进行了内生真菌的分离、纯化,并对得到的内生真菌进行了抗菌活性、抗氧化活性的测定。对极端环境下药用植物内生真菌的研究,探讨在外界恶劣环境下,植物与内生真菌之间协同抵御环境影响的关系,并期望从中分离筛选出具有高生物活性的内生真菌菌株。
1 材料与方法
1.1 试验样品
选取宁夏回族自治区银川市贺兰山区采集的麻黄。采集时间为2014年4~5月。采集麻黄新鲜枝叶,以体积分数为75%乙醇擦拭表面后装入保鲜袋,4 ℃封存。
1.2 指示菌
抗菌试验指示菌:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphalococcus aureus)、炭疽杆菌(Bacillus anthraci)、黑曲霉(Aspergillus niger),均为本实验室保存菌悬液。
1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,加去离子水煮沸30 min,8层纱布过滤,滤液加入葡萄糖20 g,去离子水定容至1 000 mL,并加入2%~2.5%的琼脂制成固体培养基。121 ℃高压灭菌30 min。
马铃薯葡萄糖培养基(PDB):去皮马铃薯200 g,加去离子水煮沸30 min,8层纱布过滤,滤液加入葡萄糖20 g,去离子水定容至1 000 mL。121 ℃高压灭菌30 min。
牛肉膏蛋白胨培养基(NA):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂15~20 g,加入去离子水定容至1 000 mL,校正pH至7.2~7.4。121 ℃高压灭菌30 min。
1.4 仪器与设备
ZSD-1160全自动新型生化培养箱、KYC-11021C恒温培养摇床、台式高速冷却离心机、T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司)、Multicontrol12L/18L型高压灭菌锅、PB303-E电子天平(METTLER-TOLEDO仪器公司)、北京长源水浴控温仪(北京长源实验设备厂)、R201D-11旋转蒸发仪(上海亚荣生化仪器厂)、超净工作台、试管、烧杯、锥形瓶。
2 试验方法
2.1 内生真菌的分离
试验方法参照文献[6~9],将采集来的麻黄置于水槽中用流动水冲洗5 min,将麻黄置于滤纸上自然风干。将风干的麻黄分为根、茎、叶三部分,分别剪成大小为2~3 cm的组织块,在超净工作台再将样品剪成0.5 cm×0.5 cm大小,并用体积分数为75%的乙醇浸泡1 min,去离子水漂洗2次;在2.5%的次氯酸溶液中浸泡2 min,去离子水漂洗3次。置于滤纸上风干后,接种于含有磷酸庆大霉素的PDA培养基中(每皿3~4个组织块)。置于恒温培养箱中,28~30 ℃培养5~7 d,12 h观察一次,48 h内长出的菌丝,均用无菌解剖刀连培养基切去。48 h后,将组织块边缘菌丝挑至另外PDA斜面进行分离培养,保种。
2.2 内生真菌的纯化
将分离出的菌种再次进行恒温培养(此次培养基中不加磷酸庆大霉素),28~30 ℃培养5~7 d,48 h后将长出的菌落边缘菌丝挑至新配制的PDA培养基中。进行3~4次重复培养。培养完成后将菌种挑至斜面进行保种。
2.3 内生真菌的发酵
将上述经纯化的内生真菌接种于PDA培养基中活化(28~30 ℃),5 d后配制液体培养基PDB,将经活化的内生真菌单个菌落的1/4用无菌解剖刀连培养基切下,放入PDB中,置于恒温摇床进行发酵。发酵时间为14 d。发酵结束后,将发酵液经8层纱布过滤,以8 000 r/min速度离心10 min。离心结束后,取上清液进行旋蒸,冷却至室温后置于洗净的锥形瓶中,4 ℃保存备用。
2.4 抗氧化活性的测定
2.4.1 抑制羟自由基能力测定 根据Fenton反应测定样品对羟自由基的抑制作用。采用南京建成公司生产的羟自由基测定试剂盒(货号:A018 50T/48样),依据其说明配制应用液。应用液在37 ℃水浴中预温3 min,并在水浴锅中完成空白管、标准管、对照管和测定管的添加工作。混匀,37 ℃反应1 min(以秒表计时),加入显色剂终止反应,一次做一支试管。再次混匀后室温放置20 min,而后以波长550 nm,1 cm光径,去离子水调零,测定各管的吸光值。
抑制羟自由基能力(U/mL)
=■×标准品浓度(8.824 mmol/L)×■×样本测试前稀释倍数。
2.4.2 总抗氧化活性测定 机体中有许多抗氧化物质,能将Fe3+还原成为Fe2+,后者可与斐林类物质形成稳固的络合物。采用南京建成公司生产的总抗氧化(T-AOC)测定试剂盒,依据说明书配制应用液。按要求加入相应的应用液,充分混匀后,37 ℃水浴30 min,向测定管和对照管中加入内生真菌发酵液。再次混匀后放置10 min,而后以波长520 nm,1 cm光径,去离子水调零,测定各管的吸光值。
总抗氧化能力(U/mL)=
■×■×样本测试前稀释倍数。
2.5 抗菌活性的测定
取滤纸,用打孔器将滤纸打成直径约0.5 cm的滤纸片,经高压灭菌锅灭菌后备用。取本实验室保存的指示菌大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、炭疽杆菌(Bacillus anthraci)、黑曲霉(Aspergillus nige)进行活化培养,将经活化的指示菌接种于培养基中,并在接种位置附近放置经内生真菌发酵液浸泡的滤纸片。恒温培养24 h后,测量滤纸片边缘产生的抑菌圈大小。
3 结果与分析
3.1 麻黄内生真菌的分离
用组织切片培养法从麻黄组织的叶片内、茎和根部中共分离得到7株内生真菌,其中叶片内分离出2株、茎4株、根部1株。本试验分离到的麻黄内生真菌数量较少,可能是由于麻黄生长环境特殊所致;也可能是由于前期植物样品经消毒、灭菌的时间长、过于彻底导致。
3.1 抗氧化活性测定
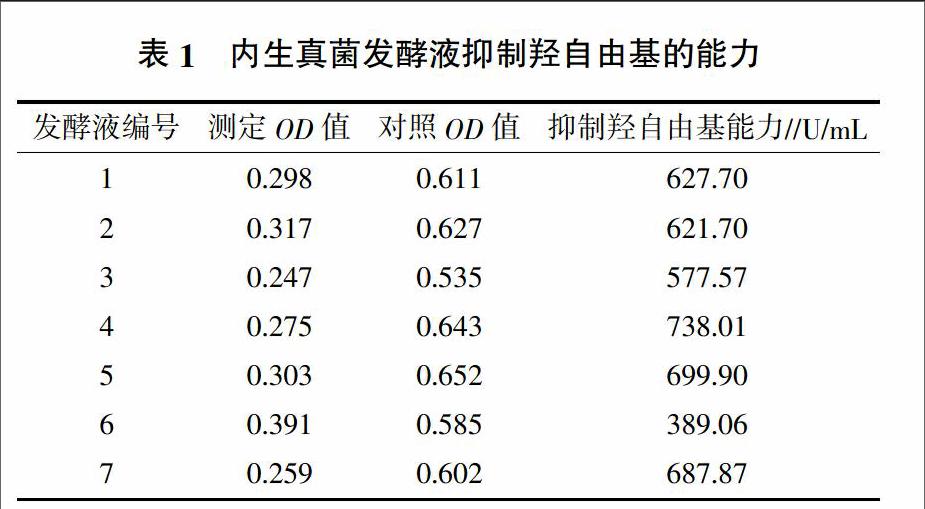
3.1.1 抑制羟基自由基能力 经羟基自由基测定试剂盒测定,7株麻黄内生真菌发酵液经稀释20倍后抑制羟基自由基的能力如表1所示。
用相同方法测得维生素C的抑制羟基自由基能力为908.47 U/mL。与维生素C的抑制羟基自由基能力相比较,7种内生真菌发酵液中,除3号和6号抑制羟基自由基能力弱以外,其余5株麻黄内生真菌发酵液均具有较高的抑制羟基自由基能力。
3.1.2 总抗氧化测定 经总抗氧化(T-AOC)测定试剂盒测定,7株麻黄内生真菌发酵液总抗氧化能力如表2所示。
用相同方法计算维生素C的总抗氧化能力为43.78 U/mL。由表2可知,7种内生真菌发酵液中,2号和6号菌株发酵液的总抗氧化能力较弱,其余5株麻黄内生真菌具有中等强度的总抗氧化活性。
3.2 抗菌活性测定
以金黄色葡萄球菌(SA)、大肠杆菌(EC)、炭疽杆菌(BA)、黑曲霉(AN)作为指示菌,采用滤纸片法对分离的7株麻黄内生真菌进行抗菌活性测定。抑菌结果见表3。
由表3可知,在7株供试菌中,对细菌类的大肠杆菌和金黄色葡萄球菌均有一定的抑制作用,但对真菌类的炭疽杆菌和黑曲霉均无抑菌作用。其中有5株对金黄色葡萄球菌显示出了较强的抗菌活性。
4 小结与讨论
中国中草药资源丰富,使用年代久远,中草药是具有价值的药用资源[10]。麻黄作为一种传统的中药材在民间和中医中广泛采用。本研究选取宁夏回族自治区贺兰山盐碱化较重地区生长的麻黄作为试验材料,分离得到7株内生真菌。在麻黄内生真菌的抗氧化活性测定中,选取抗氧化活性较强的维生素C作为阳性对比,有5株显示出中等强度的总抗氧化活性,5株显示出较强抑制羟自由基能力。样品的抗菌活性分析中,滤纸片法测定结果显示,各株麻黄内生真菌对于大肠杆菌和金黄色葡萄球菌等细菌具有一定的抑菌活性,但对炭疽杆菌和黑曲霉等真菌无抑菌作用。
本研究对宁夏回族自治区盐碱化地区生长的药用植物麻黄进行了内生真菌的初步分离,并对其生物活性进行了初步探讨,为药用植物内生真菌的研究添加了植物样本。同时,对内生真菌生物活性研究为从特殊生境的药用植物中得到结构新颖的药物先导化合物奠定了基础,对药用植物的保护与合理开发利用意义重大。
参考文献:
[1] 华永丽,欧阳少林,陈美兰,等.药用植物内生真菌研究进展[J].世界科学技术—中医药现代化,2008,10(4):105-111.
[2] 常明进,李春强,彭 明.天然药物紫杉醇的研究与开发[J].安徽农业科学,2006,34(2):257-258.
[3] 范光南,傅世宗,蔡海洋.极端环境微生物的研究概况[J].福建热作科技,2000,25(2):12-15.
[4] 李 茜,孙兆军,秦 萍.宁夏盐碱地现状及改良措施综述[J].安徽农业科学,2007,35(33):10808-10810,10813.
[5] 聂 毅,张洪林.中草药麻黄和益母草中的生物碱对金黄色葡萄球菌代谢作用的微量量热法研究[J].化学世界,2005(3):133-136,154.
[6] TAECHOWISAN T,PEBERDY J F,LUMYONG S. Isolation of endophytic actinomycetes from selected plants and their antifungal activity[J]. World Journal of Microbiology and Biotechnology,2003,19(4):381-385.
[7] 何 颖,谈 锋,谢建平.红豆杉内生真菌产紫杉醇研究进展[J].天然产物研究与开发,2006(18):519-523,513.
[8] LI Y,SONG Y C,LIU J Y,et al. Anti-Helicobacter pylori substance from endophytic fungal culture[J].World Journal of Microbiology and Biotechnology,2005(21):553-558.
[9] 廖友媛,曾松荣,马建波,等.药用植物辣木内生真菌的分离及其抗菌活性分析[J].株洲工学院学报, 2006,20(6):36-38.
[10] KUO Y C,LIN Y L,LIU C P,et al. Herpes simplex virus type propagation in Hela cells interrupted by Nelumbo nucifera[J]. Journal of Biomedical Science,2005,12(6):1021-1034.

