3D纸基微流控分析器件测定药物中抗坏血酸的研究
玄翠娟, 王 荣, 闫宏涛
(西北大学化学与材料科学学院,陕西西安 710127)
抗坏血酸(AA)是一种重要的生物分子[1],它参与众多生命过程,在人体中起着重要的作用,如胶原蛋白的形成、离子吸收、神经传递和免疫反应及抗氧化作用等[2]。在临床中,AA已用于普通感冒、精神疾病、不孕不育等疾病的预防和治疗[3]。在食品加工行业,AA作为抗氧化剂和必要的添加剂,广泛应用于食品和饮料中[4]。然而,AA的过量摄取会导致腹泻、胃酸过多和肾脏结石,而饮食中AA的缺乏亦会导致坏血病[5]。因此,研究并建立一种简单快速、现场实时测定AA的分析方法具有十分重要的实际意义和应用价值。
目前,AA的测定方法已报道的有分光光度法[6]、高效液相色谱法[7]、电化学法[8]和荧光法[9]等。但这些方法均需要特定仪器,难以进行现场测定,尤其在偏远地区以及家庭卫生保健等的应用中有一定的局限性[5]。纸基微流控分析(μPADs)具有制作简单,成本低,易于储存和运输,使用方便等优点,自2007年Martinez等[10]首次提出以来,引起了人们的极大关注[11]。已有许多μPADs的制作方法和测定方法的研究报道[12,13],但鲜有对于μPADs分析过程中反应时间进行控制的报道。
本文报道了一种可手动折叠的新型3D纸基微流控分析器件。采用不同的方法固化试剂于器件测定滤纸。基于折叠器件滤纸以控制各步反应时间,避免了试剂间的交叉影响。该纸基微流控分析器件具有制作简单、灵敏,成本低廉,操作方便,适用于现场实时测定等特点。建立的方法应用于药物中AA的测定,获得满意结果。
1 实验部分
1.1 仪器及试剂
UV-2550型紫外-可见分光光度计(日本,岛津公司);SONY DSC-W100数码相机;V350型扫描仪(爱普生中国(上海)有限公司)。滤纸(Φ=9 cm,杭州新华双圈定性滤纸)。
AA标准溶液(0.005 mol/L):准确称取0.0440 g AA(天津登峰化学试剂厂),溶解后定容于50 mL棕色容量瓶中,使用时,稀释该标准溶液于一定浓度。Fe3+溶液(0.02 mol/L):准确称取0.5091 g Fe2(SO4)3(天津耀华化工厂),以适量H2SO4和水溶解,定容于100 mL容量瓶中。1,10-菲罗啉溶液(Phen,0.05 mol/L):准确称取0.9911 g 1,10-菲罗啉(上海山浦化工有限公司),溶解并定容于100 mL容量瓶中。NaF溶液(0.2 mol/L):准确称取0.84 g NaF,溶解后定容于100 mL容量瓶中。HAc-NaAc缓冲溶液(pH=5.0):采用0.1 mol/L HAc和0.1 mol/L NaAc溶液配制,酸度计校正pH。正硅酸乙酯(天津科密欧化学试剂公司)。实验所用试剂均为分析纯。水为二次蒸馏水。
1.2 溶胶-凝胶溶液的合成
分别移取2 mL正硅酸乙酯和2.5 mL无水乙醇于烧杯中,混合均匀,缓慢加入3%的Triton X-100溶液1 mL,充分搅拌;再加入1 mL 0.1 mol/L HCl,连续搅拌直至形成澄清的溶液,室温静置2~3 h。将该溶胶-凝胶溶液密封保存于4 ℃冰箱中,备用[14]。
1.3 纸基微流控器件的制备及测定
3D纸基微流控器件制备及其实物照片分别如图1A、1B所示。图1A中所示a、b、c、d滤纸片上(8×8 mm)分别固定有Fe3+溶液、NaF溶液、HAc-NaAc缓冲溶液和1,10-菲罗啉溶液。具体步骤如下:分别准确移取1.429 mL 1,10-菲罗啉溶液和0.571 mL溶胶-凝胶溶液,配制1,10-菲罗啉/溶胶-凝胶混合溶液(体积比5∶2)。接着,裁取如图1A所示形状的滤纸(8×8 mm)、疏水纸和基体纸片。分别移取25 μL Fe3+溶液、NaF溶液、HAc-NaAc缓冲溶液,以及25 μL 1,10-菲罗啉/溶胶-凝胶混合液滴加于a、b、c、d滤纸片上,待阴干后,按照图中所示顺序分别粘贴固定有Fe3+溶液、NaF溶液、HAc-NaAc缓冲溶液和1,10-菲罗啉/溶胶-凝胶混合液的滤纸于折叠的疏水基体纸片上,制备成3D纸基微流控分析器件。为了携带方便,并目视该器件测定过程显色变化,器件整体固定于一透明玻璃盒内(图1A)。

图1 3D -μPAD制作过程示意图(A)和整个器件的照片图(B)Fig.1 Schematic of preparation procedure of 3D-μPAD(A) and photograph of the entire device(B)
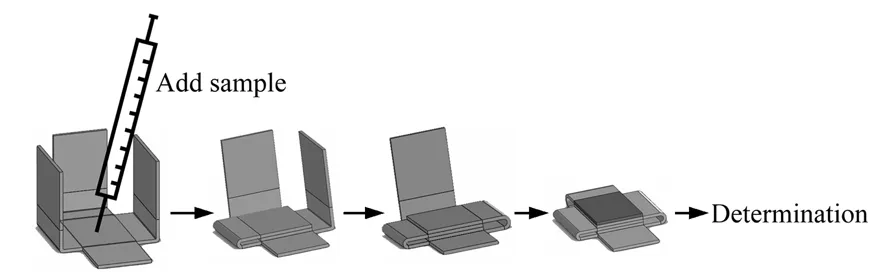
图2 AA的测定步骤示意图Fig.2 Diagram of the assay procedure for determination of AA
该纸基微流控分析器件测定过程如图2所示。采用注射器滴加一定量的AA标准溶液或待测样品于固定有Fe3+的滤纸片上,反应2 min后,再按照图2所示顺序依次折叠已固定有NaF溶液、HAc-NaAc缓冲溶液和1,10-菲罗啉/溶胶-凝胶混合溶液的a、b、c、d滤纸,20 min后(可目视显色的变化),以数码相机拍照,并用Adobe Photoshop图像处理软件处理颜色信号,计算灰度值(Gray)。为了避免外界光照等环境因素对器件的影响,该器件置于黑色塑料袋中,于4 ℃密闭避光条件下保存备用。
2 测定原理
实验中,采用该3D纸基微流控分析器件进行AA测定,是基于如下氧化还原和配位反应:
(1) AA将Fe3+还原为Fe2+,即:

其中,H2A是AA的还原形式,DA为AA的氧化形式。
(2) 生成的Fe2+与1,10-菲罗啉(Phen)发生配位反应得到橙红色配合物
3 结果与讨论
3.1 实验条件的优化
3.1.1Fe3+浓度的选择实验考察了Fe3+浓度对测定的影响,结果如图3所示。表明随着Fe3+浓度的增大,体系灰度值(Gray)随之增大。在Fe3+浓度为0.015 mol/L时,体系灰度值基本保持不变。Fe3+浓度太低时,AA不能被完全氧化,但Fe3+浓度过大时,过量的Fe3+自身颜色会干扰体系显色测定。综合考虑,实验选择该测定体系Fe3+浓度为0.015 mol/L。
3.1.2NaF浓度的选择实验中加入的NaF溶液以掩蔽反应过量的Fe3+。考察了NaF浓度对于测定的影响,结果表明NaF在0.05~0.3 mol/L浓度范围内,随着NaF浓度逐渐增大,灰度值缓慢降低,浓度为0.2 mol/L时逐渐趋于稳定。实验中选择加入0.2 mol/L NaF进行测定。
3.1.31,10-菲罗啉与溶胶-凝胶溶液浓度比溶胶-凝胶法制备材料具有许多优良的特性,如化学稳定性、热稳定性、化学惰性、高纯度和均匀性;在紫外到红外较宽的波长范围内具有较高的透明度;在水溶液或无水溶液中几乎不发生溶胀[15,16]。通过控制操作过程可以在溶胶-凝胶无机基体中包埋许多有机、金属有机和生物分子。实验比较了1,10-菲罗啉溶液及其溶胶-凝胶混合溶液对器件测定的影响,结果表明在相同1,10-菲罗啉浓度,两种溶液的测定结果基本一致。但比较而言,采用1,10-菲罗啉/溶胶-凝胶混合溶液固定于测定器件具有较好的稳定性。因此,实验选择溶胶-凝胶方法固定1,10-菲罗啉,并探讨了1,10-菲罗啉和溶胶-凝胶的浓度比对测定的影响,结果如图4所示。表明随着1,10-菲罗啉和溶胶-凝胶的体积比(0.5~4范围内)逐渐增大,测定体系的灰度值先增大然后略有降低。这可能是由于1,10-菲罗啉和溶胶-凝胶体积比小时,即较小浓度的1,10-菲罗啉不能与反应生成的Fe2+完全反应;而当两者体积混合比较大时,过量的1,10-菲罗啉不能很好地混合包埋,对于测定有一定的影响。实验选择1,10-菲罗啉和溶胶凝胶的体积比值为2.5。
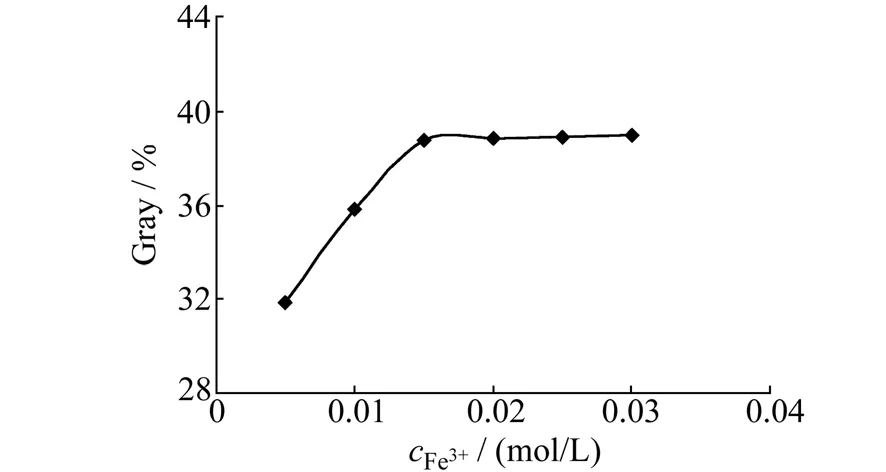
图3 Fe3+的浓度对AA测定的影响Fig.3 Effects of the concentration of Fe3+ on the detection of AA
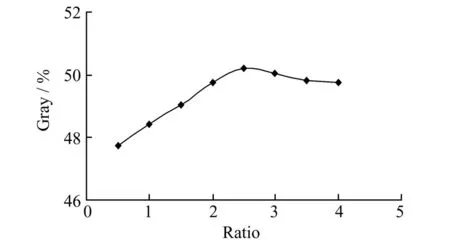
图4 1,10-菲罗啉和溶胶-凝胶体积比对AA测定的影响Fig.4 Effects of the volume ratio of 1,10-phenanthroline to sol-gel on the detection of AA
3.1.4样品的加入量实验考察了样品加入体积对测定的影响。结果表明,灰度值随着样品加入体积的增大而增大,90 μL后灰度值基本不变。样品加入体积较小时,溶液不能完全润湿并与滤纸固化试剂反应(固定1,10-菲罗啉的滤纸上仅有少量试剂与所生成的Fe2+反应),灰度值较小;而加入样品体积太大,超出滤纸承载量,不利于测定。因此,选择加入90 μL的样品溶液进行实验。
3.1.5反应时间的影响如上所述,该测定体系反应原理是AA先将Fe3+还原为Fe2+,然后生成的Fe2+与1,10-菲罗啉发生配合反应得到橙红色配合物。实验分别考察了Fe3+与AA,以及生成物Fe2+与1,10-菲罗啉反应时间对测定的影响,结果如图5所示。对于Fe3+与AA反应,灰度值随着反应时间的增大而逐渐增大,2 min后基本趋于稳定。反应时间较短,AA不能被Fe3+完全氧化,灰度值较小;反应时间太长,不利于快速测定。而对于生成物Fe2+与1,10-菲罗啉反应时间对测定的影响而言,室温下分别对100和300 μmol/L AA进行了测定,灰度值变化趋势完全一致。随着反应时间的增大灰度值急剧增大,在20 min后基本稳定。因此,实验选择Fe3+与AA和生成物Fe2+与1,10-菲罗啉在室温下反应时间分别为2 min和20 min。
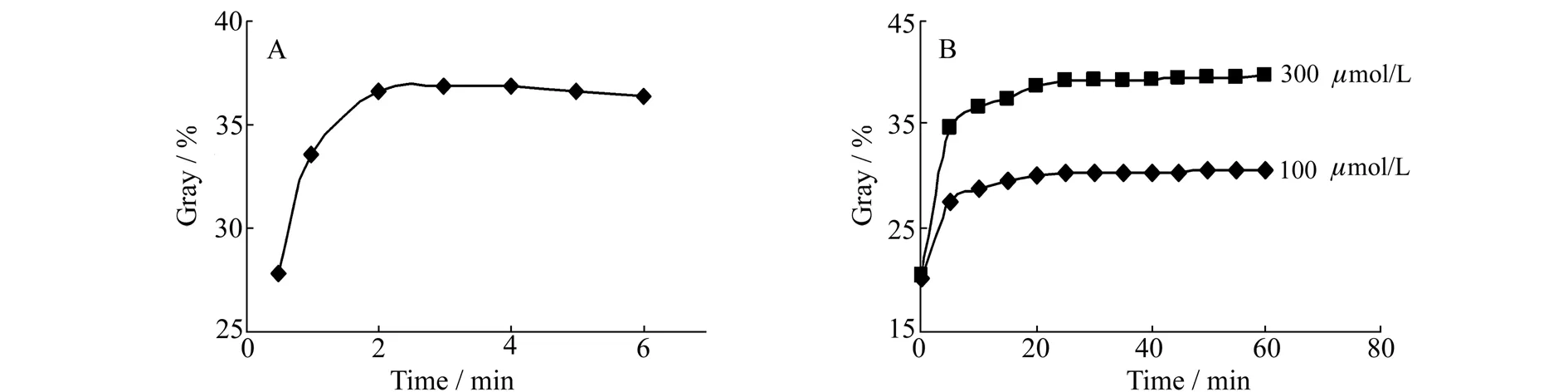
图5 Fe3+与AA(A)和Fe2+与1,10-菲罗啉(B)反应时间的影响Fig.5 Effects of reaction time between Fe3+ and AA(A),and Fe2+ and 1,10-phenanthroline(B)
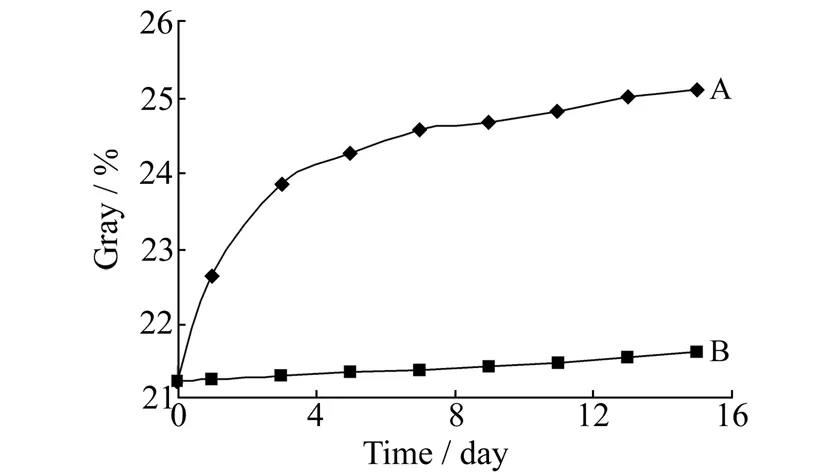
图6 分析器件的稳定性Fig.6 Stability of analytical device A.indoor environment;B.sealed in black plastic bag with desiccant at 4 ℃
3.2 器件的稳定性
实验进行了3D纸基微流控分析器件的稳定性实验。分别在室内自然环境和避光密闭环境保存下,对制备的纸基微流控器件进行连续15 d测定,其灰度值的变化如图6所示。表明在室内保存时,可能是由于固定于滤纸上的Fe3+在空气中易被还原所致,体系的灰度值呈明显上升趋势。而保存于4 ℃避光密闭环境中,测定体系的灰度值基本保持不变。结果表明该纸基微流控器件密闭保存于避光环境,器件稳定性良好。
3.3 工作曲线及检出限
在上述优化的实验条件下,测定了一系列AA标准溶液,并绘制校正曲线。结果表明,在7~550 μmol/L浓度范围内,测定的灰度值(y)与AA的浓度(x)呈线性关系。线性回归方程为:y=0.0493x+25.104,线性相关系数r=0.9942,检出限(3σ/k)为6.1 μmol/L(n=10)。实验对250 μmol/L的AA标准溶液平行测定10次,其相对标准偏差为0.63%。
3.4 干扰实验
实验进行了维生素C药品中常见辅助剂淀粉、糊精、蔗糖、葡萄糖、β-环糊精等对AA测定的影响。结果表明,对于200 μmol/L AA的测定,在误差不超过±5%时,25倍的淀粉、糊精、蔗糖、甘油,20倍的葡萄糖,5倍的β-环糊精,2倍的酒石酸和酒石酸钾钠,均不干扰测定。而实际药品中这些物质的含量均小于此,因此不会影响AA的测定。
3.5 样品的测定
取10片维生素C片,计算得到维生素C片的平均质量。将药片研磨并混合均匀,准确称取相当于0.5片维生素C片质量的粉末,溶于约40 mL二次蒸馏水中,离心过滤,滤液转移于50 mL容量瓶中定容,备用。分别采用分光光度法和制备的3D纸基微流控分析器件对上述预处理样品中AA的含量进行测定,并进行加入回收实验,结果如表1所示。表明3D纸基微流控分析器件测定结果与分光光度法基本一致。所建立的3D纸基微流控分析器件测定方法适用于样品中AA含量的测定。
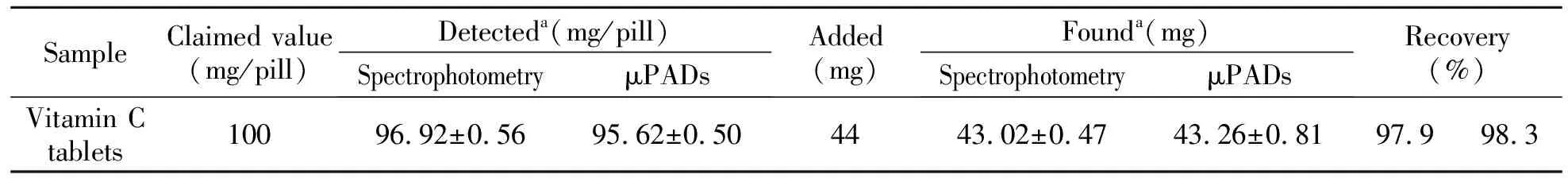
表1 维生素C药品中AA的测定
aMean±SD(n=3).
4 结论
本文提出了一种可手动折叠的新型3D纸基微流控分析器件。该微流控分析装置采用不同的方法固定测定试剂于器件a、b、c滤纸,从而避免了试剂间的交叉影响。测定中通过手动分别折叠,控制了各步反应时间。应用于药物中AA的测定,获得满意结果。该方法简单、快速、携带方便、成本低廉,适用于药物及其它样品中AA的现场实时测定。而且可基于该纸基微流控分析器件制备方法及具体测定要求,设计不同形状的纸基微流控分析器件。

