响应面试验优化黑脉羊肚菌多酚纯化工艺及其抗氧化活性
卢可可,郑少杰,吴素蕊,廖 霞,明 建,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.重庆市特色食品工程技术研究中心,重庆 400715)
响应面试验优化黑脉羊肚菌多酚纯化工艺及其抗氧化活性
卢可可1,郑少杰1,吴素蕊2,廖 霞1,明 建1,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.重庆市特色食品工程技术研究中心,重庆 400715)
以吸附率和解吸率为评价指标,研究9种大孔吸附树脂对黑脉羊肚菌多酚吸附及解吸性能,采用响 应面法建立NKA-Ⅱ树脂纯化黑脉羊肚菌多酚的二次多项回归模型,对多酚的纯化工艺进行优化,并比较纯化前后多酚的抗氧化活性。结果表明:最佳纯化树脂为NKA-Ⅱ。吸附的最佳工艺条件为上样液质量浓度295.86 μg/mL、上样流速1.90 mL/min、上样液pH 2.84,解吸的最佳工艺条件为乙醇体积分数78.56%、洗脱速率0.80 mL/min、洗脱剂pH 3.08;在此条件下吸附率可达98.69%,解吸率可达92.75%,纯化前后羊肚菌多酚纯度提高了2.94倍。黑脉羊肚菌多酚纯化前1,1-二苯基-2-三硝基苯肼自由基清除率、2,2'-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐自由基清除率和还原力EC50值分别为1.48、0.015、2.35 mg/mL,纯化后分别为0.52、0.004、0.69 mg/mL,纯化后抗氧化活性明显增强。
黑脉羊肚菌多酚;大孔吸附树脂;NKA-Ⅱ;响应面;抗氧化活性
黑脉羊肚菌(Morchella angusticepes Peck)属盘菌目(Pezizales)羊肚菌属(Morchella),主要分布于我国云南、四川、新疆、甘肃、西藏、青海等地[1],欧洲及北美东部亦有分布[2],是一种名贵的野生食药用真菌。黑脉羊肚菌富含蛋白质、维生素及多种必需氨基酸,并含有钾、钠、钙、镁和锌、铁等多种常量和微量元素[3]。有研究表明黑脉羊肚菌多酚含量丰富,能清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基(ABTS+·),具有一定的抗氧化能力[4]。
许多功能活性研究都围绕羊肚菌多酚粗提物进行,并未去除蛋白质和糖等杂质,对多酚含量及活性测定都会造成干扰。因此,纯化是进一步研究多酚功能及构效的重要步骤。常用的多酚纯化方法有薄层色谱[5]、固相萃取[6](C18和聚合物)、柱层析法(硅胶柱[7]、聚酰胺柱[8]、羟丙基葡聚糖凝胶柱(Sephadex LH-20)[9]和大孔吸附树脂[10])、制备型高效液相色谱(high performance liquid chromatography,HPLC)[11]等,而大孔吸附树脂具有选择性强、吸附容量大、吸附速率快、解吸容易、成本低、易再生等优点,成为多酚类物质纯化常用柱材[12]。
目前,大孔吸附树脂纯化植物多酚的研究[13-15]较多,但是由于不同植物多酚组成不同,极性强弱不同,所适用的大孔吸附树脂可能会有一定差异,而关于大孔吸附树脂纯化羊肚菌多酚研究还未有报道。因此,本研究通过比较9种大孔吸附树脂对羊肚菌多酚的吸附和解吸性能,筛选羊肚菌多酚纯化的最佳树脂;采用响应面法优化纯化工艺,评价纯化前后多酚的抗氧化活性,为进一步研究黑脉羊肚菌多酚提供理论依据。
1 材料与方法
1.1材料与试剂
黑脉羊肚菌(Morchella angusticepes Peck)产自云南,由中华全国供销总社昆明食用菌研究所提供。
D101、D4020、NKA-9、NKA-Ⅱ、X-5、AB-8、S-8大孔吸附树脂 天津市光复精细化工研究所;XAD-16、聚酰胺大孔树脂 上海摩速科学器材有限公司;DPPH、VC、ABTS 美国Sigma公司;其他试剂均为分析纯。
1.2仪器与设备
FW177型中草药粉碎机 天津泰斯特仪器有限公司;XHF-D均质机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发仪、SHZ-Ⅲ循环水真空泵 上海亚荣生化仪器厂;5810型台式高速离心机 德国Eppendorf公司;DW-FL270超低温(-40 ℃)冷冻储存箱 中科美菱温科技有限责任公司;722分光光度计 上海精科科学仪器厂;KQ-100型超声波清洗器 昆山市超声仪器有限公司;PB-10 pH计 德国赛多利斯公司;HZQ-F100型恒温摇床 太仓市实验设备厂;Φ1.84 cm×40 cm玻璃层析柱 重庆骏伟广生物科技有限公司。
1.3方法
1.3.1材料预处理
黑脉羊肚菌采摘后12 h内速冻,于-20 ℃条件下冻藏,实验前取出冷冻羊肚菌于50 ℃烘箱烘干至恒质量,中药粉碎机粉碎,过80目筛后密封备用。大孔吸附树脂预处理参考安晓婷等[16]方法。
1.3.2样品液制备和质量浓度测定
将40 g羊肚菌粉参考Okarter[17]和卢可可[18]等的方法提取,得样品液,过0.45 μm有机滤膜后贮于-40 ℃条件下保存备用。
参考Chu等[19]的方法,以没食子酸为标准品,得到标准曲线方程为y=0.002 9x+0.013 4(R2=0.996 7),其中y为没食子酸质量浓度(μg/mL),x为吸光度,根据该方程计算样品液多酚质量浓度(μg/mL)。
1.3.3树脂的筛选
参考陈晓侠等[20]的方法,分别绘制静态吸附动力学曲线和静态解吸动力学曲线,测定滤液中多酚含量。分别测定树脂的吸附量、解吸量、吸附率、解吸率,筛选最佳树脂。
1.3.4大孔树脂纯化羊肚菌多酚条件优化[16]
通过静态吸附解吸实验,筛选出最佳纯化树脂,将预处理的该树脂装入玻璃层析柱中,柱床体积BV为90 mL,用3 BV乙醇过柱洗涤后,用2 mL/min水平衡12 h。
1.3.4.1动态吸附条件优化
1)上样流速对吸附效果的影响:将质量浓度为267.7 μg/mL的样品液,在自然酸度pH 5.10条件下,各取250 mL,分别以1、2、3、4、5 mL/min流速通过层析柱,计算吸附率。2)上样液pH值对吸附效果的影响:用5% HCl溶液将质量浓度为220.7 μg/mL的样品液pH值分别调至2、3、4、5、6这5 个水平,各取上述溶液250 mL,以2 mL/min的流速通过层析柱,计算吸附率。3)上样液质量浓度对吸附效果的影响:分别取250 mL质量浓度分别为200、300、400、500、600 μg/mL的多酚提取液,用5% HCl溶液调至pH 3.0,以2 mL/min的流速通过层析柱,计算吸附率。
1.3.4.2动态解吸条件优化
1)洗脱速率对解吸效果的影响:将吸附饱和的树脂装入5 根层析柱中,先用1 BV水过柱洗脱,再用60%乙醇溶液在自然酸度条件下,分别以1、2、3、4、5 mL/min流速通过层析柱,计算解吸率。2)洗脱剂pH值对解吸效果的影响:将吸附饱和的树脂装入5 根层析柱中,先用1 BV水过柱洗脱,再用5% HCl溶液将60%乙醇溶液pH值分别调至2、3、4、5、6这5 个水平,以1 mL/min的流速通过层析柱,计算解吸率。3)洗脱剂体积分数对解吸效果的影响:将吸附饱和的树脂装入5根层析柱中,先用1 BV水过柱洗脱,再用5% HCl溶液将体积分数分别为20%、40%、60%、80%、100%乙醇溶液洗脱剂调至pH 3.0,以1 mL/min的流速通过层析柱,计算解吸率。
1.3.4.3响应面试验优化树脂纯化多酚工艺[21]
采用统计软件Design-Expert中响应面方法的Box-Behnken模型,以上样液质量浓度、上样流速及上样液pH值3 个因素为吸附操作中的自变量,以吸附率为响应值,因素水平见表1。以乙醇体积分数、洗脱速率及洗脱剂pH值3 个因素为解吸操作中的自变量,以解吸率为响应值,因素水平见表2。

表1 吸附试验自变量因素编码及水平Table 1 Codes and levels of factors chosen for adsorption experiments

表2 解吸试验自变量因素编码及水平Table 2 Codes and levels of factors chosen for desorption experiments
1.3.5羊肚菌多酚抗氧化活性测定
DPPH自由基清除率测定:参考Cheung等[22]的方法测定;还原力测定:参考Ardestani等[23]的方法测定;ABTS+·清除率测定:参考Soong等[24]的方法测定。
1.4数据处理
数据采用Origin 8.0和Design-Expert V8.0.6统计分析,实验重复3次,结果用表示。
2 结果与分析
2.1最佳树脂型号的筛选
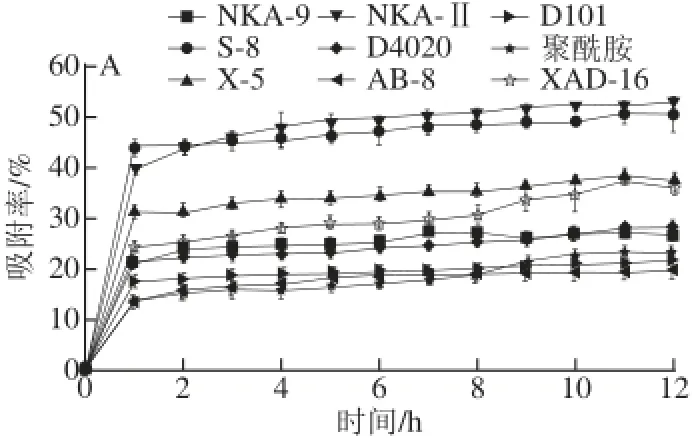

图1 不同型号树脂静态吸附(A)和解吸(B)动力学曲线Fig.1 Static absorption and desorption kinetics curves for different resins
由图1可知,9 种树脂对羊肚菌多酚均具有较好的吸附和解吸性能,均能在较短时间内完成对羊肚菌多酚的吸附和解吸作用,随着时间的延长,吸附和解吸动力学曲线逐渐平缓,10 h左右吸附和解吸作用基本达到平衡。不同型号树脂对羊肚菌多酚的吸附性能和解吸性能有所差异,极性树脂NKA-Ⅱ和S-8的吸附率始终优于其他树脂;树脂D101、XAD-16、AB-8和NKA-Ⅱ的解吸率高于其他树脂。
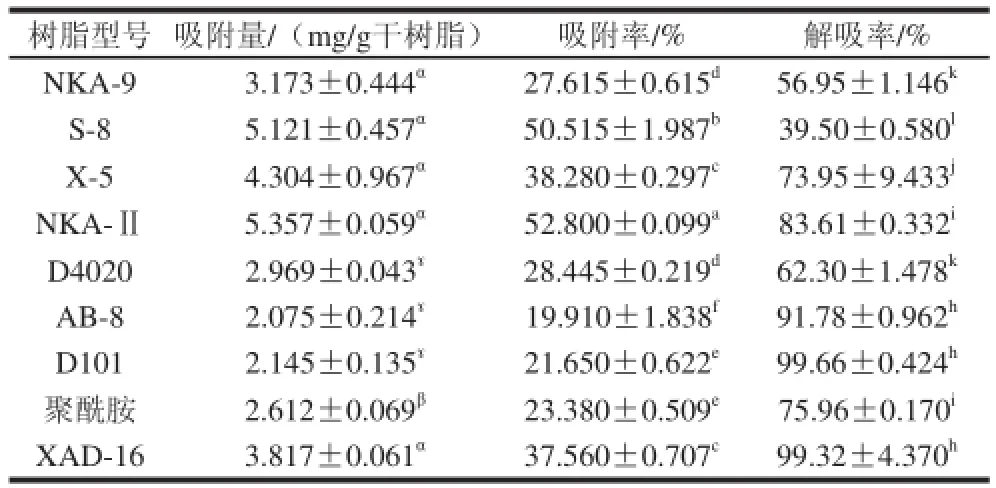
表3 不同型号树脂的吸附和解吸能力比较Table 3 Comparisons of absorption and desorption capacities of different macroporous resins
由表3可知,NKA-Ⅱ对羊肚菌多酚吸附量最高为(5.357±0.059)mg/g干树脂,其次是S-8为(5.121±0.457)mg/g干树脂,但二者间差异不显著(P<0.0 5);而二者的吸附率分别为(52.800±0.099)%和(50.515±1.987)%,差异显著(P<0.05)。此外,X-5、XAD-16和NKA-9对羊肚菌多酚的吸附性能也较好,吸附量均超过3 mg/g干树脂。根据类似物易吸附类似物的原理,非极性吸附树脂因表面的疏水作用,可通过与有机物的疏水部分作用而吸附溶液中的有机物,最适合于从极性溶剂(如水)中吸附非极性物质;中极性吸附树脂表面兼有疏水和亲水部分,既可从极性溶剂中吸附非极性物质,也可从非极性溶剂中吸附极性物质;极性和强极性吸附树脂一般通过静电作用吸附极性物质[25]。羊肚菌及其他食用菌中多酚组分主要以酚酸类物质为主[18,26],因此极性较强,所以极性强的NKA-Ⅱ和S-8树脂对羊肚菌多酚的吸附效果较好。
9种树脂对羊肚菌多酚的解吸性能实验中,D101、XAD-16、AB-8和NKA-Ⅱ解吸率均较大,均达到80%以上。综合考虑大孔吸附树脂对羊肚菌多酚的吸附量与解吸率结果,选择NKA-Ⅱ作为纯化黑脉羊肚菌多酚的最佳树脂。
2.2NKA-Ⅱ型树脂的动态吸附解吸条件优化
2.2.1动态吸附条件优化
2.2.1.1上样流速对吸附效果的影响

图2 上样流速对吸附效果的影响Fig.2 Infl uence of sample loading fl ow rate on absorption effi ciency
羊肚菌多酚是一类大分子酚类化合物,在大孔吸附树脂间扩散较慢,如果上样流速过大,多酚类物质还未被树脂吸附就流出树脂柱,导致吸附率变低;但如果速率太低,操作时间较长。由图2可知,当上样流速增加到3 mL/min时,吸附率明显减小,因此综合考虑,上样流速应控制在2 mL/min。
2.2.1.2上样液pH值对吸附效果的影响
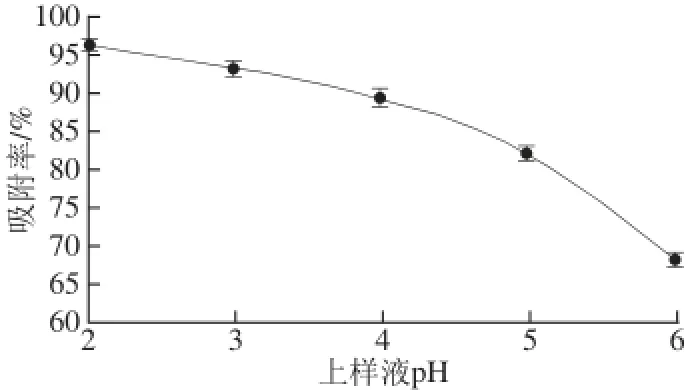
图3 上样液pH值对吸附效果的影响Fig.3 Infl uence of sample pH on absorption effi ciency
上样液pH值会影响多酚在溶液中存在的形式、其溶解度以及溶液极性,从而影响多酚与大孔吸附树脂的分子间作用力[27]。羊肚菌多酚主要以酚酸类物质[18],呈一定的酸性,由于酸性化合物在酸性溶液中易被吸附,碱性化合物在碱性条件下易被吸附。因此,在酸性条件下有利于大孔吸附树脂对羊肚菌多酚的吸附。由图3可知,在pH 2和pH 3时,吸附率较大,与其他文献[28]报道相符合。但当pH 2时溶液中有少许沉淀出现,因此,上样液pH值控制在3。
2.2.1.3上样液质量浓度对吸附效果的影响
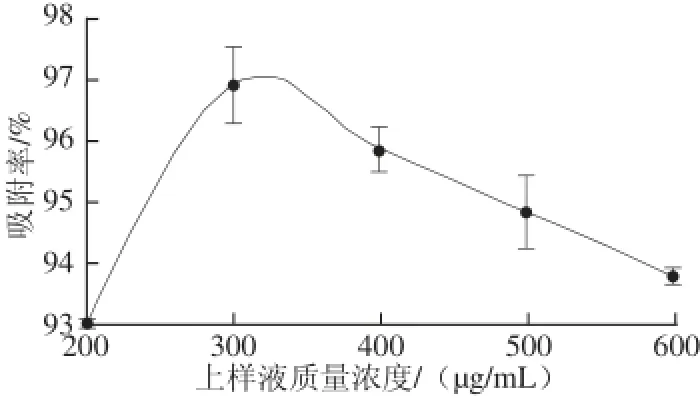
图4 上样液质量浓度对吸附效果的影响Fig.4 Infl uence of sample solution concentration on absorption effi ciency
由图4可知,随着上样液质量浓度的增加,吸附率逐渐增大,当质量浓度达到300 μg/mL时,吸附率达到最大,达96.91%,超过该质量浓度时,吸附率减小,因为当上样液质量浓度较低时,即使出现漏液现象,可能有些树脂还未达到饱和,增大质量浓度,在吸附过程中多酚与树脂接触几率增大,从而利于多酚向树脂扩散;但当质量浓度过高时,与多酚竞争吸附的杂质量也随之增加,且速率恒定时,高质量浓度不利于多酚在树脂间的扩散。因此,上样液质量浓度控制在300 μg/mL。
2.2.2动态解吸条件优化
2.2.2.1洗脱速率对洗脱效果的影响

图5 洗脱速率对解吸效果的影响Fig.5 Infl uence of desorption fl ow rate on desorption effi ciency
如图5所示,解吸率与洗脱速率呈负相关,可能是因为速率会影响洗脱剂与吸附在树脂上的多酚类物质间的交换,洗脱速率过快,洗脱剂不能充分置换吸附在树脂上的多酚类物质,从而导致解吸率降低。因此,洗脱速率选择1 mL/min。

图6 洗脱剂pH值对解吸效果的影响Fig.6 Infl uence of eluent pH on desorption effi ciency
2.2.2.2洗脱剂pH值对洗脱效果的影响如图6所示,随着洗脱剂pH值的降低,解吸率逐渐增大,当pH3时解吸率达到最大为90.24%,继续降低pH值,解吸率反而降低。与吸附作用相同,酸性条件有利于NKA-Ⅱ树脂吸附的羊肚菌多酚类物质的解吸。综合考虑,洗脱剂pH值应控制在3。
2.2.2.3乙醇体积分数对洗脱效果的影响

图7 乙醇体积分数对解吸效果的影响Fig.7 Infl uence of ethanol concentration on desorption effi ciency
由图7可知,随着乙醇体积分数的增大,解吸率逐渐升高,乙醇体积分数为20%时,解吸率仅为46.25%,但当乙醇体积分数为80%时,解吸率最高达91.69%,继续增大体积分数,解吸率反而下降。因此,乙醇体积分数为80%。
2.2.3动态吸附工艺优化及模型的建立
在NKA-Ⅱ型大孔吸附树脂吸附羊肚菌多酚的单因素试验基础上,采用Design-Expert进行试验设计及数据分析,以考察各因素间的交互作用及优化最佳吸附工艺。试验设计与结果见表4。
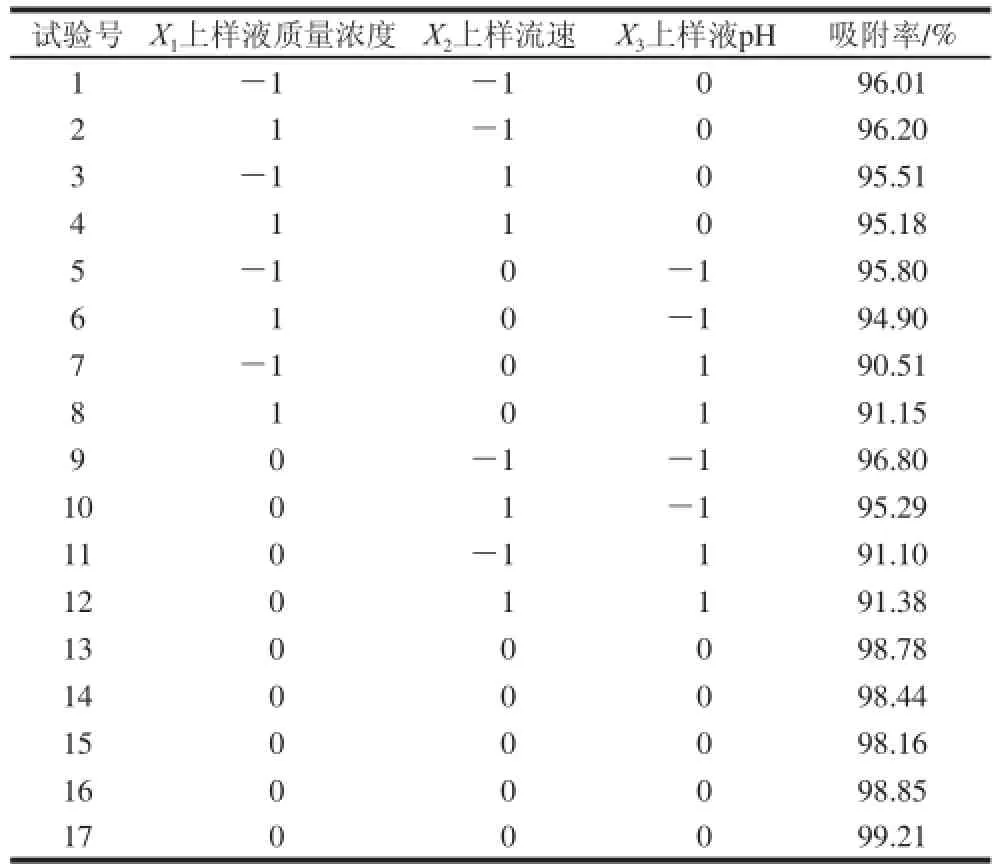
表4 NKA-Ⅱ大孔吸附树脂动态吸附优化试验设计与结果Table 4 Experimental design and results for dynamic absorption process of NKA-II
对表4试验数据进行多元回归分析,得到NKA-Ⅱ型大孔吸附树脂吸附羊肚菌多酚吸附率对自变量上样液质量浓度、上样流速、上样液pH值的二次多项回归模型方程(1)。
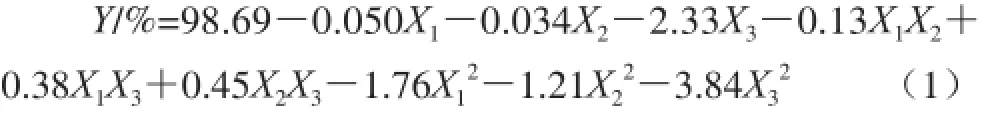
对该模型进行方差分析,结果见表5,可知,模型F=148.75>F0.01(9,4)=14.66,模型P<0.000 1,表明该回归模型极显著;F失拟=0.11<F0.05(9,3)=8.1,失拟项P=0.950 4>0.05,模型失拟度不显著;模型的校正决定系数为0.988 1,说明该模型能解释98.81%响应值的变化,仅有总变异的1.19%,不能用此模型来解释;复相关系数为0.994 8,说明该模型拟合程度良好,试验误差小。
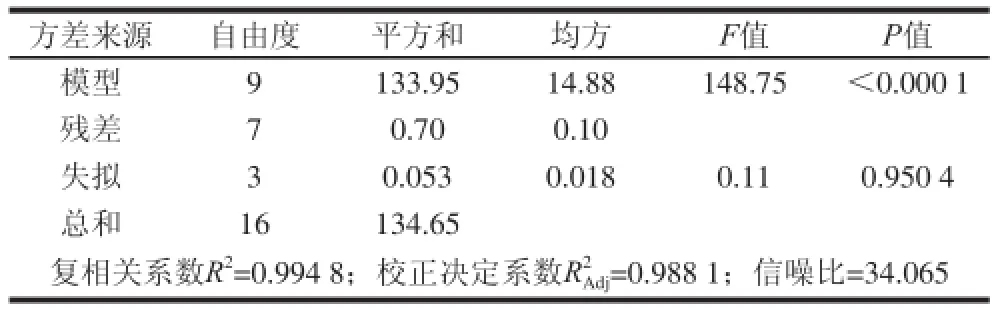
表5 吸附试验回归模型方差分析Table 5 Analysis of variance of regression equation for the adsorption experiment
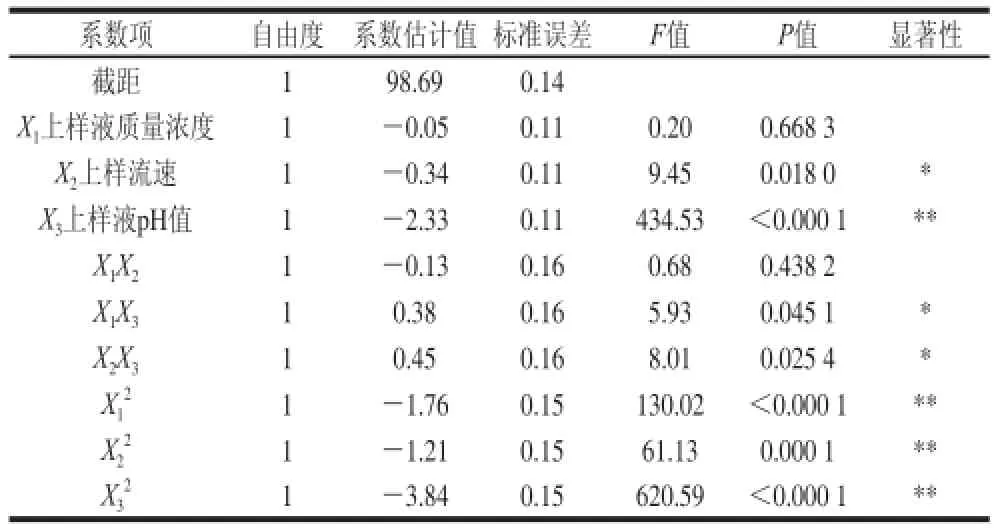
表6 吸附试验回归模型系数显著性检验Table 6 Signifi cance test of regression coeffi cients for the adsorption experiment
对模型系数进行显著性检验,结果见表6。模型中一次项X2、X3,二次项以及交互项X1X3、X2X3对吸附率Y有显著或极显著影响,其余项的影响均不显著(P>0.05)。其中,上样液质量浓度、上样流速、上样液pH值对吸附率影响顺序为:上样液pH值>上样流速>上样液质量浓度。优化回归模型为:
为了直观反映各因素对吸附率的影响及最佳工艺参数和参数间的交互作用,用响应面及其等高线图表示,由表6可知,X1X3、X2X3对Y的影响显著,如图8所示,而X1X2对Y的影响不显著。

图8 因素交互作用对吸附率影响的响应面和等高线Fig.8 Response surface and contour plots for the interactive effects of factors on adsorption rate
如图8a所示,曲面为固定上样流速为2 mL/min情况下,不同上样液质量浓度和上样液pH值对吸附率的影响情况,二者交互作用显著(P<0.05)。上样液pH值不变,上样液质量浓度在250~350 μg/mL范围内变化时,随着上样液质量浓度的增大,树脂对羊肚菌多酚的吸附率即响应值Y先增大后减小,在300 μg/mL附近时达到最大;当上样液质量浓度不变时,随着上样液pH值的升高,响应值Y先增大后减小,在pH 2.7~2.9间取得最大值。如图8b所示,曲面为固定上样液质量浓度为300 μg/mL情况下,不同上样流速和上样液pH值对吸附率的影响情况,二者交互作用显著(P<0.05)。上样液pH值不变,上样流速在1.5~2.5 mL/min范围内变化时,随着流速的增大,响应值Y先增大后减小,但变化趋势不明显;当上样流速不变时,随着上样液pH值的升高,响应值Y先增大,后急剧减小。
利用Design-Expert软件解模型方程(1)的逆矩阵,求得吸附率的最大预测值为99.09%,此时最佳工艺为上样液质量浓度295.86 μg/mL、上样流速1.90 mL/min、上样液pH 2.84;取最佳工艺的近似值,即上样质量浓度295.00 μg/mL、上样流速1.90 mL/min、上样液pH 2.80进行验证实验,得到吸附率为98.69%,与预测值相比,相对误差仅为0.41%,说明该回归模型优化的工艺组合是有效的。
2.2.4动态解吸工艺优化及模型的建立
在解吸单因素试验基础上,采用Design-Expert进行试验设计及数据分析,以考察各因素间的交互作用及优化最佳解吸工艺,试验结果见表7。

表7 NKA-Ⅱ大孔吸附树脂动态解吸优化试验设计与结果Table 7 Experimental design and results for dynamic desorption process of NKA-Ⅱ
对表7试验数据进行多元回归分析,得到解吸率对自变量乙醇体积分数、洗脱速率、洗脱剂pH值的二次多项回归模型方程(2)。

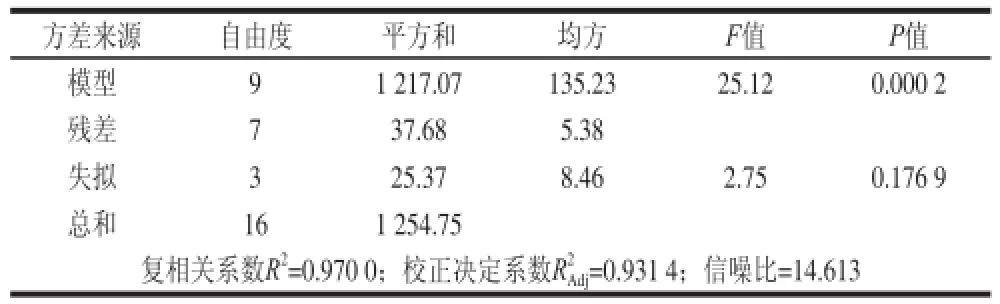
表8 解吸试验回归模型方差分析Table 8 Analysis of variance of regression equation for the desorption experiment
对该模型进行方差分析,结果见表8,可知,模型F=25.12>F0.01(9,4)=14.66,模型P=0.000 2,表明该回归模型极显著;F失拟=2.75<F0.05(9,3)=8.1,失拟项P=0.176 9>0.05,模型失拟度不显著;模型的校正决定系数为0.931 4,说明该模型能解释93.14%响应值的变化,仅有总变异的6.86%,不能用此模型来解释;复相关系数为0.970 0,说明该模型拟合程度良好,试验误差小。

表9 解吸试验回归模型系数显著性检验Table 9 Signifi cance test of regression coeffi cients for the desorption experiment
对模型系数进行显著性检验,结果见表9。模型中一次项A、B、C,二次项A2、B2、C2以及交互项AB对解吸率Y'有显著或极显著影响,其余项的影响均不显著(P<0.05)。其中,乙醇体积分数、洗脱速率、洗脱剂pH对解吸率影响顺序为:乙醇体积分数>洗脱剂pH值>洗脱速率。优化回归模型为:Y'/%=92.75-4.76A-2.70B+ 2.84C-3.12AB-12.09A2-6.00C2。
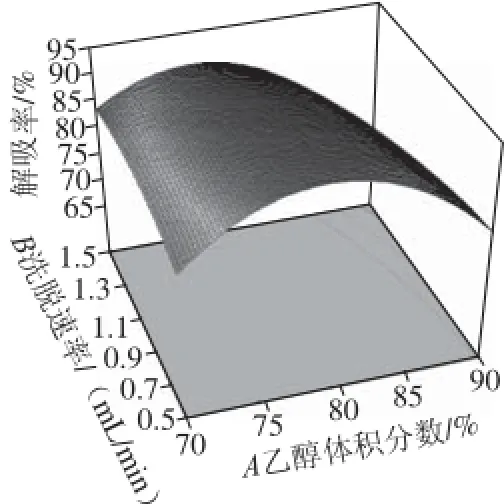

图9 乙醇体积分数和洗脱速率交互作用对解吸率影响的响应面和等高线Fig.9 Response surface and contour plots for the effects of ethanol concentration, fl ow rate and their interaction on desorption rate
A与B对Y'的交互作用如图9所示,在固定洗脱剂pH 3情况下,当速率不变,乙醇体积分数在70%~90%范围内变化时,随着乙醇体积分数的增大,洗脱剂对羊肚菌多酚的解吸率即响应值Y'先增大后大幅度减小;当乙醇体积分数不变时,随着洗脱速率的增大,响应值Y'变化趋势不明显。
利用Design-Expert软件解模型方程(2)的逆矩阵,求得解吸率的最大预测值为93.84%,此时最佳工艺为乙醇体积分数78.56%、洗脱速率0.80 mL/min、洗脱剂pH 3.08;取最佳工艺的近似值,即乙醇体积分数80%、洗脱速率0.80 mL/min、洗脱剂pH 3.00进行验证实验,得到解吸率为92.75%,与预测值相比,相对误差仅为1.17%,说明该回归模型优化的工艺组合是有效的。
2.3NKA-Ⅱ树脂的动态洗脱性能曲线

图10 动态洗脱曲线Fig.10 Dynamic elution curve
由图10可知,动态条件下,NKA-Ⅱ树脂上吸附的羊肚菌多酚易被洗脱下来,洗脱液体积为0.5~1.5 BV时,洗脱液中羊肚菌多酚含量较多,洗脱峰比较集中,达到3 BV时,洗脱液中几乎没有多酚物质,因此解吸时洗脱体积选择3 BV即可。
2.4羊肚菌多酚大孔吸附树脂纯化前后抗氧化活性
引入半数抑制率EC50值作为DPPH自由基清除能力、还原力和ABTS+·清除能力的评价标准[29],EC50值越小,说明抗氧化剂的抗氧化效果越好。黑脉羊肚菌纯化前后多酚纯度及DPPH自由基清除率、ABTS+·清除率和还原力的EC50值见表10。
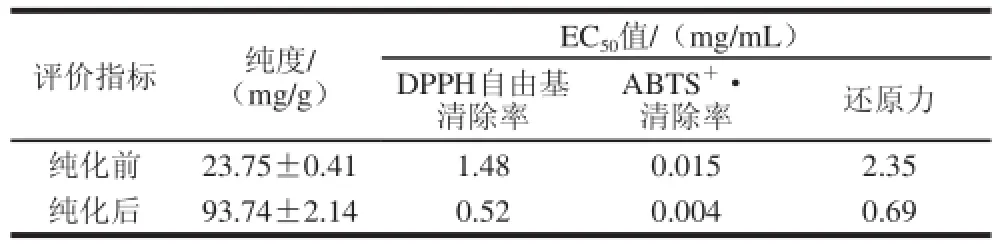
表10 羊肚菌多酚纯化前后纯度及抗氧化活性比较Table 10 Comparison of antioxidant activities and purities of polyphenol before and after purifi cation
由表10可知,经NKA-Ⅱ树脂纯化后,羊肚菌多酚纯度从纯化前(23.75±0.41)mg/g粗提物达到(93.74±2.14)mg/g,纯度提高了2.94倍;纯化后EC50值也有所降低。说明纯化后羊肚菌多酚抗氧化活性明显增强。
3 结 论
通过比较9种大孔吸附树脂对黑脉羊肚菌多酚的静态吸附与解吸性能,确定NKA-Ⅱ型树脂最适于纯化羊肚菌多酚;再利用试验设计软件Design-Expert,优化了NKA-Ⅱ树脂纯化黑脉羊肚菌多酚的吸附、解吸工艺条件,建立了各因素及响应值间的二次多项数学模型,根据响应面图和等高线图对关键因素对响应值的交互作用进行分析。结果表明:吸附各因素对吸附率的影响顺序为上样液pH值>上样流速>上样液质量浓度;解吸各因素对解吸率的影响顺序为乙醇体积分数>洗脱剂pH值>洗脱速率;吸附的最佳条件为上样液质量浓度295.86 μg/mL、上样流速1.90 mL/min、上样液pH 2.84,解吸的最佳条件为乙醇体积分数78.56%、洗脱速率0.80 mL/min、洗脱剂pH 3.08;在此条件下吸附率可达98.69%,解吸率可达92.75%,只需3 BV洗脱剂就能将其基本洗脱,纯化前后羊肚菌多酚纯度约提高3倍;黑脉羊肚菌多酚具有一定的抗氧化活性,纯化前DPPH自由基清除率、ABTS+·清除率和还原力EC50值分别为1.48、0.015、2.35 mg/mL,纯化后分别为0.52、0.004、0.69 mg/mL,纯化后抗氧化活性明显增强。
[1] 卯晓岚. 中国蕈菌[M]. 北京: 科学出版社, 2009: 750-777.
[2] 杜习慧, 赵琪, 杨祝良. 羊肚菌的多样性, 演化历史及栽培研究进展[J].菌物学报, 2014, 33(2): 183-197.
[3] 刘蓓, 吴素蕊, 朱萍, 等. 滇西北地区四种羊肚菌营养成分分析比较[J].食品工业科技, 2012, 33(1): 363-365.
[4] GURSOY N, SARIKUKCU C, CENGIZ M, et al. Antioxidant activities, metal contents, total phenolics and flavonoids of seven Morchella species[J]. Food and Chemical Toxicology, 2009, 47(9):2381-23 88.
[5] WANG W, GUO J, ZHANG J, et al. Isolation, identification and antioxidant activity of bound phenolic compoun ds present in rice bran[J]. Food Chemistry, 2015, 171: 40-49.
[6] 赵文芳, 黄亚辉. 中低压C18柱层析分离儿茶素单体的研究[J]. 食品工业科技, 2014, 35(17): 97-101.
[7] 刘天行, 郭佳, 王伟, 等. 小米中结合型酚类化合物的分离与鉴定[J].南京农业大学学报, 2014, 37(1): 138-142.
[8] 张佰清, 张艳艳, 李龙杰. 二次柱层析制备高纯度树莓籽原花青素的工艺[J]. 食品科学, 2011, 32(8): 163-166.
[9] 罗超华, 李俊. 凝胶柱分离纯化茶多酚中表没食子儿茶素没食子酸酯的工艺优化[J]. 中国药物经济学, 2015, 10(1): 24-29.
[10] 刘荣, 姜元松, 杨巍巍, 等. 樟子松树皮多酚二次纯化及成分分析[J].食品工业科技, 2014, 35(3): 113-118.
[11] 孙怡, 张鑫, 张文芹, 等. 苦丁 茶冬青苦丁茶中多酚类物质的分离纯化与结构解析[J]. 食品科学, 2011, 32(11): 60-63.
[12] SOTO M L, MOURE A, DOMINGUEZ H, et al. Recovery,concentration and purifi cation of phenolic compounds by adsorption: a review[J]. Journal of Food Engineering, 2011, 105(1): 1-27.
[13] 苏东晓, 张瑞芬, 张名位, 等. 荔枝果肉酚类物质大孔树脂分离纯化工艺优化[J]. 中国农业科学, 2014, 47(14): 2897-2906.
[14] 王若兰, 田志琴, 孔祥刚, 等. 大孔吸附树脂纯化小米酚类化合物的工艺条件研究[J]. 中国粮油学报, 2011, 26(10): 35-39.
[15] 陶莎, 黄英, 康玉凡, 等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报, 2013, 29(23): 276-285.
[16] 安晓婷, 周涛, 李春阳, 等. 大孔树脂纯化蓝莓果渣多酚及其组成分析[J]. 食品科学, 2013, 34(20): 1-6. doi: 10.7506/spkx1002-6630-201320001.
[17] OKARTER N, LIU Changshu, SORRELLS M E, et al. Phytochemical content and anti oxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257.
[18] 卢可可, 谭玉荣, 吴素蕊, 等. 不同产地尖顶羊肚菌多酚组成及抗氧化活性研究[J]. 食品科学, 2015, 36(7): 24-29. doi: 10.7506/spkx 1002- 6630-201507001.
[19] CHU Yifang, SUN Jie, WU Xianzhong, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916.
[20] 陈晓侠, 宋渊, 张纪柏, 等. 吸附树脂对蛹虫草黄酮纯化工艺条件优化[J]. 食品科学, 2015, 36(4): 68-73. doi: 10.7506/spkx1002-6630-20150413.
[21] 于智峰, 王敏, 张家峰. 大孔树脂精制苦荞总黄酮工艺条件的优化研究[J]. 农业工程学报, 2007, 23(4): 253-257.
[22] CHEUNG L, CHEUNG P C, OOI V E. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry, 2003,81(2): 249-255.
[23] ARDESTANI A, YAZDANPARAST R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry,2007, 104(1): 21-29.
[24] SOONG Y Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3):411-417.
[25] 李鸿江, 温致平, 赵由才. 大孔吸附树脂处理工业废水研究进展[J].安全与环境工程, 2010, 17(3): 21-24.
[26] GUO Yajun, DENG Guifang, XU Xiangrong, et al. Antioxidant capacities, phenolic compounds and polysaccharide contents of 49 edible macro-fungi[J]. Food and Function, 2012, 3(11): 1195-1205.
[27] LIU Fuqiang, XIA Mingfang, YAO Sanli, et al. Adsorption equilibria and kinetics for phenol and cresol onto polymeric adsorbents:effects of adsorbents/adsorbates structure and interface[J]. Journal of Hazardous Materials, 2008, 152(2): 715-720.
[28] 李琼, 陈恺, 陈燕勤, 等. 大孔吸附树脂分离纯化核桃青皮总多酚[J].食品与机械, 2015, 31(1): 175-180.
[29] WOLDEGIORGISAZ, ABATE D, HAKI G D, et al. Antioxidant property of edible mushrooms c ollected from Ethiopia[J]. Food Chemistry, 2014, 157: 30-36.
Optimization of Purifi cation Process of Polyphenol from Morchella angusticepes Peck and Antioxidant Activity of the Extracted Polyphenol
LU Keke1, ZHENG Shaojie1, WU Surui2, LIAO Xia1, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Kunming Research Fungi Institute, All-China Federation of Supply and Marketing Cooperatives, Kunming 650223, China;3. Chongqing Speci al Food Program and Technology Research Center, Chongqing 400715, China)
Nine macroporous resins were investigated with respect to their adsorption and desorption rates for the polyphenol extracted from Morchella angusticepes Peck in order to find the most appropriate one. Response surface methodology was utilized to establish a mathematical regression model for optimizing the purifi c ation of the crude extract by adsorption column chromatography with the selected resin. NKA-Ⅱ was found to be the most suitable resin for the purifi cation of polyphenol. The optimum conditions for purifi cation we re obtained when the sample containing 295.86 μg/mL polyphenol at pH 2.84 was loaded onto the column at a fl ow rate of 1.90 mL/min, and then eluted with 78.56% aqueous ethanol acidifi ed to pH 3.08 at a fl ow rate of 0.80 mL/min. The purifi cation process yielded an adsorption rate of 98.69%, a desoprtion rate of 92.75% and a purifi cation factor of approximately 4. The half maximal effective concentrations (EC50) for DPPH and ABTS radical scavenging capacities and reducing power of the crude extract were 1.48, 0.015 and 2.35 mg/mL and reduced to 0.52, 0.004 and 0.69 mg/m L after the purifi cation, suggesting a signifi cant increase in the antioxidant activities.
polyphenols from Morchella angusticepes Peck; macroporous resin; NKA-Ⅱ; response surface methodology;antioxidant activity
R151.2
A
1002-6630(2015)18-0013-08
10.7506/spkx1002-6630-201518003
2015-04-17
国家自然科学基金面上项目(31471576);“十二五”国家科技支撑计划项目(2013BAD16B01)
卢可可(1991—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:lukeke8868@163.com
明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com

