高效毛细管电泳法对5 个产地苦荞中黄酮类化合物的检测
郭芳芳,冯 锋,,*,白云峰,刘荔贞,陈泽忠,李 蓉,周 高
(1.山西大学化学化工学院,山西 太原 030006;2.大同大学化学与环境工程学院,山西 大同 037009)
高效毛细管电泳法对5 个产地苦荞中黄酮类化合物的检测
郭芳芳1,冯 锋1,2,*,白云峰2,刘荔贞2,陈泽忠2,李 蓉2,周 高2
(1.山西大学化学化工学院,山西 太原 030006;2.大同大学化学与环境工程学院,山西 大同 037009)
采用高效毛细管电泳法,分别对5 个不同产地苦荞中黄酮类化合物进行检测。电泳条件:10 mmol/L Na2B4O7-H3BO3缓冲溶液,pH 9.3,检测波长218 nm,分离电压25 kV。在该条件下,表儿茶素、芦丁、山奈酚和槲皮素4 种黄酮类化合物在7 min内得到分离,线性范围分别为0.03~0.54、0.05~0.97、0.03~0.63、0.04~0.90 mg/mL,相关系数为0.992 3~0.998 7,最低检出限分别为5.33×10-6、1.80×10-5、2.51×10-5、1.24×10-5mg/mL(RSN=3),平均回收率在95.5%~104.7%之间,相对标准偏差不大于3.66%。结果表明:该方法准确可靠,可用于苦荞中黄酮类化合物的检测。
高效毛细管电泳;黄酮类化合物;苦荞
苦荞,又名鞑靼荞麦,为一年生蓼科类草本植物,是国际粮农组织公认的粮药的同源食物之一,苦荞中含有大量的化学活性物质,包括黄酮类化合物[1-2]、维生素[3]、蛋白质[4]等。相关研究表明苦荞的大多数药理作用都与苦荞中酚类化合物有关,而苦荞中最主要的酚类化合物是黄酮类物质[5]。许多研究表明黄酮类化合物具有抗氧化[6-8]、抗肿瘤[9]、抗敏[10]、抗菌抗病毒[11]、降血糖[12]、降血脂[10-12]、降血 压等作用[13]。因此建立一种对苦荞中的黄酮类化合物进行检测的方法非常重要。
目前对苦荞中黄酮类化合物的检测方法主要有分光光度法[4,14-16]、薄层色谱(thin-layer chromatography,TLC)法[17]、高效液相色谱(high performance liquid chromatography,HPLC)法[18-22]、液相色谱-质谱联用技术[23]以及毛细管电泳法[24]等。分光光度法选择性较差,TLC法测定结果准确度低,HPLC法试剂消耗量大,所需成本高、分析时间长。而毛细管电泳法具有试剂消耗量小、柱效高、分析速度快、经济环保等优点,被广泛运用于食品和药品活性物质的检测中。到目前为止,毛细管电泳技术对于不同产地苦荞中黄酮类化合物的分析应用尚未有见报道。本实验采用毛细管电泳法对5 个不同产地的苦荞中表儿茶素、芦丁、山奈酚和槲皮素4 种黄酮类物质进行测定,为苦荞的质量评价提供了科学依据。
1 材料与方法
1.1材料与试剂
四川大凉山、山西广灵、山东沂蒙、云南昆明、山西左云的苦荞 市购;氢氧化钠(分析纯) 天津市化学试剂批发公司;硼砂、硼酸(均为分析纯) 天津化学试剂三厂;黄酮类化合物(表儿茶素、芦丁、山奈酚、槲皮素) 美国阿拉丁公司;实验用水为二次蒸馏水。
1.2仪器与设备
P/ACETMMDQ高效毛细管电泳仪(配有紫外检测器以及32 Karat软件) 美国Beckman公司;内径75 μm未涂层石英毛细管 邯郸鑫诺光纤色谱有限公司;KQ5200DA型数控超声波清洗器 昆山市超声仪器有限公司;AP250D分析天平 美国Ohaus公司;TDL-16B型离心机 上海安亭科学仪器厂;PSH-2C型精密酸度计 上海大普仪器有限公司;0.22 μm一次性针孔过滤器;Lambda35紫外-可见分光光度计 美国PerkinEimer公司。
1.3方法
1.3.1溶液配制
分别称量10 mg表儿茶素、芦丁、山奈酚和槲皮素于4 个10 mL容量瓶中,用二次蒸馏水溶解后定容成1.0 mg/mL标准储备液。配制10 mmol/L硼砂(Na2B4O7)溶液,用10 mmol/L硼酸(H3BO3)溶液调至pH值为9.3。
1.3.2样品处理
采用超声法[25]对苦荞中黄酮类化合物进行测定。称取适量苦荞,在真空干燥器中烘干,后将其研成粉末,精密称取5 g于50 mL锥形瓶中,加入20 mL体积分数75%甲醇溶液并封口,超声提取30 min,超声前后用体积分数75%乙醇溶液将不足量补足,转移至离心管中,以6 000 r/min离心10 min,取上层清液,用0.22 μm一次性针孔过滤器过滤2 次,放置于冰箱中4 ℃保存备用。
1.3.3操作条件
对新毛细管进行活化,在20 psi条件下,用0.1 mol/L NaOH溶液、二次蒸馏水和缓冲溶液各冲洗30 min;2 次进样间分别用0.1 mol/L NaOH溶液、二次蒸馏水和缓冲溶液冲洗5 min。检测波长218 nm;分离电压25 kV;进样时间5 s;缓冲溶液:15 mmol/L Na2B4O7-H3BO3,pH 9.3。
2 结果与分析
2.1电泳分离条件的确定
2.1.1检测波长的选择
用甲醇配制一定质量浓度的表儿茶素、芦丁、山奈酚和槲皮素的标准溶液,用甲醇做空白,在波长200~450 nm范围内对其进行紫外扫描,确定5 种色素在波长218 nm处均有较大吸收,故将218 nm作为最佳检测波长。
2.1.2缓冲溶液浓度和pH值的选择
考察了Na2B4O7-H3BO3缓冲溶液在不同浓度(10、20、30、40、50 mmol/L)时,4 种黄酮类化合物的分离情况。随着缓冲溶液浓度增大,电流不断增大,同时产生较多焦耳热,基线响应信号值增加,4 种黄酮类化合物不能完全出峰。综合考虑,本实验选择10 mmol/L Na2B4O7-H3BO3为最佳缓冲溶液浓度。
考察pH值分别在9.1、9.2、9.3、9.4时对4 种黄酮类化合物分离的影响,结果如图1所示。当pH值为9.1时,表儿茶素和芦丁未能完全分离;随着pH值的增大,4 种分析物分离度变大,pH值为9.3时,分离完全;当pH值为9.4时,芦丁和山奈酚两峰部分重合,分离不完全,因此实验中选择9.3为最佳pH值。
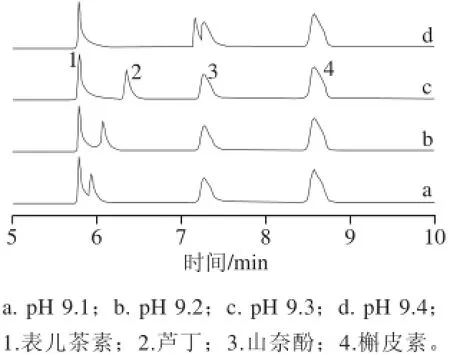
图1 pH值对分析物分离的影响Fig.1 Effect of running buffer pH on the separation of four analytes
2.1.3分离电压和进样时间的选择
提高分离电压,可以缩短分析时间,提高分离效率,但电压过高,体系产生的焦耳热也随之增加,有可能出现基线不稳,进而影响分离效果。考察15、20、25、30 kV时,4 种黄酮类化合物的分离情况,结果如图2所示。分离电压在15 kV时,分析时间长,山奈酚和槲皮素峰形差;分离电压为20 kV和25 kV时,化合物可以完全分离,但在分离电压为25 kV条件下,分析时间短;分离电压为30 kV时,表儿茶素和芦丁两峰分离不是很完全。综合考虑,选择25 kV作为最佳分离电压。
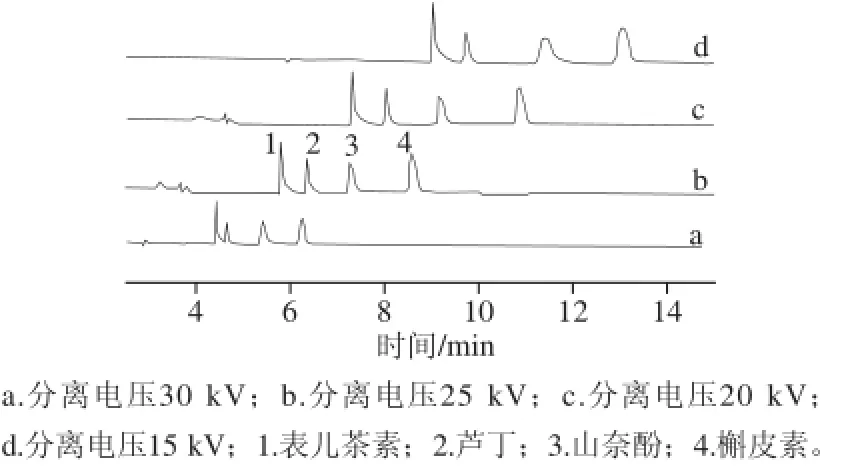
图2 分离电压对分析物分离的影响Fig.2 Effect of applied voltage on the separation of four analytes
在最佳电泳条件下,考察进样时间为3、4、5、6、7 s时4 种黄酮类化合物的的分离情况,结果如图3所示。进样时间小于5 s时,进样量少,峰面积较小,但是当进样时间大于5 s时,峰面积增大,峰形展宽,峰形变差。综合考虑,选择5 s作为最佳进样时间。
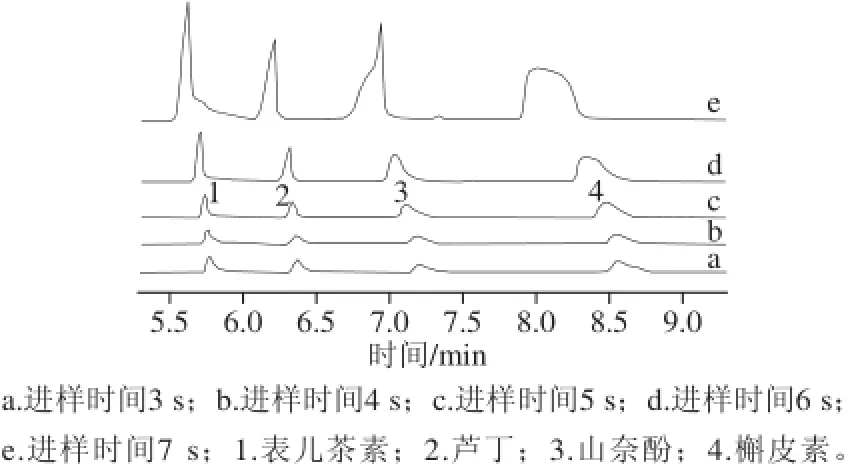
图3 进样时间对分析物分离的影响Fig.3 Effect of injection time on the separation of four analytes
2.2标准曲线及检出限测定结果
用甲醇做溶剂,配制4 种黄酮化合物的系列标准溶液(0.03~0.97 mg/mL),在最佳电泳条件下进行测定,以峰面积对质量浓度作图,得出各组分的线性方程、线性相关系数、线性范围和各物质的检出限(RSN=3),结果如表1所示。
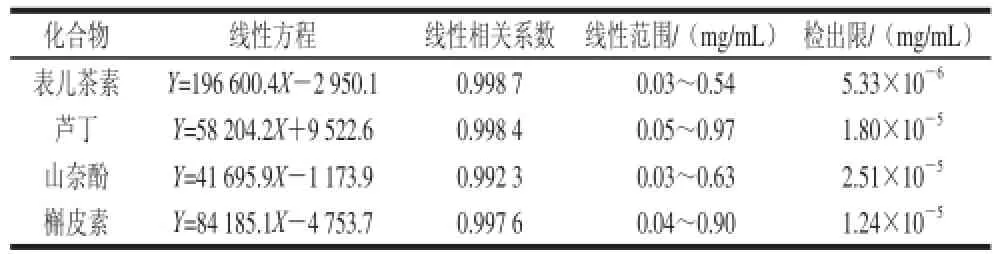
表1 4 种黄酮化合物的线性方程及检出限Table 1 Standard curves for determining four fl avonoids by HPCE and their limits of detection
2.3精密度实验结果
通过考察4 种黄酮类物质迁移时间以及峰面积的日内、日间相对标准偏差(relation standard deviation,RSD),对方法的精密度进行评估。4 种标样各取50 mL混合均匀,在最优电泳条件下日内、日间连续进样3 次,根据所得数据计算4 种黄酮类物质迁移时间和峰面积的RSD,结果见表2。日内精密度RSD不大于1.88%,日间精密度RSD不大于3.66%,表明该方法精密度良好。

表2 精密度实验Table 2 Results of precision experiments
2.4实际样品的测定
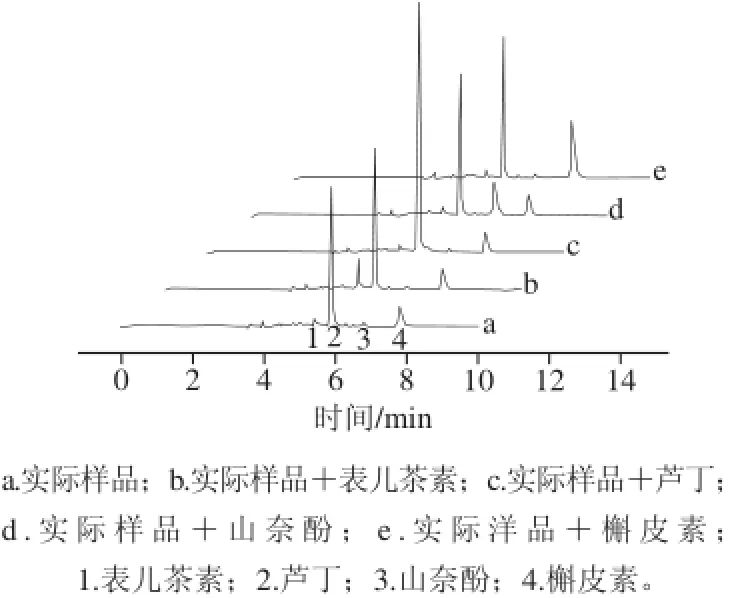
图4 实际样品的测定Fig.4 Chromatograms of real samples
按照1.3.2节方法对苦荞样品进行处理,在最佳电泳条件下对样品进行分析,采用标准加入法来确定样品中是否含有被检测的黄酮类物质,结果如图4所示。在实际样品中分别添加一种黄酮标准样品后,只有相对应的电泳峰明显升高且没有引起新的电泳峰出现,证明实际样品中有4 种被测黄酮类化合物的存在。
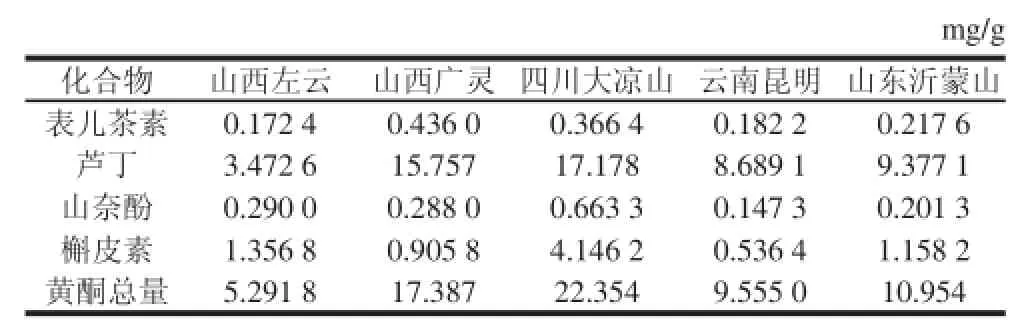
表3 5 种样品的分析结果(n=3)Table 3 Assay results for flfl avonoids in fifi ve samples (n= 3)
按照1.3.2节的方法对苦荞样品进行处理,提取液经微孔膜过滤2 次后连续进样3 次,对数据进行处理,结果如表3所示。不同产地的苦荞中,4 种被测黄酮类化合物中芦丁含量均为最高。其中四川大凉山苦荞中山奈酚和槲皮素含量均高于其他产地苦荞。山西广灵苦荞中表儿茶素含量最高。被测4 种黄酮化合物总量从大到小分别为四川大凉山>山西广灵>山东沂蒙>云南昆明>山西左云。
2.5回收率实验结果
在最佳电泳条件下进行回收率实验,通过向苦荞样品提取液中加入一定量(3 个水平)的黄酮类化合物,来测定回收率,结果如表4所示,回收率范围在95.5%~104.7%之间,RSD在1.57%~4.48%之间,表明该方法准确可靠。
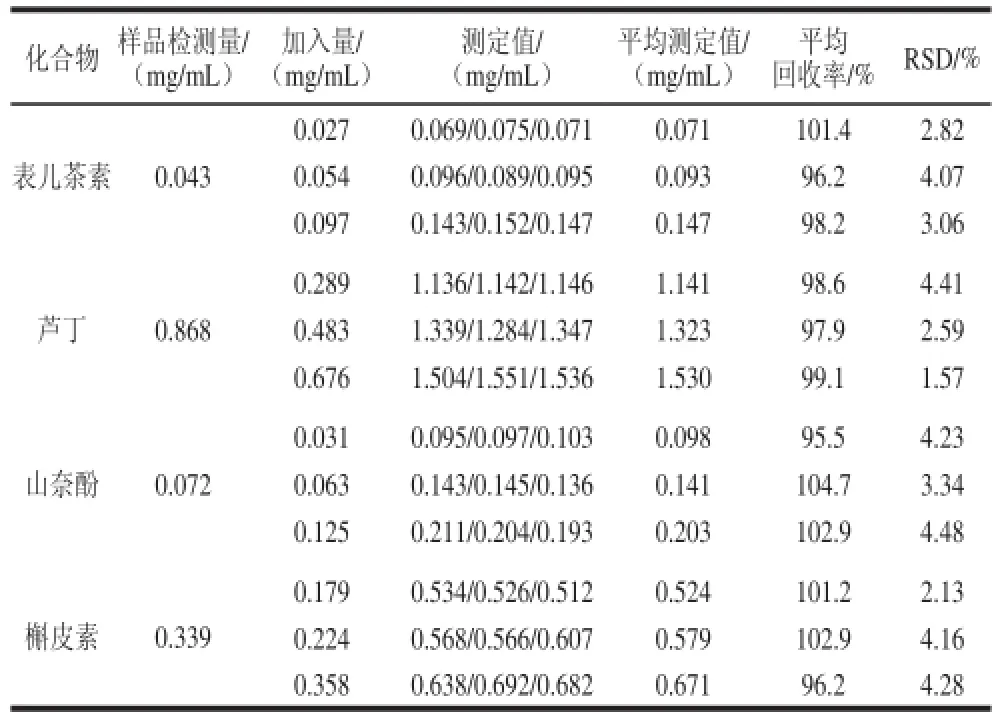
表4 回收率实验Table 4 Results of recovery experiments
3 结 论
本实验使用高效毛细管电泳法,对5 个不同产地苦荞中黄酮类化合物进行测定,在最佳电泳条件下(检测波长218 nm,分离电压25 kV,15 mmol/L Na2B4O7-H3BO3缓冲溶液,pH 9.3),表儿茶素、芦丁、山奈酚和槲皮素4 种黄酮类化合物在7 min内得到分离,线性范围分别为0.03~0.54、0.05~0.97、0.03~0.63、0.04~0.90 mg/mL,相关系数为0.992 3~0.998 7,最低检出限(RSN=3)分别为5.33×10-6、1.80×10-5、2.51×10-5、1.24×10-5mg/mL,平均回收率为95.5%~104.7%,RSD不大于3.66%。实验结果表明该方法准确可靠,适用于苦荞中黄酮类化合物的分析。
[1] 黄兴富, 赵声定, 孙浩岩, 等. 浅析苦荞的营养价值与开发利用[J].中国民族民间医药, 2010, 19(13): 24-25.
[2] 王华, 张雄, 张国涛, 等. 荞麦中黄酮类化合物的分析方法研究进展[J].应用化工, 2013, 42(7): 1331-1338.
[3] 常庆涛, 王书勤, 王建如, 等. 荞麦中黄酮类化合物的研究进展[J].安徽农业科学, 2001, 29(5): 681-683.
[4] 左光明, 谭斌, 王金华, 等. 苦荞米与苦荞粉加工中营养功能成分的评价及利用[J]. 食品科学, 2009, 30(14): 183-187.
[5] 季春燕. 苦荞的化学成分研究[D]. 杨凌: 西北农林科技大学, 2005.
[6] 王静波, 赵江林, 彭镰心, 等. 苦荞芽中黄酮类化合物含量及其抗氧化性的研究[J]. 现代食品科技, 2013, 34(5): 965-968.
[7] 任顺成, 孙军涛. 荞麦粉、皮、芽中黄酮类化合物抗氧化研究[J].河南工业大学学报, 2008, 29(2): 15-17.
[8] 李丹, 丁霄霖. 苦荞黄酮抗氧化作用的研究[J]. 食品科学, 2001,22(4): 22-24.
[9] 李富华, 刘冬, 明建. 苦荞麸皮黄酮抗氧化及抗肿瘤活性[J]. 食品科学, 2014, 35(7): 58-63. doi: 10.7506/spkx1002-6630-201407012.
[10] 尹超彦. 苦荞黄酮对实验性大鼠预防性调节血脂和血流变作用及毒理学评价[D]. 太原: 山西医科大学, 2004.
[11] 罗光宏, 陈天仁, 祖廷勋, 等. 苦荞生物类黄酮及其测定方法研究进展[J]. 食品科学, 2005, 26(9): 542-545.
[12] 张瑞. 苦荞黄酮及降血糖活性研究[D]. 北京: 中国农业科学院, 2008.
[13] 郭刚军, 何美莹, 邹建云, 等. 苦荞黄酮的提取分离及抗氧化活性研究[J]. 食品科学, 2008, 29(12): 373-376.
[14] 周小理, 方向, 周一鸣, 等. 磁场对苦荞种子萌发过程中黄酮类物质的诱导效应[J]. 食品科学, 2012, 33(21): 20-23.
[15] 胡鞒缤, 姚瑛瑛, 李艳琴, 等. 荞麦植株各部位总黄酮含量的测定与比较[J]. 食品与药品, 2013, 15(6): 394-396.
[16] 周建华, 刘松艳, 巩发永. 两种分光光度法测定苦荞中黄酮含量的比较[J]. 江苏农业科学, 2008(5): 247-251.
[17] 郑庆红, 周瑞雪, 韩利文, 等. 苦荞黄酮类化合物的提取及微乳薄层色谱鉴别[J]. 中国药物与临床, 2012, 12(9): 1153-1156.
[18] ANA-MARIA D, AKIRA K, HIDEKI H, et al. Determination of rutin,catechin, epicatechin, and epicatechin gallate in buckwheat fagopyrum esculentum moench by micro-high-performance liquid chromatography with electrochemical detection[J]. Journal of Agricultural and Food Chemist ry, 2007, 55(4): 1139-1143.
[19] KREFT I, FABJAN N, YASUMOTO K. Rutin content in buckwheat(Fagopyrum esculentum Moench) food materials and products[J]. Food Chemistry, 2006, 98(3): 508-512.
[20] 齐宁利, 龚霄, 杨子明, 等. 高效液相色谱-二极管阵列检测同时测定苦荞中芦丁和槲皮素的含量[J]. 食品科技, 2013, 38(10): 301-304.
[21] 夏清, 黄艳菲, 李波, 等. HPLC法测定荞麦不同种不同部位槲皮素和山柰酚的含量[J]. 中药材, 2014, 37(7): 1149-1151.
[22] 黄兴富, 黎其万, 刘宏程, 等. 高效液相色谱法同时测定苦荞中芦丁、槲皮素和山柰酚的含量[J]. 中成药, 2011, 33(2): 345-347.
[23] 徐宝才, 肖刚, 丁霄霖, 等. 液质联用分析测定苦荞黄酮[J]. 食品科学, 2003, 24(6): 113-117.
[24] WANG J, WANG H, HAN S. Ultrasensitive determination of epicatechin,rutin, and quercetin by capillary electrophoresis chemiluminescence[J]. Acta Chromatographica, 2012, 24(4): 679-688.
[25] 李欣, 王步军. 两种苦荞黄酮提取方法的优化及含量测定[J]. 食品科学, 2010, 31(6): 80-85.
Determination of Flavonoids in Buckwheat from Five Different Growing Areas by High Performance Capillary Electrophoresis
GUO Fangfang1, FENG Feng1,2,*, BAI Yunfeng2, LIU Lizhen2, CHEN Zezhong2, LI Rong2, ZHOU Gao2
(1. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;2. College of Chemical and Environmental Engineering, Datong University, Datong 037009, China)
An effi cient high performance capillary electrophoresis (CE) method has been successfully developed for the determination of flavonoids in buckwheat. The running buffer contained 10 mmol/L Na2B4O7-NaH2PO4, at pH 9.3, the detection wavelength was set at 218 nm and a voltage of 25 kV was applied. Under these conditions, four fl avonoids, i.e.,picatechin, rutin, kaempferd and quercetin, could be fully separated from each other within seven minutes. The linear ranges were 0.03 to 0.54, 0.05 to 0.97, 0.03 to 0.63, and 0.04 to 0.90 mg/mL, respectively, with correlation coeffi cients between 0.992 3 and 0.998 7 and the limits of detection (LOD) were 5.33 × 10-6, 1.80 × 10-5, 2.51 × 10-5, and 1.24 × 10-5mg/mL,respectively (RSN= 3). The average recoveries were between 95.5% and 104.7%, with a relative standard deviation (RSD)less than 3.66%. This method is convenient to operate, accurate, effi cient and suitable for the simultaneous detection of fl avonoids in buckwheat.
high performance capillary electrophoresis; fl avonoids; buckwheat
O611.5
A
1002-6630(2015)18-0085-04
10.7506/spkx1002-6630-201518015
2015-01-25
国家自然科学基金面上项目(21375083)
郭芳芳(1989—),女,硕士研究生,主要从事毛细管电泳研究。E-mail:13546046121@163.com
冯锋(1964—),男,教授,博士,主要从事光分析化学研究。E-mail:feng-feng64@263.net

