高效液相色谱法同时测定仙鹤草中6 种黄酮
高 意,周光明*,陈军华,秦红英
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715)
高效液相色谱法同时测定仙鹤草中6 种黄酮
高 意,周光明*,陈军华,秦红英
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715)
目的:建立超声辅助萃取-高效液相色谱法分离仙鹤草中芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素6 种黄酮及 其含量测定的方法。方法:采 用Phenomenex C18色谱柱(150 mm×4.6 mm,5 μm)分离6 种成分;流动相为甲醇-0.1%醋酸溶液,梯度洗脱;流速0.8 mL/min,紫外检测波长320 nm,柱温35 ℃。结果:6 种成分在15 min内均达到基线分离,线性关系良好(r不低于0.999 1,n=6),平均回收率均在97.78%~104.4%之间(相对标准偏差小于1.20%,n=3)。结论:本实验采用超声波法提取,方法简单、快速、经济、可靠,可用于仙鹤草的质量监控。
高效液相色谱;仙鹤草;超声萃取;黄酮;含量测定
仙鹤草(Agrimonia pilosa Ledeb),又名龙芽草、脱力草,系蔷薇科多年生植物地上部分,全草入药[1]。现代药理学研究表明,仙鹤草具有收敛止血[2]、抗氧化[3]、抗菌[4]、抗炎[5]和抗癌[6]等药理作用,在临床上主要用于治疗咳血、便血、尿血等出血症状[7]。据文献报道,仙鹤草含有三萜皂苷[8-9]、鞣质[10]、黄酮类[11]、有机酸[12]和挥发油[13]等多种成分,其中主要成分为鹤草酚,在临床上常以鹤草酚的含量作为检测仙鹤草质量的主要依据[14]。近来年,据文献报道仙鹤草中含有芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素等多种黄酮类成分[11-16],此类成分具有抗心律失常、抑制乙酰胆碱酯酶、抗炎活性、降糖等多种药理作用[17-20],因此研究仙鹤草中黄酮类化合物对仙鹤草的深入研究开发和质量控制具有重要意义。
目前对于仙鹤草的研究方法不一,有薄层扫描法[14,21]、红外光谱[22]和电泳法[23]等,各方法均有其优缺点,如Gu等[21]利用薄层色谱法 测定仙鹤草中成分,虽时间较短,但操作过程中受环境影响较大,测定结果稳定性、重复性较差;李强等[22]利用红外光谱对仙鹤草原药材及其提取物进行分析与鉴定,但并未对其中具体成分含量进行测定,亦有Jiang Qinghua[24]、Wang Yan[25]等分别利用高效液相色谱法-二极管阵列检测-电喷雾离子化-串联质谱法和高速逆流色谱法对仙鹤草中多种活性成分进行纯化分析,但是利用高效液色谱相同时测定仙鹤草中的多种黄酮成分尚未见报道,本实验利用高效液相色谱法建立对仙鹤草中多种黄酮同时分离和测定含量的方法,此方法简单省时、测定快速且重复性好,为仙鹤草质量控制和评估提供重要的参考依据。
1 材料与方法
1.1材料与试剂
仙鹤草购于当地药房;芦丁、花旗松素、香豆素、木犀草素、山奈酚、芹菜素对照品(纯度均不小于98.5%) 上海晶纯实业有限公司;甲醇(色谱纯)、醋酸(分析纯) 重庆川东化工有限公司化学试剂厂;二次蒸馏水 实验室自制。
1.2仪器与设备
LC-20A高效液相色谱仪(包括SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵) 日本岛津公司;KH-3200B型超声波清洗器 昆山禾创超声仪器有限公司;SZ-2自动双重纯化水蒸馏器 上海泸西分析仪器;XY型电热恒温干燥箱 上海精宏实验设备有限公司;FA2004A型分析天平 上海精天电子仪器有限公司。1.3 方法
1.3.1色谱条件

图1 混合对照品(A)和样品(B)色谱图Fig.1 Chromatograms of standard mixture (A) and sample (B)
Phenomenex C18色谱柱(150 mm×4.6 mm,5 μm);流动相:以甲醇为流动相B,0.1%醋酸为流动相A,选择梯度洗脱(0~5 min,45%→65% B;5~10 min,65%→80%B;10~15 min,80%→75% B; 15~20 min,75%→45% B);流速0.8 mL/min;进样量20 μL;检测波长320 nm;柱温35 ℃。样品和对照品色谱图见图1。
1.3.2对照品溶液的制备
精确称取芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素对照品适量分别置于10 mL容量瓶中,以甲醇溶解稀释、定容,制得对照品溶液,质量浓度分别为740、690、870、600、320、490 μg/mL分别准确量取6 种对照品溶液各0.1 mL于10 mL容量瓶中,稀释甲醇至刻度,得到混合对照品溶液,置于冰箱(4 ℃)中避光保存。
1.3.3供试品溶液的制备
精确称取干燥且已过60 目筛的仙鹤草粉末0.1 g,依次加入6 mL甲醇溶液和4 mL水,超声(160 W,4 kHz)萃取40 min,取萃取液上层清液离心(6 000 r/min)10 min,取上层清液过滤(0.45 μm有机滤膜),制得供试溶液,混合对照品和样品的色谱图如图1所示。
2 结果与分析
2.1线性关系考察
精确吸取混合对照品溶液(1.3.2节制得),以甲醇和水逐步稀释为8 个不同质量浓度的混合对照品溶液,由低质量浓度到高质量浓度依次进样3 次,并以1.3.1节色谱条件进行分析。最后以对照品质量浓度为横坐标X,平均峰面积为纵坐标Y,进行线性回归。6 种被测成分的线性关系考察结果见表1。
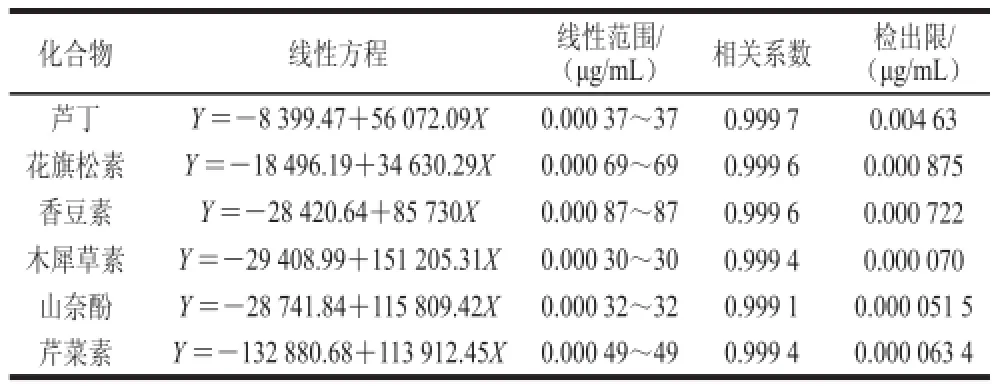
表1 6 种被测成分的线性方程、线性范围和相关系数Table 1 Regression equations with linear range and correlation coeffi cients for 6 compounds
2.2精密度
取混合对照品溶液重复进样6 次,测定各个对照品的峰面积,结果芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素平均峰面积的相对标准偏差(relative standard deviation,RSD)分别为1.87%、1.32%、1.90%、1.38%、0.93%、1.49%、1.77%,表明仪器精确度良好。
2.3重复性
称取同一批样品6 份制备供试品溶液(制备方法同1.3.3节),分别进样分析,结果显示芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素的峰面积RSD(n=6)分别为1.02%、1.94%、1.64%、1.44%、1.40%、1.45%,证明仪器重复性良好。
2.4样品含量的测定及回收率实验
取仙鹤草粉末制备供试品溶液3 份(以1.3.3节中的方法),每份样品进样2 次测定分析,根据表1中得到的线性方程计算出样品中各个成分的含量,见表2。称取9 份同一批次仙鹤草粉末各0.1 g,每3 个为一组,每组按照低、中、高分别加入对应含量的对照品溶液,再按照1.3.3节制备供试品,得到3 组9 个样品溶液,从低质量浓度到高质量浓度进样测定分析,计算平均回收率。
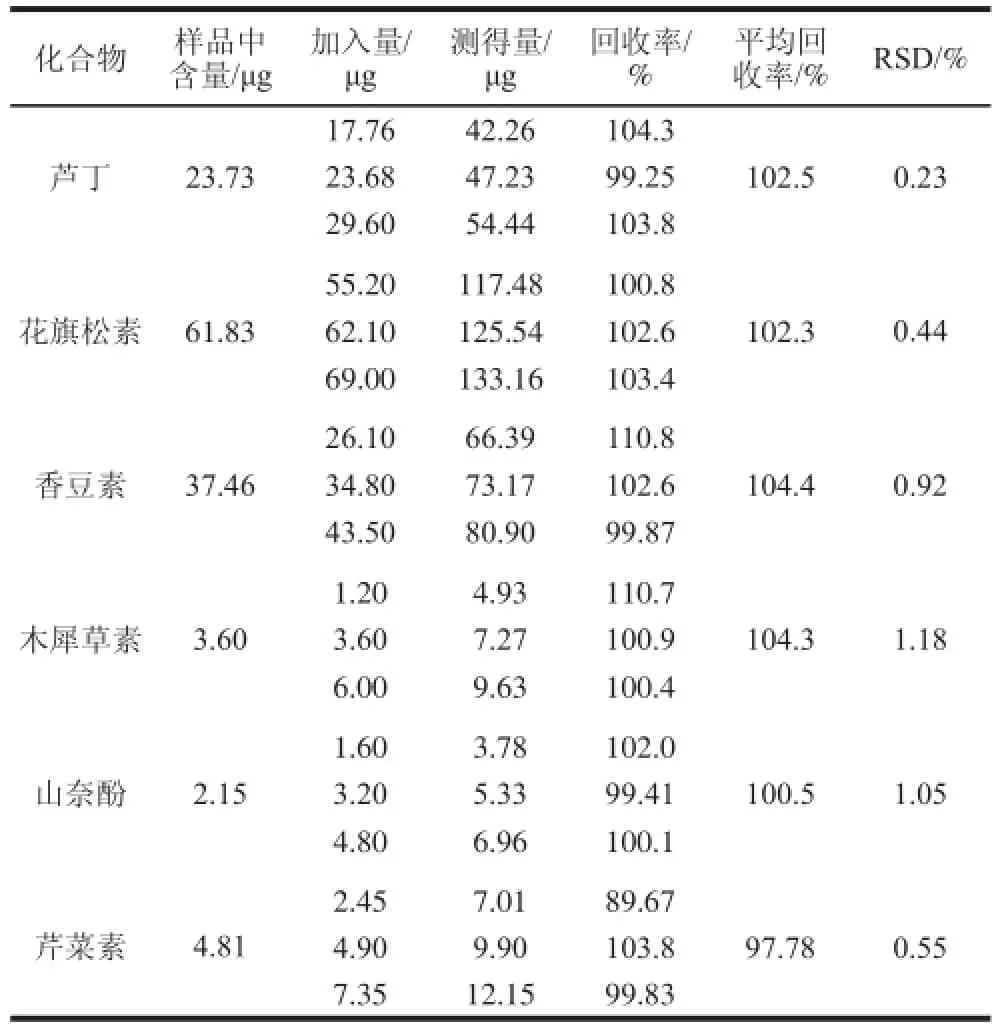
表2 样品含量测定及加标回收率实验(n=3)Table 2 Analytical results of real samples and recovery of spiked standards (n= 3)
2.5分析条件优化
2.5.1流动相的选择
本实验分别比较了乙醇-水、甲醇-水、乙腈-水作为流动相的分离效果,结果表明,用乙醇-水为流动相时,花旗松素和香豆素分离效果差;以乙腈-水作为流动相分离时,芹菜素和山奈酚相对应的峰出现重叠,无法完全分离;以甲醇-水作为流动相分离时,能实现基线分离,但各组分峰宽且不对称。为实现各组分的基线分离并得到良好的峰形,本研究进一步实验了甲醇-醋酸溶液为流动相时的分离效果,并尝试不同体积分数醋酸溶液以达到最佳分离效果,结果表明,流动相为甲醇-0.1%醋酸溶液时,各组分分离效果好,且峰形良好。在尝试以不同比例的甲醇-醋酸溶液进行等度洗脱,发现均不能实现基线良好分离;实验梯度选择,并不断改变甲醇比例,最后得到最佳梯度为:0~5 min,45%→65% B;5~10 min,65%→80% B;10~15 min,80%→75% B;15~20 min,75%→45% B。
2.5.2提取溶剂的选择
本实验比较了甲醇、乙醇和环己烷3 种提取溶剂的提取效果,结果发现,以乙醇作为提取剂时,没有提取得到花旗松素成分;以环己烷作为提取剂时,提取出的芦丁、花旗松素的含量非常低;以甲醇作为提取剂时,提取率较乙醇和环己烷的提取率都高,故选择甲醇作为提取剂。同时本实验进一步比较了甲醇和水不同比例时6 种黄酮的提取率,发现在体积分数60%时提取的6 种黄酮总量最高,故选择体积分数60%甲醇-水溶液作为最终的提取剂,提取溶剂对6 种黄酮总量的影响见图2。
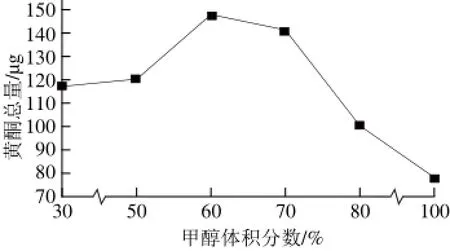
图2 提取溶剂对6 种黄酮总量的影响Fig.2 Effect of extraction solvents on the total recovery of 6 fl avones
2.5.3萃取时间和萃取功率的影响
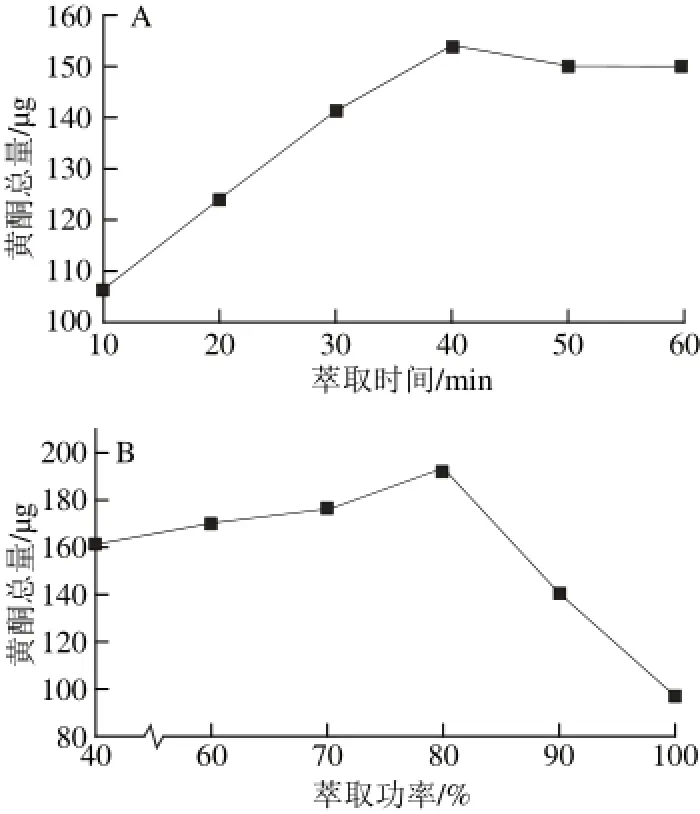
图3 萃取时间(A)、萃取功率(B)对6 种黄酮总量的影响Fig.3 Effect of extraction time and ultrasonic power on the total recovery of 6 fl avones
比较了甲醇超声时间分别为10、20、30、40 min和50 min时所测组分黄酮总量,结果表明样品超声40 min得到的所测组分的黄酮总量最高,故选择40 min为萃取时间,萃取时间对6 种黄酮总量的影响见图3A。同时进一步比较了40%、50%、60%、70%、80%、100%功率条件下所测组分浸出率,结果表明在最大功率的80%(160 W)时提取出的6 种黄酮总量最高,故选择最大功率的80%(160 W)为萃取功率,萃取功率对6 种黄酮总量的影响见图3B。
2.5.4波长和液固比的选择
芦丁、香豆素、木犀草素、山奈酚和芹菜素在波长360 nm处均有较强的紫外吸收,花旗松素在波长290 nm处有较强的紫外吸收。本实验比较了波长290、300、310、320、330、340、360 nm对样品的检测,结果表明,当波长大于320 nm后,无法检测到花旗松素,而当波长小于310 nm以后,芦丁、香豆素、木犀草素、山奈酚和芹菜素紫外吸收很低,导致出峰不明显,由此选择波长320 nm作为检测波长。同时本实验还比较了液固比分别为20∶1、30∶1、50∶1、60∶1、80∶1和100∶1(mL/g)的提取效果,结果表明当液固比为100∶1时,所测组分黄酮总量最高,故选择液固比为100∶1作为最终的提取液固比。
2.6稳定性
吸取同一供试溶液2 d内每隔3 h进样测分析,结果表明芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素峰面积RSD分别为1.73%、1.33%、1.43%、1.77%、1.53%、1.97%,由此表明该方法具有良好的稳定性。
3 结 论
本实验讨论了萃取时间和萃取功率对6 种黄酮总量的影响,实验发现,当萃取时间达到40 min时,随着萃取时间的延长,黄酮总量不增反减,从经济、环保等多方面综合考虑,最终选择40 min为萃取最佳时间。查阅已报道的关于高效液相测试自然产物的文献,在优化分析条件方面主要是针对萃取溶剂和流动相的优化,本实验针对萃取功率进行优化,发现在最大功率时并不能到达最大提取率,而在最大功率的80%时6 种黄酮总量最高,故以此作为最佳萃取功率。
相关仙鹤草中黄酮成分含量测定的文献报道很多,如刘磊等[26]用反相-高效液相色谱法以甲醇-乙腈-0.2%磷酸为流动相测定仙鹤草药材中槲皮素的含量,亦有赵艳霞等[27]以高效液相色谱法测定仙鹤草中山奈酚-3-O-(6-p-香豆酰基)-β-D-吡喃葡萄糖苷的含量,但尚未有对仙鹤草中芦丁、花旗松素、香豆素、木犀草素、芹菜素和山奈酚6 种黄酮含量同时测定的报道。本实验利用甲醇辅助超声萃取条件下高效液相色谱法测定仙鹤草中芦丁、花旗松素、香豆素、木犀草素、山奈酚和芹菜素6 种黄酮成分的含量,15 min所有组分完全出峰,6 种黄酮含量测定结果分别为237.3、618.3、374.6、36.0、21.5、48.1 μg/g。实验结果满意且重复性良好,实验操作简单快捷,可以用于药用仙鹤草中黄酮的测定。
临床应用中,仙鹤草主要的有效成分是鹤草酚,本实验测定结果表明仙鹤草里面的黄酮总含量也较高,且黄酮成分本身药用价值高,因此在临床应用时不应仅以鹤草酚含量作为仙鹤草质量监控指标,其中黄酮类含量也不容忽视。本实验建立的以甲醇辅助萃取条件下利用高效液相测定仙鹤草中6 种黄酮的含量,为仙鹤草的深入开发和质量控制提供新的参考。
[1] 国家药典委员会. 中华人民共和国药典: 一部[S]. 北京: 化学工业出版社, 2005: 67.
[2] 费鲜明, 陈艳, 吴万飞, 等. 仙鹤草水提物体外对血小板聚集、凝血功能及血液流变学的影响[J]. 中国临床药理学与治疗学, 2013,18(1): 10-16.
[3] ZHU Liancai, TAN Jun, WANG Bochu. Antioxidant activities of aqueous extract from Agrimonia pilosa Ledeb and its fractions[J]. Chemistry and Biodiversity, 2009, 10(6): 1716-1726.
[4] KASAI S, WATANABLE S, KAWABATA J. Antimicrobial catechin derivatives of Agrimonia pilosa[J]. Phytochemistry, 1992, 31(3): 787-789.
[5] KIM J J, JIANG J, SHIM D W. Anti-infl ammatory and anti-allergic effects of Agrimonia pilosa Ledeb extract on murine cell lines and OVA-induced airway infl ammation[J]. Journal of Ethnopharmacology,2012, 140(2): 213-221.
[6] 宛春雷, 金哲雄. 仙鹤草鞣质成分的抗肿瘤作用研究[J]. 黑龙江医药, 2011, 24(1): 29-31.
[7] 蒋望洪, 王晓东, 金杨君. 仙鹤草的临床应用进展[J]. 世界最新医学信息文摘: 电子版, 2013, 13(11): 321-321.
[8] 周雪梅. 仙鹤草黄酮及三萜组分多途径干预Ⅱ型糖尿病的研究[D].重庆: 重庆大学, 2012.
[9] KOUNO L, BABA N, OHNI Y. Triterpenoids from Agrimonia pilosa[J]. Phytochemistry, 1988, 27(1): 297-299.
[10] PEI Y H, LI X, ZHU T R. Studies on the chemical constituents from the root-sprouts of Agrimonia pilosa Ledeb[J]. Acta Pharmaceutica Sinica, 1989, 24(6): 431-437.
[11] 余昕, 朱烨, 李春红, 等. 泸州仙鹤草不同采收期总黄酮含量的测定[J]. 泸州医学院学报, 2012, 35(1): 41-44.
[12] 赵莹, 刘金平, 李平亚. 仙鹤草化学成分及药理研究进展[J]. 特产研究, 2001, 23(1): 50-53.
[13] 杜成智, 王卉, 冯旭, 等. 不同产地仙鹤草挥发油成分的GC-MS分析[J]. 江苏农业科学, 2014, 42(4): 253-255.
[14] 沙世炎. 鹤草芽中鹤草酚的薄层扫描定量法[J]. 中国药学杂志,1980, 15(7): 294-296.
[15] KATOA H, LI W, KOIKE M. Phenolic glycosides from Agrimonia pilosa[J]. Phytochemistry, 2010, 71(16): 1925-1929.
[16] TAIRA J, NANBU H N, UEDA K U. Nitric oxide-scavenging compounds in Agrimonia pilosa Ledeb on LPS-induced RAW264.7 macrophages[J]. Food Chemistry, 2009, 115(4): 1221-1227.
[17] KUO S M, LEAVITT P S, LIN C P. Dietary fl avonoids interact with trace metals and affect metallothionein level in human intestinal cells[J]. Biological Trace Element Research, 1998, 62(3): 135-153.
[18] BROWNSON D M, AZIOS N G, FUQUA B K. Flavonoid effects relevant to cancer[J]. Journal of Nutrition, 2002, 132(11): 3482-3489.
[19] ANDROUTSOPOULOS V P, PAPAKYRIAKOU A, VOURLOUMIS D. Dietary fl avonoids in cancer therapy and prevention: substrates and inhibitors of cytochrome P450 CYP1 enzymes[J]. Pharmacology and Therapeutics, 2010, 126(1): 9-20.
[20] 王勇, 赵海燕. 植物黄酮类治疗糖尿病药理机制的研究进展[J]. 医学综述, 2010, 16(4): 612-615.
[21] GU X Q, LI H Q, QI B L. TLC densitometric determination of agrimophol in the buds of Agrimoniar pilosa[J]. 中草药, 1980, 6(8): 346-348.
[22] 李强, 张荣强. 仙鹤草原药材及提取物的红外光谱的分析与鉴定[J].北方药学, 2011, 8(6): 4-5.
[23] XU X Q, QI X Z, WANG W. Separation and determination of flavonoids in Agrimonia pilosa Ledeb by capillary electrophoresis with electrochemical detection[J]. Journal of Separation Science, 2005,28(7): 647-652.
[24] JIANG Qinghua, MA Jianghao, WANG Ying. Simultaneous determination of nine major constituents in Agrimonia pilosa Ledeb by HPLC-DADESI-MS/MS[J]. Analytical Methods, 2014, 6(12): 4373-4379.
[25] WANG Yan, LIU Mozhen, ZHENG Lingli. Preparative purification of fi ve bioactive components from Agrimonia pilosa Ledeb by highspeed counter-current chromatography[J]. Journal of Separation Science, 2012, 35(15): 1977-1984.
[26] 刘磊, 王慧. RP-HPLC法测定仙鹤草药材中槲皮素的含量[J]. 齐齐哈尔医学院学报, 2009, 30(11): 1369-1370.
[27] 赵艳霞, 陈芳, 邓雁如. HPLC测定仙鹤草中山奈酚-3-O-(6-p-香豆酰基)-β-D-吡喃葡萄糖苷含量[J]. 中华中医药学刊, 2014, 32(3):644-646.
Determination of Six Flavonoids in Agrimonia pilosa Ledeb by HPLC
GAO Yi, ZHOU Guangming*, CHEN Junhua, QIN Hongying
(Key Laboratory on Luminescence and Real-Time Analysis, Ministry of Education, School of Chemistry and Chemical Engineering,Southwest University, Chongqing 400715, China)
Objective: To establish a high performance liquid chromatography (HPLC) method for separation and quantifi cation of rutin, taxifolin, coumarin, luteolin, kaempferol and apigenin in Agrimonia pilosa Ledeb by ultrasonic-assisted extraction. Methods: The separation of six flavonoids was performed on Phenomenex C18column (150 mm × 4.6 mm,5 μm) using step gradient elution. The mobile phase was composed of methanol and 0.1% acetic acid at a fl ow rate of 0.8 mL/min. The UV detection wavelength was 320 nm and the column temperature was set at 35 ℃. Results: Good separation of rutin, taxifolin, coumarin, luteolin, apigenin and kaempferol was achieved within 15 min. Calibration curves of all the six components showed an excellent linear relationship (r ≥ 0.999 1, n = 6). The average recoveries were between 97.78% and 104.4% with a relative standard deviation (RSD) of < 1.20%. Conclusion: This method, based on ultrasonic-assisted extraction, is simple, fast, economical and reliable.
high performance liquid chromatography (HPLC); Agrimonia pilosa Ledeb; ultrasonic-assisted extraction;fl avonoids; quantitation
O652.62
A
1002-6630(2015)18-0093-04
10.7506/spkx1002-6630-201518017
2015-01-26
国家自然科学基金面上项目(21277110)
高意(1991—),女,硕士研究生,研究方向为色谱分析。E-mail:raining@swu.edu.cn
周光明(1964—),男,教授,博士,研究方向为色谱及其联用技术。E-mail:gmzhou@swu.edu.cn

