金属硫蛋白基因表达水平评估青海不同地区的重金属污染程度
薛艳锋,罗毅皓,刘祥军,谢凤莲,蒋国斌,孙万成,*
(1.青海大学畜牧兽医科学院,青海 西宁 810016;2.青海大学农牧学院,青海 西宁 810016)
金属硫蛋白基因表达水平评估青海不同地区的重金属污染程度
薛艳锋1,罗毅皓2,刘祥军2,谢凤莲2,蒋国斌2,孙万成2,*
(1.青海大学畜牧兽医科学院,青海 西宁 810016;2.青海大学农牧学院,青海 西宁 810016)
为揭示青海不同地区重金属污染的潜在生态风险,从玉树、果洛、海晏、刚察、共和5个 地区的牦牛肝脏样品中提取总RNA,在逆转录聚合酶的作用下生成cDNA,以逆转录产物为模板,利用实时定量PCR检测牦牛金属硫蛋白基因的表达水平。若将刚察地区牦牛肝脏金属硫蛋白cDNA实时荧光定量值作为对照组,2-ΔΔCt值设定为1时,则玉树、果洛、海晏、共和地区的牦牛肝脏金属硫蛋白cDNA实时荧光定量值分别为0.669、0.624、0.529、1.320,并且通过酶联免疫反应测定的牦牛体内金属硫蛋白的含量,相互印证,从而更加准确地评估青海不同地区牦牛机体重金属暴露水 平,以便对牦牛产品安全进行评价。基因表达和酶联免疫反应的实验结果都表明,共和与刚察地区的重金属污染可能较为严重。
金属硫蛋白;实时定量聚合酶链式反应;基因表达;牦牛;酶联免疫吸附测定
随着工业化进程的加快,青海各地区也受到了重金属不同程度的污染,且重金属具有亲脂性、难降解性和高富集性[1-2],严重威胁着食品安全。金属硫蛋白(metallothionein,MT),分子质量为6 000~7 000 D,每个MT分子含有61 个氨基酸,可以结合7~12 个金属离子[3],是一种分子质量低,疏基含量高,能大量结合重金属离子的蛋白质。MT分子有2 个独立的结构域α和结构域β[4-5],整个分子呈哑铃状。MT最早是由Margoshes等从马的肾脏中发现并且分离出来的[6],随后在高等植物、真核微生物、原核微生物当中也发现并且分离得到了MT[7],证明了MT是普遍存在于各种生物体中[8-9],李令媛等[10-11]也在大鲵、刺猬中也分离得到了MT。MT的生物学功能:清除自由基,抵抗电离辐射[12-14],解毒[15],参与微量元素的代谢[16-18],调控机体免疫能力和生长发育[19]。MT基因的表达受到多种因素的影响[20],重金属是最强的诱导剂[21],可以将MT表达量提高成百上千倍,因此,MT可以作为生物体内重金属污染的一个重要的生物学标志[22],通过检测生物体内MT的含量变化,来预测生物体受重金属污染的情况,已经成为了近些年研究的热点。但多数是测定水生生物体内MT的含量来反应水质污染程度[23-26],还没有人通过测定牦牛体内MT含量和MT基因的表达量来评估不同牧场的重金属污染程度。
青海各个地区的牧场受到了重金属不同程度地污染,从而使牦牛的肉和乳重金属含量出现不同程度超标,因此本实验通过MT基因实时定量聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)表达差异分析,评估不同地区牦牛体内重金属的暴露水平。利用PCR技术研究MT基因的相对定量表达水平,即利用实时荧光定量PCR技术定量测定牦牛肝脏中的MT。首先,从不同地区的牦牛肝脏中提取总RNA,然后在逆转录聚合酶的作用下生成cDNA,以逆转录产物为模板,实施RT-PCR检测MT基因的表达水平。同时,通过酶联免疫(enzyme linked immuno sorbent assay,ELISA)反应,直接测定青海不同地区牦牛肝脏样品中的MT含量,与前面通过实时定量测得的MT基因的表达水平对比,再次印证,从而保证得到MT含量的正确性。然后,根据MT含量,正确评估青海不同地区牦牛肉与乳的重金属暴露水平,以便对牦牛肉乳品质评价、食品安全及环境保护提出指导性的建议。
1 材料与方法
1.1材料与试剂
分别从青海省的玉树、果洛、海晏、刚察、共和这5 个地区,采集现杀的不同牦牛的肝脏组织(采集样品所用的手术刀、镊子等严格灭菌),迅速装于冷冻管中,保存在液氮罐中,带回实验室后,将样品从液氮罐中取出,保存于-80 ℃冰箱中,备用。
氯仿、异丙醇、乙醇 上海友盛化工科技有限公司;RNase-free water、RNAiso Plus、反转录试剂盒、荧光定量染料 日本TaKaRa公司;MT ELISA试剂盒、乙二胺四乙酸二钠、柠檬酸钠、聚丁二酸丁二醇酯缓冲液(pH 7.4) 上海江莱生物科技有限公司。
利用GenBank中介绍的牦牛(Bos grunniens)MT基因GenBank Accession No:AY513744,通过核心序列设计5'和3'端特异性引物利用Primer Premier 5.0软件设计引物(表1),引物均由上海生工生物工程技术服务有限公司合成。

表1 牦牛MT基因cDNA克隆引物Table 1 cDNA cloning primers of yak metallothionein gene
1.2仪器与设备
PCR扩增仪、RT-PCR仪、核酸电泳仪 美国Bio-Rad公司;高速冷冻离心机 美国Sigma公司;凝胶成像系统 英国Syngene公司;移液枪 上海生工生物工程技术服务有限公司。
1.3方法
1.3.1总RNA的提取
将超低温冻结的RNA提取样品(牦牛肝脏样品)迅速转移至用液氮预冷过的研钵中,用研杵研磨组织,其间不断加入液氮冷却,直至将样品研磨成粉末状;向研钵中加入1.5 mL的RNAiso Plus匀浆,将研磨成粉末状的样品完全覆盖;室温静置,直至样品完全融化,再用研杵继续研磨至裂解液呈透明状;使用移液枪将匀浆液转移至离心管中,室温静置5 min;在12 000 r/min,4 ℃条件下离心5 min;小心吸取上清液,使用移液枪转移到新的离心管中(切勿触及、吸取沉淀);向上述匀浆裂解液中加入氯仿300 μL(RNAiso Plus的1/5体积量),用手剧烈振荡15 s,待溶液充分乳化后,再室温静置5 min;在12 000 r/min,4 ℃条件下离心15 min;吸取上清液转移至另一新的离心管中(切忌吸出白色中间层);向上清液中加入等体积提前预冷过的异丙醇,上下颠倒离心管充分混匀后,在15~30 ℃条件下静置10 min;12 000 r/min,4 ℃条件下离心10 min;弃去上清液,缓慢地沿离心管壁加入提前预冷的体积分数75%乙醇溶液l mL(切勿触及沉淀),轻轻上下颠倒,洗涤离心管管壁;在12 000 r/min,4 ℃条件下离心5 min;使用移液枪小心弃去乙醇,切勿触及沉淀,剩下的少量乙醇,让其自然挥发除去。室温干燥沉淀2~5 min,加入适量的RNA-free water溶解沉淀后,-80 ℃条件下保存。
1.3.2cDNA的合成
将提取到的牦牛肝脏样品的总RNA进行反转录,主要参考TaKaRa反转录试剂盒进行,采用10 μL反转录体系,进行PCR扩增得到cDNA。反转录反应条件如下:37 ℃,15 min(反转录反应);85 ℃,5 s(反转录酶的失活反应)。
1.3.3RT-PCR反应
以合成的牦牛肝脏样品的cDNA为模板,按TaKaRa试剂盒推荐方法在冰盒上进行操作。加入引物MT1F1-MT1R1进行RT-PCR,同时选择内参β-actinF1-β-actinR1进行RT-PCR作为对照。两步法PCR扩增标准程序:循环 1:预变性,95 ℃,30 s;循环40:PCR反应,95 ℃,5 s,60 ℃,30 s。
1.3.4ELISA反应
按照ELISA试剂盒,采用双抗体夹心法测定样品中MT水平。用纯化的MT抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入MT,再与HRP标记的MT抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化条件下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的MT呈正相关。用酶标仪在波长450 nm处测定吸光度,通过标准曲线计算样品中MT含量。
2 结果与分析
2.1提取的RNA检测
图1 不同地区牦牛肝脏样品RNA电泳图Fig.1 RNA electrophoretogram of yak liver samples from different regions
提取出的不同地区牦牛肝脏样品的总RNA在质量分数1.2%琼脂糖凝胶上的电泳结果。由图1可以清楚地看到28S、18S、5S三条亮带,且28S条带亮度大概是18S条带亮度的2 倍。
2.2牦牛肝脏MT基因cDNA的合成
图2 cDNA经PCR扩增成DNA的电泳图Fig.2 Electrophoretogram of DNA fragment amplifi ed from cDNA by PCR
图2由提取的总RNA反转录后合成cDNA,再通过普通PCR扩增成DNA得到的电泳图。利用在编码区两侧设计的牦牛MT-Ⅰ和MT-Ⅱ通用引物扩增目的DNA,获得约190 bp的DNA片段[27],本实验应用DL5 000的Marker可以看出在100~250 bp之间。
2.3MT基因PCR荧光定量
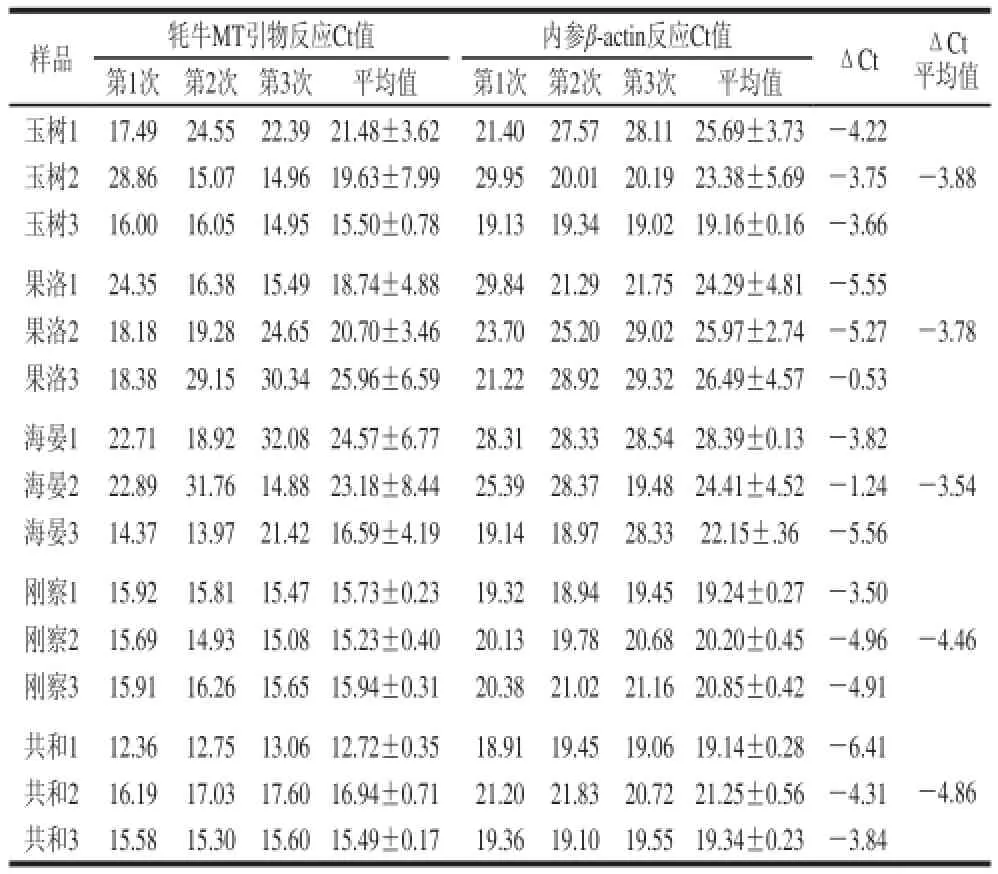
表2 不同地区牦牛MT基因荧光定量PCRTable 2 Fluorescence quantitative PCR of metallothionein gene of yaks from different regions
表3 不同地区牦牛MT基因的Ct值对比(x±s)Table 3 Comparison of the Ct values of metallothiof yaks from different regions(x±s)

表3 不同地区牦牛MT基因的Ct值对比(x±s)Table 3 Comparison of the Ct values of metallothiof yaks from different regions(x±s)
地区玉树果洛海晏刚察共和引物MT反应Ct18.87±4.1321.80±4.9821.45±6.4715.63±0.3115.05±0.41内参β-actin反应Ct22.74±3.1925.58±4.0424.98±3.3420.10±0.3819.91±0.36
通过比较阈值法(2-ΔΔCt)进行相对定量[22]。循环次数(cycle times,Ct)为样品中PCR扩增反应的荧光信号到达设定的域值时所经历的循环数。以刚察地区的牦牛肝脏样品作为对照样,并将其2-ΔΔCt值设为1进行阈值比较,如表2、3所示。

计算得出:玉树:2-(-3.88+4.46)=0.669;果洛:2-(-3.78+4.46)=0.624;海晏:2-(-3.54+4.46)=0.529;共和:2-(-4.86+4.46)=1.320。
由上述公式计算得到的结果可以看到MT相对定量的拷贝数(图3)。
本实验以青海省的玉树、果洛、海晏、刚察、共和这5 个地区的牦牛肝脏为样品,通过对MT的DNA重复3 次进行荧光定量PCR检测法,测出它们的平均ΔCt值,再根据比较阈值法进行相对定量得到最后的结果。
由图3可以看出,共和地区的牦牛样肝脏品中的MT相对定量的拷贝数最高,接下来依次是刚察、玉树、果洛、海晏。由此可以得到,青海不同地区牦牛肝脏样品中的MT含量从高到低依次为共和、刚察、玉树、果洛、海晏。

图3 MT相对定量拷贝数Fig.3 Relative quantitative copy number of metallothionein gene
根据测定的各个地区的Ct值,利用SPSS 16.0分析软件计算得出5 个地区MT含量的差异显著性如表4所示。

表4 不同地区牦牛MT含量差异显著性分析Table 4 Signifi cance analysis on the difference in metallothionein contents of yak livers from different regions

表5 ELISA反应测定的不同地区牦牛MT含量Table 5 Metallothionein contents of yak livers from different regions determined by ELISA

图4 ELISA反应测定的不同地区牦牛MT含量Fig.4 Metallothionein contents of yak livers from different regions determined by ELISA
由表5和图4可知,ELISA反应所测定MT的含量从高到低依次是:共和、刚察、果洛、海晏、玉树,但是5个地区的含量差异都不显著(P>0.05)。
ELISA反应测得的不同地区的牦牛样品中MT的含量(图4),也可以明显看出,共和地区的牦牛样品中MT含量比对照组高,而玉树、果洛、海晏3 个地区牦牛MT的含量比对照组低,这也正好印证了通过相对定量法测定的不同地区牦牛体内MT含量的差异对比。基因表达和ELISA反应2 种方法的测定结果基本相符,提高了所测定MT含量结果的正确性和可信度。由于MT可以作为潜在的新型生物标志物,用来评价重金属对环境生态系统的生物效应,可以判断出共和地区牦牛重金属污染严重。而造成污染的原因可能有:工业化进程加快及矿产资源的开发利用;矿产企业多为小企业,缺乏必要的技术管理及生产设备,出现随意排放污水及矿业废渣的情况;青海的畜产品安全风险监测评估与预警工作基础薄弱,对有害因素的风险监测与评估尚处起步阶段。
3 结 论
根据MT基因的表达水平可知,玉树、果洛、海晏、刚察、共和5 个地区的样品ΔCt的平均值分别为-3.88、-3.78、-3.54、-4.46、-4.86。利用2-ΔΔCt进行比较,将刚察样品的2-ΔΔCt设定为1,再通过计算得到玉树、果洛、海晏、刚察、共和5 个地区样品的2-ΔΔCt分别为0.669、0.624、0.529、1.000、1.320。根据ELISA反应的测定结果可知,玉树、果洛、海晏、刚察、共和5 个地区的样品MT含量分别为732.82、746.97、739.61、776.96、778.66 ng/L。
共和地区牦牛MT基因表达量比对照组高,表明共和地区牦牛肝脏含有的MT比对照组多。玉树、果洛、海晏3 个地区牦牛MT表达量比对照组低,表明玉树、果洛、海晏3 个地区牦牛肝脏含有的MT比对照组低。并且,ELISA反应测定的结果也是共和MT含量高于对照组,而玉树、果洛、海晏MT含量低于对照组。因此,可以判定青海省共和、刚察2个牧场的重金属污染程度较重,而玉树、果洛、海晏的重金属污染程度较轻。对于重金属污染程度较重的共和、刚察地区必须严格规范矿产资源的开发和利用,严防工业污水和矿产废渣的随意排放,另外,必须加强这2 个地区畜产品的安全评估,确保食品质量安全。
[1] WANG Wenxiong, KE Caihuan. Dominance of dietary intake of cadmium and zinc by two marine predatory gastropods[J]. Aquatic Toxicology, 2002, 56(3): 153-165.
[2] 毕春娟, 陈振楼, 许世远, 等. 长江口潮滩大型底栖动物对重金属的累积特征[J]. 应用生态学报, 2006, 17(2): 309-314.
[3] 蔡震峰, 任凤莲. 金属硫蛋白的研究进展[J]. 应用化工, 2007, 36(2):187-190.
[4] 茹炳根. 一种新型食品添加剂: 金属硫蛋白[J]. 精细与专用化学品,2002, 10(8): 15-16.
[5] ZHOU Yuanjiao, LI Lingyuan, RU Binggen. Expression purifi cation and characterization of β domain and β domain dimmer of metallothionein[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2000, 1524(2): 87-93.
[6] 刘志勇, 魏国林. 金属硫蛋白研究进展[J]. 江西科学, 2004, 22(6):105-109.
[7] 刘安玲, 朱必凤. 金属硫蛋白的研究进展[J]. 韶关学院学报: 自然科学版, 2001, 22(3): 86-91.
[8] MARGOSHES M, VALLEE B L. A cadmium protein from equine kidney cortex[J]. Journal of the American Chemical Society, 1957,79(17): 4813-4814.
[9] COBBETT C, GOLDSBROUGH P. Phytochelatins and metallothioneins:roles in heavy metal detoxifi cation and homeostasis[J]. Annual Review of Plant Biology, 2002, 53(1): 159-182.
[10] 李令媛, 马宏安, 安钰, 等. 镉诱导大鲵肝脏与肠金属硫蛋白的分离纯化与鉴定[J]. 北京大学学报: 自然科学版, 1996, 32(4): 534-541.
[11] 李令媛, 马宏安, 吕迎春, 等. 金属诱导条件下刺猬各组织器官金属硫蛋白含量比较分析[J]. 兽类学报, 1995, 15(1): 65-70.
[12] 田晓丽, 郭军华. 金属硫蛋白的研究进展[J]. 国外医学: 药学分册,2005, 32(2): 119-124.
[13] 郝守进, 茹炳根. 金属硫蛋白及其在食品工业应用中的研究进展[J].食品 与发酵工业, 2002, 28(8): 62-67.
[14] CAI L, SATOH M, TOHYAMA C, et al. Metallothionein in radiation exposure: its induction and protective role[J]. Toxicology, 1999,132(2): 85-98.
[15] PARK J D, LIU Y, KLAASSEN C D. Protective effect of metallothionein against the toxicity of cadmium and other metals[J]. Toxicology, 2001, 163(2): 93-100.
[16] 闫海亮, 张晶, 丁洪浩, 等. 金属硫蛋白及其诱导、分离纯化研究进展[J]. 饲料工业, 2007, 28(24): 52-54.
[17] SCHMIDT C, BEYERSMANN D. Transient peaks in zinc and metallothionein levels during differentiation of 3T3L1 cells[J]. Archive of Biochemistry and Biophysics, 1999, 364(1): 91-98.
[18] COYLE P, PHILCOX J C, ROFE A M. Metallothionein null mice absorb less Zn from an egg white diet, but a similar amount from solutions, although with altered inter tissue Zn distribution[J]. The Journal of Nutrition, 1999, 129(2): 372-379.
[19] PRASAD A S. Role of metallothioneins in human health[J]. Journal of Laboratory and Clinical Medicine, 1992, 120(3): 357-358.
[20] 陈春, 周启星. 金属硫蛋白作为重金属污染生物标志物的研究进展[J].农业环境科学学报, 2009, 28(3): 425-432.
[21] 陈春, 周启星. 蚯蚓金属硫蛋白定量PCR检测方法及其分子诊断[J].中国环境科学, 2011, 31(8): 1377-1382.
[22] ROMERO-ISART N, VASAK M. Advances in the structure and chemistry of metallothioneins[J]. Journal of Inorganic Biochemistry,2002, 88(3): 388-396.
[23] CHAN K M. Concentrations of copper, zinc, cadmium and lead in rabbit fish (Siganus oramin) collected in Victoria Harbour, Hong Kong[J]. Marine Pollution Bulletin, 1995, 31(4): 277-280.
[24] PEDERSEN S N, LUNDEBYE A K, DEPLEDGE M H. Field application of metallothionein and stress protein biomarkers in the shore crab (Carcinus maenas) exposed to trace metals[J]. Aquatic Toxicology, 1997, 37(2): 183-200.
[25] QUIRÓS L, PIÑA B, SOLÉ M, et al. Environmental monitoring by gene expression biomarkers in barbus graellsii: laboratory and field studies[J]. Chemosphere, 2007, 67(6): 1144-1154.
[26] NIKPOUR Y, ZOLGHARNEIN H, SINAEI M, et al. Evaluation of metallothionein expression as a biomarker of mercury exposure in Scatophagus argus[J]. Pakistan Journal of Biological Sciences, 2008,11(18): 2269-2273.
[27] 马彬云, 任宏伟, 吴建平, 等. 牦牛MT-Ⅰ/-ⅡcDNA分子克隆及其蛋白质结构分析[J]. 中国生物工程杂志, 2005, 25(4): 62-68.
Assessment of Heavy Metal Pollution by Expression of Yak Metallothionein Gene in Qinghai
XUE Yanfeng1, LUO Yihao2, LIU Xiangjun2, XIE Fenglian2, JIANG Guobin2, SUN Wancheng2,*
(1. Academy of Animal Science and Veterinary Medicine, Qinghai University, Xining 810016, China;2. College of Agriculture and Animal Husbandry, Qinghai University, Xining 810016, China)
In order to study the potential risk of heavy metal contamination in Qinghai, total RNA was extracted from yak liver samples from fi ve regions, Yushu, Guoluo, Haiyan, Gangcha and Gonghe, and then cDNA was generated under the action of reverse transcription polymerase. The product of reverse transcription reaction was fi nally used to carry out RTPCR and detect the expression levels of metallothionein (MT) gene. The results showed that when yak liver sample from Gangcha was taken as the control group and the value of 2-ΔΔCtwas set to be 1, the fl uorescence quantitative values of yak livers from Yushu, Guoluo, Haiyan and Gonghe were 0.669, 0.624, 0.529 and 1.320, respectively. Meanwhile, these results were confi rmed by comparison with those of ELISA reaction. The exposure levels of heavy metal in yak body from different regions in Qinghai were evaluated, so that we could come up with assessment to yak production safety. Both the results of gene expression (mRNA level) and ELISA reaction (protein level) displayed that the most serious pollution regions of heavy metal were Gonghe and Gangcha.
metallothionein; real-time polymerase chain reaction; gene expression; yak; enzyme-linked immuno sorbent assay
TS201.2
A
1002-6630(2015)18-0177-05
10.7506/spkx1002-6630-201518032
2015-01-16
国家自然科学基金重点项目(31160125)
薛艳锋(1990—),男,硕士研究生,研究方向为动物营养与饲料科学。E-mail:945982845@qq.com
孙万成(1972—),男,教授,博士,研究方向为食品质量与安全。E-mail:sun.wancheng0108@aliyun.com

