CDK2-AP1通过调控细胞周期抑制乳腺癌生长
何向明 黄润 俞洋 向华 杨红健 宗祥云★
·论著·
CDK2-AP1通过调控细胞周期抑制乳腺癌生长
何向明 黄润 俞洋 向华 杨红健 宗祥云★
目的 探讨CDK2-AP1在乳腺癌的作用及其机制。方法 分别在正常乳腺组织及不同分期乳腺癌组织中检测CDK2-AP1的表达情况;进行CDK2-AP1的LOF & GOF细胞功能实验;接种CDK2-AP1干扰或过表达的乳腺癌细胞及对照细胞在裸鼠观察成瘤及相应指标。结果 在乳腺癌存在CDK2-AP1表达降低/缺失而CDK2/CyclinD1表达升高的情况,且CDK2-AP1的表达在正常乳腺组织细胞、乳腺导管原位癌、侵袭性乳腺癌、复发转移性乳腺癌渐次降低(P<0.001),与CDK2/CyclinD1相反。体内、外实验均发现抑制CDK2-AP1表达后乳腺癌细胞周期后移、增殖加快;过表达CDK2-AP1的乳腺癌细胞周期阻滞在G0/G1和G2/M期,生长受抑制、裸鼠成瘤速度及大小均受抑制。结论 CDK2-AP1的表达降低以至缺失促进乳腺细胞进入恶性增殖形成肿瘤,缺乏细胞周期负性调控的乳腺癌细胞增殖能力增强。
乳腺癌 CDK2-AP1 细胞周期
细胞周期激酶2相关蛋白1(CDK2-AP1)是CDK2基因的特异性负向调节蛋白,文献报道其表达降低引起TGF-β-Smad 信号通路失活,导致细胞恶性增殖。且在化疗药物介导的DNA损伤过程中通过调节CDK2的活性影响肿瘤细胞凋亡[1~5]。CDK2-AP1表达降低还可能与口腔鳞癌、胃癌、食管癌以及前列腺癌的生长、预后有关[6~8]。CDK2-AP1基因在乳腺癌的作用很少报道,本文探讨CDK2-AP1与乳腺癌发生发展的关系。
1 材料和方法
1.1组织标本检测 随机抽取浙江省肿瘤医院组织库标本209例,其中正常乳腺组织40例、乳腺导管原位癌30例、浸润性导管癌121例、复发转移性乳腺癌18例。石蜡切片脱蜡、脱水后免疫组化检测CDK2-AP1表达。染色强度分两组:阳性:>20%肿瘤细胞染色。阴性:≤20%肿瘤细胞染色。
1.2方法 (1)质粒构建:CDK2-AP1全长cDNA由人脑组织PCR扩增获得,通过连接酶反应直接连入酶切后的慢病毒表达载体CMV启动子下游,基因测序选出重组CDK2-AP1基因表达序列正确的载体。CDK2-AP1上、下游扩增引物分别为5'-AGCATGGCAACGTCTTCACAGT-3'、5'-TGGCATTCCGTTCCGTTTCT-3';CDK2-AP1特异性siRNA序列为5'-GCTGCTGGCCATCATTGAAGA-3',对照片段序列为5'-TTCTCCGAACGTGTCACGT-3'。siRNA寡核苷酸退火后连接到pLV3载体生成CDK2-AP1 shRNA和对照shRNA表达质粒。(2)病毒包装 用Qiagen公司质粒抽提试剂盒提取慢病毒包装系统中CDK2-AP1干扰质粒、过表达质粒和慢病毒辅助质粒。使用MISSION Lentiviral Packaging Mix kit (Sigma)按操作步骤将重组质粒、包装载体pGag/Pol、pRev和封装载体pVSV-G共转染至HEK293T。将CDK2-AP1慢病毒按感染复数(MOI)为20,感染6孔板中SK-BR-3细胞获得稳定过表达;同样siCDK2-AP1慢病毒感染MCF-7获得稳定沉默。感染96h后抽提细胞总RNA和蛋白。(3) Realtime RT-PCR:CDK2-AP1扩增引物见上述,内对照GAPDH引物为5'-ACCACAGTCCATGCCATCAC-3'和5'-TCCACCACCCTGTTGCTGTA-3'。两步法行实时荧光定量,40个循环中每次在延伸阶段读取吸光度值;PCR结束后,95℃变性lmin,冷却至55℃,从55℃开始升温至95℃,每一步保持在<30s上升0.5℃,同时读取吸光度值,绘制熔解曲线。(4)Western blot:取30μg等量蛋白加至12% SDS-PAGE凝胶电泳,冰浴、90V恒压条件下电转120min。转好的膜加一抗4℃孵育12h,洗膜3次,用封闭液稀释相应的辣根过氧化物酶共价二抗室温孵育2h,TBST洗膜3次。ECL Western试剂盒(Amersham)显色。(5)MTT assay:转染后乳腺癌细胞培养3d后1×103/孔接种于96孔板,44h后加MTT溶液(5mg/ml)37℃培育4h,弃培养介质,每孔加100μl DMSO室温振荡使充分溶解,检测540nm波长处吸光度值绘制细胞生长曲线。(6)克隆形成实验:转染后乳腺癌细胞对数生长期胰酶消化、完全培养基重悬。800个/孔接种于6孔板,继续培养至每个克隆包含>50个细胞。PBS洗涤细胞2次,多聚甲醛固定后PBS洗涤2次,Giemsa染色,去离子水洗涤3次后计数克隆。(7)细胞周期:转染后乳腺癌细胞1×106/孔接种于12孔板,培养24h后胰酶消化、收集细胞,1500r/min离心5min;1ml预冷PBS洗涤细胞1次,转移至1.5ml离心管,4℃、1500r/min离心5min,50μl预冷PBS重悬并吹散成单细胞悬液,逐滴加入预冷的950μl 70%乙醇中置-20℃ 3h。加入1U DNase-free RNase,37℃孵育30min,1500r/min离心5min,弃上清液,每管加入500μl PI染色液,37℃避光孵育1h,流式细胞仪检测细胞周期分布。(8)裸鼠成瘤实验:CDK2-AP1过表达的SK-BR-3细胞和CDK2-AP1干扰后MCF-7细胞培养至对数生长期,胰酶消化、PBS重悬,100μl细胞悬液(1×107/mouse)皮下注射于雌性裸鼠(BALB/c-nu/nu)[n=54,(20±2)g,4~5周龄]。每3d测量肿瘤大小,记录长径和垂直短径,以公式V (mm3)=1/2ab2计算体积。5周后处死裸鼠,取瘤称重。肿瘤组织切片免疫组化检测CDK2/ CyclinD1并计算bcl-2/bax比值。
1.3统计学分析 CDK2-AP1表达差异通过卡方检验分析、肿瘤体积和重量差异运用重复测量数据的线性回归分析检验,P<0.05为差异有统计学意义。
2 结果
2.1CDK2-AP1蛋白表达在正常乳腺组织高于乳腺癌组织 免疫组化染色结果显示CDK2-AP1阳性表达率在正常乳腺组织(72.5%)、导管原位癌(16.7%)、侵袭性乳腺癌(14.0%)、复发转移性乳腺癌(5.6%)依次降低(P<0.001);CDK2及CyclinD1在正常乳腺组织(7.5%、12.5%)、乳腺导管原位癌(40.0%、50.0%)、侵袭性乳腺癌(51.2%、55.4%)、复发转移性乳腺癌(55.6%、50.0%)的表达依次升高(P<0.001)。不同组织中CDK2-AP1的表达差异提示正常乳腺到癌变以至发生侵袭、转移的过程中CDK2-AP1表达降低、功能受抑制并与CDK2/CyclinD1反相关。
2.2CDK2-AP1mRNA可在MCF-7细胞成功沉默、在SK-BR-3细胞成功过表达 MCF-7细胞内源性CDK2-AP1的mRNA和蛋白表达水平均较高,SKBR-3细胞则均较低;MDA-MB-231则是mRNA水平较高而蛋白偏低。故以慢病毒介导的CDK2-AP1 siRNA静默MCF-7细胞的CDK2-AP1表达(见图1),转染过表达CDK2-AP1mRNA于SK-BR-3细胞(见图2)。
2.3CDK2-AP1抑制乳腺癌细胞生长、阻滞细胞于G0/ G1和G2/M期 MTT和克隆形成实验均显示CDK2-AP1mRNA静默的MCF-7细胞生长加速而过表达CDK2-AP1mRNA的SK-BR-3细胞生长受抑制;过表达CDK2-AP1的SK-BR-3细胞G0/G1及G2/M期比例增多、S期比例降低(P<0.05),siCDK2-AP1转染的MCF-7 G0/G1及G2/M期比例降低、S期比例升高(见图3)。
2.4CDK2-AP1静默促进MCF-7细胞在裸鼠成瘤和生长 siCDK2-AP1转染MCF-7细胞及对照细胞分别皮下注射于裸鼠,生长5周,发现CDK2-AP1干扰后促进MCF-7细胞在裸鼠成瘤且生长迅速,肿瘤体积及质量均大于对照组(见图4A、B)。免疫组化显示CDK2-AP1抑制后bcl 2/bax比值升高,CDK2/ cyclinD1表达升高(见图4C)。

图1 CDK2-AP1 mRNA及蛋白在三种乳腺癌细胞系的表达情况

图2 通过慢病毒载体转染使CDK2-AP1在MCF-7细胞静默、在SK-BR-3细胞过表达。 A CDK2-AP1 siRNA慢病毒转染MCF-7及CDK2-AP1过表达慢病毒转染SK-BR-3细胞。B MCF-7转染CDK2-AP1 RNAi后mRNA降低80.1%。C CDK2-AP1mRNA过表达于SK-BR-3,内源性CDK2-AP1mRNA上升3.3倍。D MCF-7转染后CDK2-AP1蛋白水平降低77.7%。E SK-BR-3转染后CDK2-AP1蛋白水平上调。

图3 CDK2-AP1抑制乳腺癌细胞生长,阻滞乳腺癌细胞于G0/G1及G2/M期,并提高乳腺癌细胞对多烯紫杉醇的化疗敏感性。A 干扰后MCF-7细胞克隆形成数是对照组两倍,过表达后SK-BR-3克隆数减少。 B 干扰CDK2-AP1后MCF-7细胞增殖加速至对照组1.31倍。C CDK2-AP1过表达抑制SK-BR-3细胞增殖。D 过表达CDK2-AP1阻滞SK-BR-3细胞于G0/G1、G2/M 期,下调CDK2-AP1促进MCF-7细胞进入S期。
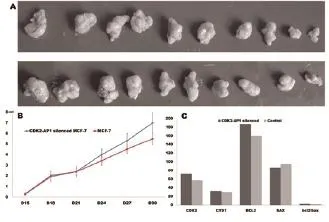
图4 CDK2-AP1降低/缺失促进MCF-7细胞裸鼠成瘤、增殖,抑制凋亡。
3 讨论
已知CDK2在细胞周期调控中起着关键作用,正常细胞的新陈代谢有赖于CDK2上、下游的调控,包括CDK2-AP1对CDK2的灭活及增殖细胞的凋亡。失去CDK2-AP1的调节,CDK2过表达会导致细胞周期下游信号通路激活、细胞持续增殖,形成细胞恶变的基础;而在肿瘤细胞则可能导致其生物学行为的改变比如增殖、侵袭力增强。作者通过临床标本检测发现在乳腺癌存在CDK2-AP1表达降低/缺失而CDK2/ CyclinD1表达升高的情况,CDK2-AP1在正常乳腺组织细胞表达远高于乳腺癌组织。此结果提示CDK2-AP1与乳腺癌的发生发展存在密切的联系:CDK2-AP1表达降低以至缺失导致乳腺细胞进入恶性增殖形成肿瘤,缺乏细胞周期调控的乳腺癌细胞增殖及侵袭能力增强。
通过CDK2-AP1细胞功能实验,证实抑制CDK2-AP1表达后乳腺癌细胞周期后移、增殖加快;过表达CDK2-AP1的乳腺癌细胞的细胞周期阻滞在G0/G1和G2/M期,增殖受抑制。同时CDK2/CyclinD1的表达与CDK2-AP1具有明显的负相关性,提示以CDK2-AP1/CDK2/CyclinD1为核心的细胞周期信号通路在乳腺癌细胞具有重要作用,影响乳腺癌细胞的发生和进展。动物实验进一步证实这一推测,接种CDK2-AP1干扰的乳腺癌细胞在裸鼠易于成瘤且生长迅速,显著高于对照组;在裸鼠肿瘤组织通过免疫组化检测发现CDK2/CyclinD1的表达升高,bcl-2/ bax比值升高。结果表明CDK2-AP1/CDK2/CyclinD1对动物体内乳腺癌细胞的生长调控具有重要作用,CDK2-AP1降低/缺失会导致细胞周期路径重要调控因子CDK2/CyclinD1的持续活化,且可能因失去对bcl-2的抑制而导致bcl2/ bax比值升高、细胞凋亡减少。以上证据提示在动物体内CDK2-AP1表达降低或缺失会促进肿瘤发生及进展,而且为细胞周期路径的调控作用提供了依据。
本资料提示CDK2-AP1可以抑制乳腺上皮细胞恶性分化及增殖,其表达降低/缺失促进乳腺癌的发生及进展。CDK2-AP1具有成为乳腺癌治疗手段的潜在可能性。
1 Todd R, McBride J, Tsuji T, et al.Wong DT Deleted in oral cancer-1(doc-1), a novel oral tumor suppressor gene, 1995, 9(13):1362~1370.
2 Tsuji T, Duh FM, Latif F,et al. Cloning, mapping, expression, function,and mutation analyses of the human ortholog of the hamster putative tumor suppressor gene Doc-1. J Biol Chem ,1998,273(12):6704~6709
3 Hu MG, Hu GF, Kim Y, et al. Role of p12(CDK2-AP1) in transforming growth factorbeta1 mediated growth suppression,2004, 64(2):490~499
4 Peng H, Shintani S, Kim Y, Wong DT. Loss of p12CDK2-AP1 expression in human oral squamous cell carcinoma with disrupted transforming growth factor-beta -Smad signaling pathway. Neoplasia,2006,8(12):1028~1036.
5 Kim Y, McBride J, Zhang R, et al . p12(CDK2-AP1) mediates DNA damage responses induced by cisplatin. Oncogene,2005,24(3):407~418.
6 Choi MG, Sohn TS, Park SB,et al. Decreased expression of p12 is associated with more advanced tumor invasion in human gastric cancer tissues. Eur Surg Res, 2009,42(4):223~229.
7 Hiyoshi Y, Watanabe M, Hirashima K,et al. p12CDK2-AP1 is associated with tumor progression and a poor prognosis in esophageal squamous cell carcinoma. Oncol Rep, 2009 ,22(1):35~39.
8 Zolochevska O, Figueiredo ML. Cell cycle regulator cdk2ap1 inhibits prostate cancer cell growth and modifies androgen-responsive pathway function. Prostate, 2009 ,69(14):1586~1597.
Objective To observe the role of CDK2-AP1 in breast cancer. Methods Expressions of CDK2-AP1,CDK2 and CyclinD1 were examined in 209 cases of pathological specimens using IHC staining. Lost-of-function and Gain-of-function assays were performed in vivo and in vitro to assess the specifi c role of CDK2-AP1 in breast cancer. Results The positive ratio of CDK2-AP1 expression was reduced successively in normal breast tissue,DCIS,invasive breast cancer and relapsed breast cancer,suggesting that CDK2-AP1 was correlated closely with the tumor's genesis and progress and might work as a tumor suppressor. After down-regulating CDK2-AP1 in breast cancer cells,the cell cycle was accelerated and the cell proliferation was promoted. The cell cycle was arrested in G0/G1 phase and G2/M phase after up-regulating CDK2-AP1 in breast cancer cells,resulting in inhibited cell proliferation. The same results were obtained by animal assays. Conclusions CDK2-AP1 affects tumor genesis and tumor growth by cell cycle regulation,which has the potential to be a therapeutic agent in breast cancer.
CDK2-AP1 Breast cancer Cell cycle
浙江省卫生厅青年人才基金(2010QNA005);浙江省自然科学基金(Y2110519)
浙江省肿瘤医院乳腺外科(何向明 俞洋 杨红健)上海交通大学附属上海第六人民医院乳腺外科(黄润宗祥云)浙江大学附属第一人民医院病理科(向华)
——一道江苏高考题的奥秘解读和拓展

