锌-铁合金电镀液的稳定性研究
陈小平*,李拔,王向东,李勇,黄涛
(钢铁研究总院,北京 100081)
锌-铁合金电镀液的稳定性研究
陈小平*,李拔,王向东,李勇,黄涛
(钢铁研究总院,北京100081)
通过赫尔槽试验和镀液氧化加速试验,筛选了适用于弱酸性氯化物体系Zn-Fe合金镀液的稳定剂,得到最优稳定剂组成为:抗坏血酸1 g/L,酒石酸1 g/L,葡萄糖酸钠12 g/L,酒石酸钾钠4 g/L。采用该复合稳定剂的Zn-Fe合金镀液稳定性极好,在40 °C下连续磁力搅拌168 h后仍保持澄清。通过测定循环伏安曲线分析了稳定剂各成分的主要作用机理。结果表明,抗坏血酸是主要还原剂,酒石酸也以还原作用为主,葡萄糖酸钠是主要配位剂,酒石酸钾钠兼有较弱的还原和配位作用。
锌-铁合金;电镀;稳定性;配位剂;还原剂
First-author's address: Central Iron and Steel Research Institute, Beijing 100081, China
Zn-Fe合金电镀层有着优异的耐腐蚀性能,其耐腐蚀性能是Zn镀层的3 ~ 5倍[1-2]。同时,Zn-Fe合金电镀成本低廉,与电镀Zn基本一致甚至更低。然而,Zn-Fe合金电镀并非像电镀Zn一样得到广泛应用,最主要原因是Zn-Fe合金镀液稳定性差,Fe2+易被空气中氧气氧化成Fe3+,从而使镀液变浑浊,性能变差直至不能使用。因此,Zn-Fe合金镀液稳定剂的研究有着更为实际的意义,甚至超过电镀Zn-Fe合金光亮剂的研究。
Zn-Fe合金镀液长期使用时,Fe2+氧化成Fe3+是镀液不稳定的主要因素,溶液中客观存在的氧会把Fe2+氧化成Fe3+。特别是在酸性镀液体系电镀过程中阴极区H+的大量消耗使溶液pH下降,OH-浓度增大也会促使生成的Fe3+与OH-生成不溶性Fe(OH)3,从而造成镀液浑浊和镀层粗糙、起皮等问题。镀液中Fe2+的非正常消耗主要有以下2种:
(1) 在大气环境中,被空气氧化成Fe3+:
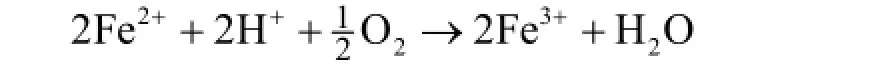
(2) 在电镀过程中发生阳极二次反应生成Fe3+:

为了使 Fe2+稳定存在于镀液中,需要在镀液中加入稳定剂。稳定剂通常由还原剂和配位剂组成。还原剂可将Fe3+还原成Fe2+,增强镀液稳定性。配位剂的作用为:一方面,配位剂既可与Fe2+形成配合物,防止其氧化,也可以和氧化生成的Fe3+形成可溶性配合物,防止其产生沉淀;另一方面,配位剂可以拉近锌和铁的析出电位,使二者共沉积,有利于电镀过程的进行。
1 实验
1. 1工艺流程
打磨─除油─水洗─酸洗─水洗─超声波清洗─活化─电镀─钝化─干燥─后处理。
1. 2基础镀液(BE)组成和工艺条件
ZnCl260 g/L光亮剂 20 mL/L
FeSO4·7H2O 10 g/L温度 30 °C
KCl 210 g/LpH 4.5 ~ 5.5
H3BO328 g/L电流密度 1.5 A/dm2
1. 3方槽试验
以50 mm × 25mm × 2.5 mm的钢铁片为阴极,锌板为阳极,分别采用新配镀液和放置1个月的镀液进行方槽试验,以研究镀液稳定性。
1. 4赫尔槽试验
以锌板为阳极,100 mm × 60 mm × 1 mm的紫铜板为阴极,分别往基础镀液中添加初选的配位剂和还原剂,进行赫尔槽试验,观察不同电流密度处的镀层表面质量。工艺条件为:电流1 A,pH 5,时间10 min,室温。
1. 5镀液氧化加速试验
取500 mL镀液,采用恒温(40 °C)匀速(150 r/min)搅拌镀液的方式来加速破坏镀液的稳定性,通过观察镀液的变化情况来评价镀液稳定性。
1. 6循环伏安曲线测试
往基础镀液中加入不同含量稳定剂,进行循环伏安测试。参比电极为饱和甘汞电极(SCE),辅助电极为 Pt电极,工作电极为10 mm × 10 mm × 1 mm的紫铜片。测试基本参数为:初始电位为开路电位,最低电位为-1.70 V,最高电位为-0.40 V,扫描速率为10 mV/s。
1. 7合金镀层中铁含量测定
采用龙尼柯上海有限公司的UV-200分光光度计测定,具体步骤为:将合金镀层溶于体积分数为1%的稀盐酸溶液中,记录溶解前后的质量差,用蒸馏水定容至50 mL后,取15 mL,滴入5 mL磺基水杨酸。用体积分数为10%的氨水滴定至溶液变黄,立即停止,再加入1 mL氨水。最后将所得溶液定容至50 mL,取适量放入分光光度计中测吸光度,通过铁标定液的Fe2+吸光度曲线计算合金镀层中的铁含量(质量分数)。
2 结果与讨论
2. 1稳定剂的筛选[2-5]
抗坏血酸是酸性Zn-Fe合金电镀体系最有效的还原剂之一,因此直接将其用作本体系的还原剂。同时将电镀Ni-Fe合金的还原剂葡萄糖和电镀光亮铁的还原剂氨基磺酸一并列入进行筛选。
2. 1. 1配合物稳定常数
首先,通过配合物稳定常数表,查找能与铁离子形成稳定配合物(即稳定常数大)的配体,同时根据各自的理化性质进行初步筛选,具体列于表1。由表1可初步得到适合的配位剂为α-氨基丙酸、半胱氨酸、氨基乙酸、氨三乙酸、EDTA-2Na(乙二胺四乙酸二钠)和柠檬酸(盐)。所用镀液属于弱酸性氯化物体系,Fe2+属于交界酸,Fe3+属于硬酸。根据软硬酸碱原理:硬酸与硬碱、软酸与软碱形成的配合物更加稳定,而交界酸与软碱、硬碱和交界碱均可形成稳定配合物。初选的配位剂中,以氧作为配位原子的柠檬酸(盐)为硬性配体,具有氧、氮配位原子的α-氨基丙酸、半胱氨酸、氨基乙酸、氨三乙酸、EDTA-2Na属于交界配体。另外,酒石酸(盐)与葡萄糖酸盐也是 Fe3+较常用的硬性配体。因此这些配体均适用于 Fe2+,柠檬酸(盐)、酒石酸(盐)和葡萄糖酸盐则适用于Fe3+,其中酒石酸还可作还原剂。

表1 配合物稳定常数表Table 1 Stability constants of complexes
2. 1. 2赫尔槽试验
选择稳定剂的重要原则之一是不能影响镀层表面质量。因此分别向基础镀液中添加2 g/L和4 g/L初选的配位剂和还原剂进行赫尔槽试验,观察不同电流密度处镀层的表面质量。结果表明,分别添加α-氨基丙酸、半胱氨酸、氨基乙酸、氨三乙酸和氨基磺酸时,所得试片光亮区窄,高电流密度区产生大量析氢条纹,应予以排除。分别加入 EDTA-2Na、柠檬酸钠、酒石酸、酒石酸钾钠、葡萄糖、葡萄糖酸钠和抗坏血酸时,均可得到全光亮的赫尔槽试片。
2. 1. 3氧化加速试验
首先向基础液中加入不同质量浓度的单一物质进行氧化加速试验,以确定各自的最佳含量,得出上述所选物质的最佳含量为:葡萄糖8 g/L,葡萄糖酸钠12 g/L,酒石酸1 g/L,酒石酸钾钠8 g/L,柠檬酸钠14 g/L,EDTA-2Na 4 g/L,抗坏血酸1 g/L。对比各自的氧化加速试验结果可知,加入葡萄糖、酒石酸钾钠、柠檬酸钠、EDTA-2Na、酒石酸和抗坏血酸的镀液分别在12、12、24、48、72和84 h后变浑浊。加入12 g/L葡萄糖酸钠的镀液在初始时由淡黄色逐渐变为褐色,84 h后依然未出现沉淀。加入酒石酸虽然可有效提高镀液稳定性,但也会使镀液pH大幅降低,通过加入一定量的酒石酸钾钠则可使pH回升到规定范围,并且酒石酸和酒石酸钾钠可形成缓冲溶液,使镀液保持澄清。
综上所述,确定电镀锌铁合金稳定剂为葡萄糖酸钠、抗坏血酸、酒石酸钾钠和酒石酸。物质的还原性强弱可根据溶液颜色深浅来判断,配位作用强弱则可根据溶液的浑浊情况来判断。观察镀液状态可知:葡萄糖酸钠为配位剂,配位作用最强;抗坏血酸为还原剂,还原性最强;酒石酸和酒石酸钾钠既是还原剂又是配位剂,酒石酸的还原性略小于抗坏血酸,酒石酸钾钠的还原性和配位作用都很小。
2. 1. 4复配试验
通过镀液氧化加速试验,对所选4种稳定剂进行大量交叉复配试验,得到电镀Zn-Fe合金稳定剂的最佳含量为:抗坏血酸1 g/L,酒石酸1 g/L,葡萄糖酸钠12 g/L,酒石酸钾钠4 g/L。采用该组合稳定剂的镀液在氧化加速试验168 h后仍保持澄清,无沉淀生成。
图1所示为基础镀液和添加最佳组合稳定剂镀液中所得赫尔槽试片的外观。从图1可知,镀液中加入组合稳定剂对镀层外观无影响,反而对高区“烧焦”现象有一定抑制作用。
分别采用新配镀液和室温放置1个月后的镀液进行方槽电镀试验,结果如图2所示。从图2可知,与新镀液产品外观相比,旧镀液产品的光亮度略有下降,但通过添加光亮剂可以恢复到和新镀液产品一样的光亮度。

图1 不同镀液的赫尔槽试片外观Figure 1 Appearance of Hull cell samples prepared from different baths

图2 采用不同镀液电镀所得Zn-Fe合金镀层的外观Figure 2 Appearance of Zn-Fe alloy coatings prepared from different plating baths
2. 2不同物质对镀液稳定性的影响作用分析
2. 2. 1抗坏血酸
在基础镀液中添加不同含量的抗坏血酸,进行不同时间氧化加速试验后,再电镀制备Zn-Fe合金镀层,镀层铁含量随氧化加速试验时间的变化如图3所示。从图3可知,抗坏血酸的加入量较少时,镀层铁含量降低得较快,随抗坏血酸加入量增大,降低幅度减小;继续增大抗坏血酸含量,镀层铁含量变化不大。确定抗坏血酸的加入量为1 g/L。

图3 镀层铁含量随BE + 抗坏血酸镀液氧化加速试验时间的变化Figure 3 Variation of iron content in coating with oxidation acceleration test time in the bath containing ascorbic acid
图4为基础镀液中加入不同含量抗坏血酸后的循环伏安曲线。从图4可以看出,当基础镀液中加入0.5 g/L抗坏血酸时,-1.10 V处的阴极沉积电位无变化,阴极在-1.70 V处的最大电流略微降低,但-1.10 ~ -1.70 V之间的沉积速率变化不大,说明抗坏血酸的加入并未使阴极进一步发生极化现象。随抗坏血酸加入量的增大,阳极峰电流逐渐增大,说明抗坏血酸浓度的增大可促进阳极溶解。阳极过程包括Zn、Fe分别生成Zn2+、Fe2+的主反应,还始终伴随析氧和析氯副反应。其中析氧反应生成的氧气会使ZnFe阳极发生氧化,导致ZnFe溶解成Zn2+、Fe2+的难度加大,阳极电流降低。随抗坏血酸含量增大,阳极峰电流而升高,说明抗坏血酸的主要作用机理为还原性,可抑制ZnFe阳极的氧化。
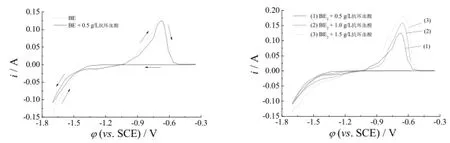
图4 镀液中抗坏血酸含量不同时的循环伏安曲线Figure 4 Cyclic voltammograms for baths with different ascorbic acid contents
2. 2. 2 酒石酸
对酒石酸含量不同的镀液进行不同时间的氧化加速试验后再电镀制备Zn-Fe合金镀层,镀层铁含量随氧化加速试验时间的变化见图5。从图5可知,与抗坏血酸类似,当酒石酸的加入量较少时,镀层铁含量随氧化加速试验时间延长而降低得较快;随酒石酸加入量增多,降低的速率减慢;继续增大酒石酸含量,镀层铁含量的降低速率变化不大。而加入量过多会使镀液pH迅速下降,因此,选择酒石酸含量为1 g/L。
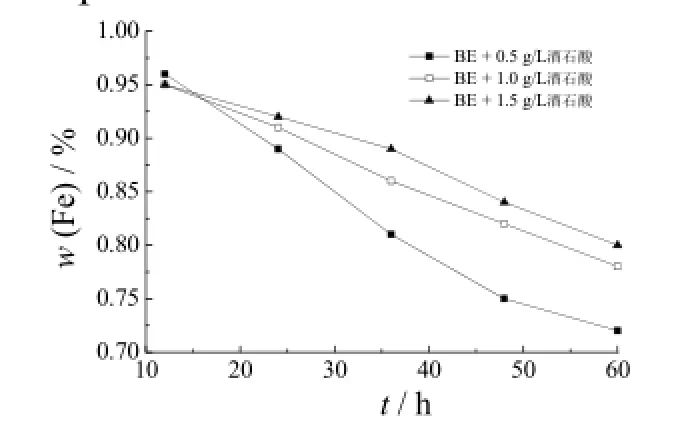
图5 镀层铁含量随BE + 酒石酸镀液氧化加速试验时间的变化Figure 5 Variation of iron content in coating with oxidation acceleration test time in the bath containing tartaric acid
图6为镀液中酒石酸含量不同时的循环伏安曲线。从图6可知,与基础镀液相比,酒石酸加入量为0.5 g/L时,-1.10 ~ -1.70 V之间的沉积速率稍微降低,-1.70 V处的最大阴极电流略微降低;随酒石酸含量增大,沉积速率和最大阴极电流又逐渐增大,说明酒石酸对阴极过程的影响不大。虽然酒石酸也是一种配位剂,但其在电镀 Zn-Fe合金溶液中的配位作用要小于镀锌光亮剂中载体的配位作用(镀锌光亮剂中载体光亮剂具有很强的配位作用,能够遮蔽酒石酸的配位作用)。另外,从阳极峰电流随酒石酸含量增大而增大可知,镀液中酒石酸的加入可促进阳极溶解,说明酒石酸的主要作用机理为还原性。

图6 镀液中酒石酸含量不同时的循环伏安曲线Figure 6 Cyclic voltammograms for baths with different tartaric acid contents
2. 2. 3酒石酸钾钠
在基础液中加入酒石酸钾钠后,镀层铁含量随镀液氧化加速试验时间的变化如图7所示。从图7可知,酒石酸钾钠含量为2 g/L和4 g/L时,镀层铁含量的降低速率相近。镀液中加入6 g/L酒石酸钾钠后,氧化加速试验24 h后镀液变得浑浊,因此酒石酸钾钠的含量不宜过大,适宜的含量为4 g/L。赫尔槽试验过程中还发现,镀液中光亮剂不足时,酒石酸钾钠具有扩大光亮电流密度区的作用。
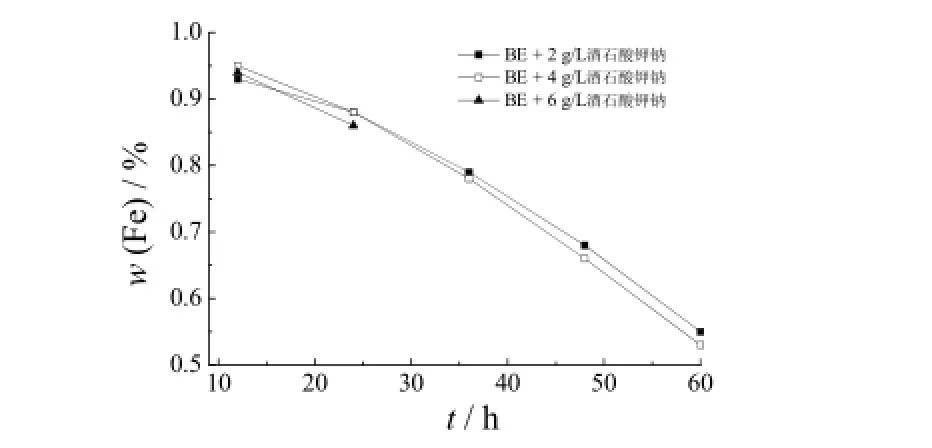
图7 镀层铁含量随BE + 酒石酸钾钠镀液氧化加速试验时间的变化Figure 7 Variation of iron content in coating with oxidation acceleration test time in the bath containing potassium sodium tartrate
图8是镀液中酒石酸钾钠含量不同时的循环伏安曲线。从图8可以看出,随酒石酸钾钠的不断加入,阴极沉积电位、阴极最大电流和阴极沉积速率变化不大,说明酒石酸钾钠的含量变化对阴极过程没有影响。但随酒石酸钾钠加入量的增大,曲线阳极峰电流逐渐增大,加入少量酒石酸钾钠就能促进阳极溶解,说明酒石酸钾钠除了是一种很好的Fe2+、Fe3+配位剂外,还有一定的还原性。
2. 2. 4葡萄糖酸钠
在基础液中加入不同含量的葡萄糖酸钠,镀层铁含量随氧化加速试验时间的变化如图9所示。
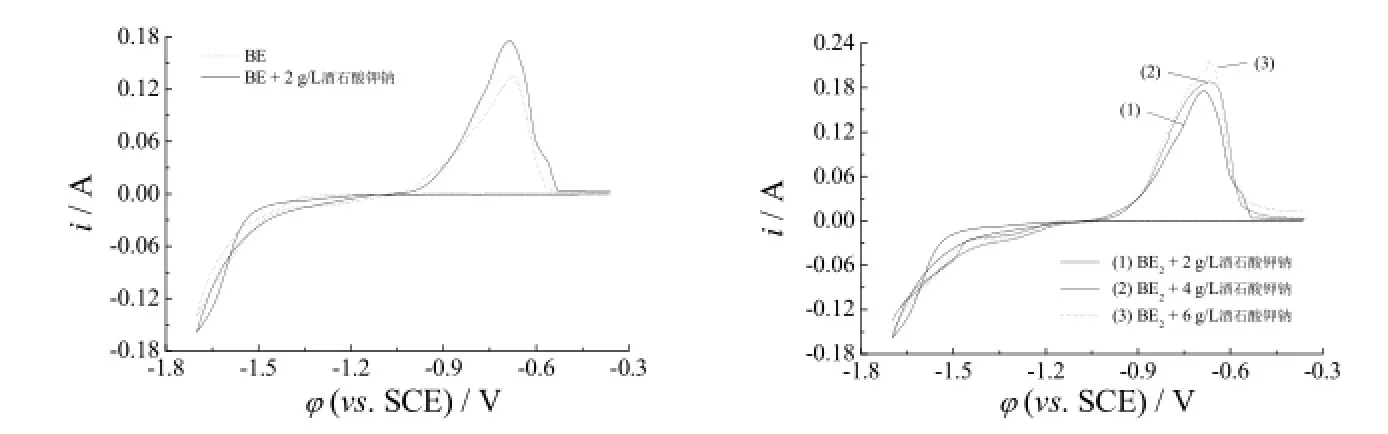
图8 镀液中酒石酸钾钠含量不同时的循环伏安曲线Figure 8 Cyclic voltammograms for baths with different potassium sodium tartrate contents

图9 镀层铁含量随BE + 葡萄糖酸钠镀液氧化加速试验时间的变化Figure 9 Variation of iron content in coating with oxidation acceleration test time in the bath containing sodium gluconate
当葡萄糖酸钠加入量较小时,镀层铁含量降低略快;随葡萄糖酸钠加入量增大,降低的速率减慢;继续增大葡萄糖酸钠含量,镀层铁含量的降低速率变化不大。
图10是镀液中葡萄酸钠含量不同时的循环伏安曲线。从图10可以看出,随葡萄糖酸钠逐渐加入,-1.10 ~-1.70 V之间的阴极沉积速率降低,-1.70 V处的最大阴极电流减小。这是因为葡萄糖酸钠具有强配位作用,其与Zn2+和 Fe2+配位,导致溶液中水合锌、铁离子浓度减少,阴极沉积速率降低。镀液加入葡萄糖酸钠后,从电位-1.70 V处回扫时,阴极沉积速率几乎不变,正扫和回扫曲线重合,说明葡萄糖酸钠与Zn2+、Fe2+的配离子使溶液具有很好的缓冲作用。随葡萄糖酸钠加入量的增大,曲线在-0.7 V处的阳极峰电流略微减小,镀液中加入少量葡萄糖酸钠就能抑制阳极溶解,因为葡萄糖酸钠在阳极表面覆盖,影响了阳极溶解。特别是在葡萄糖酸钠加入量为16 g/L时,葡萄糖酸钠在阳极表面大量覆盖,阳极溶解速率减小。

图10 镀液中葡萄糖酸钠含量不同时的循环伏安曲线Figure 10 Cyclic voltammograms for baths with different sodium gluconate contents
3 结论
电镀Zn-Fe合金的稳定剂由还原剂和配位剂组成,各物质的最佳含量为:抗坏血酸1 g/L,酒石酸1 g/L,葡萄糖酸钠12 g/L,酒石酸钾钠4 g/L。其中抗坏血酸只具有还原作用但效果显著,是主要还原剂;酒石酸兼有还原和配位的作用,但在本体系中以还原作用为主;葡萄糖酸钠对 Fe2+和 Fe3+的配位作用强,可保证镀液长时间不出现沉淀,是主要配位剂;酒石酸钾钠同样兼有还原和配位的作用,但两种作用都较弱。
[1] 彭楠. NdFeB永磁体表面电镀Zn-Fe合金工艺的研究[D]. 昆明: 昆明理工大学, 2013: 40-52.
[2] 崔萍, 左正忠. 低铁锌铁合金工艺研究与进展[J]. 科技资讯, 2008 (11): 1, 3.
[3] ZHANG Z, LENG W H, SHAO H B, et al. Study on the behavior of Zn-Fe alloy electroplating [J]. Journal of Electroanalytical Chemistry, 2001, 516 (1/2): 127-130.
[4] 耿秋菊, 冯立明, 夏祥华. 低温氯化物电镀铁溶液的稳定剂研究[J]. 电镀与涂饰, 2007, 26 (8): 14-16.
[5] 邢乐红. 硫酸型镍铁合金镀液中亚铁离子的补加与稳定性研究[D]. 哈尔滨: 哈尔滨工业大学, 2008: 33-36.
[ 编辑:周新莉 ]
Study on stability of zinc-iron alloy electroplating bath
// CHEN Xiao-ping*, LI Ba, WANG Xiang-dong, LI Yong,HUANG Tao
Some stabilizers suitable for weakly acidic chloride Zn-Fe alloy electroplating bath were selected through Hull cell test and oxidation acceleration test of plating bath. The optimal composition of stabilizer were obtained as follows:ascorbic acid 1 g/L, tartaric acid 1 g/L, sodium gluconate 12 g/L, and potassium sodium tartrate 4 g/L. The Zn-Fe alloy electroplating bath with the given composite stabilizer remains clear after continuous magnetically stirring at 40 °C for 168 h,showing excellent stability. The main functional mechanism of each component in the composite stabilizer was analyzed by cyclic voltammetry. The results showed that ascorbic acid functions as main reductant, tartaric acid also as reductant in the main,and sodium gluconate as main complexant. Potassium sodium tartrate has weak functions of both reduction and complexation. Keywords: zinc-iron alloy; electroplating; stability; complexant; reductant
TQ153.2
A
1004 - 227X (2015) 07 - 0365 - 06
2014-10-17
2015-02-02
稀土材料表面技术开发与应用(2012BAE02B01)。
陈小平(1974-),男,江苏南通人,博士,高级工程师,主要从事腐蚀与防护方面的工作。
作者联系方式:(E-mail) xiaoping118@sina.com。

