人Pokemon蛋白锌指结构域的表达与纯化
刘莉李岳亭张萌萌杨予涛徐志卿
(1.首都医科大学基础医学院,北京 100069;2.嘉兴出入境检验检疫局,嘉兴 314001)
人Pokemon蛋白锌指结构域的表达与纯化
刘莉1李岳亭1张萌萌2杨予涛1徐志卿1
(1.首都医科大学基础医学院,北京 100069;2.嘉兴出入境检验检疫局,嘉兴 314001)
旨在原核表达Pokemon基因的锌指结构域,纯化获得GST-Zinc finger的融合蛋白。以人胶质瘤T98G细胞的cDNA为模板,利用PCR扩增带有BamH I和Sal I 酶切位点的人Pokemon基因的锌指结构域,然后将其克隆到pGEX-4T-1原核表达载体中。将正确的重组载体转入大肠杆菌BL21(DE3),用IPTG诱导表达,再利用MagneGST particles亲和纯化Zinc finger融合蛋白,最后通过Western blot鉴定此融合蛋白。结果显示,成功构建pGEX-4T-1-Zinc finger原核表达载体;30℃条件下,0.2 mmol/L的IPTG能诱导出大量的可溶性GST-Zinc finger蛋白;经MagneGST particles纯化的GST-Zinc finger蛋白可被识别Pokemon锌指结构域的抗体特异识别。纯化的GST-Zinc finger蛋白可用于后续的生物学研究。
Pokemon;锌指结构域;原核表达;蛋白纯化
Pokemon,即POK红系髓性致癌因子(POK erythroid myeloid Ontogenic factor),也被称为LRF、FBI-1、OCZF,最初被认为是一种HIV-1的启动子结合蛋白,随后被作为PLZF的同源物而被克隆[1]。Pokemon是POK家族成员之一,其编码的产物具有BTB/POZ域和锌指结构,BTB/POZ域位于氨基末端,而锌指结构位于其羧基末端。人Pokemon基因编码区全长1 752 bp,编码584个氨基酸,分子量约为64 kD。由于Pokemon蛋白中存在一些sumo化翻译后修饰位点[2],免疫印迹试验中其分子量大小约为72 kD。
近年来的研究表明Pokemon在肿瘤的发生过程中起到十分重要的作用。Pokemon不仅在淋巴瘤中高表达,而且在乳腺癌、前列腺癌、结肠癌、小细胞性肺癌和胶质瘤等肿瘤中也高水平表达[3-7]。Pokemon可以通过抑制Sp1蛋白与Sp1位点的结合和募集转录负阻遏物,如N-CoR和SMRT,从而降低抑癌基因Rb的表达[8]。此外,Pokemon也可以通过抑制Sp1蛋白和p53蛋白的转录激活和募集转录负阻遏物而降低细胞周期蛋白激酶抑制因子p21CIP1的表达[9]。近年来的研究表明Pokemon也可以通过与AR的相互作用而调节雄激素信号通路[10]。
锌指结构域是锌指蛋白的重要构成部分,主要参与DNA的识别与结合,从而调控下游靶基因的表达。越来越多的研究表明,锌指结构域除了参与DNA特异识别外,还介导了一些蛋白与蛋白的相互作用[11],如锌指蛋白BCL6通过其锌指结构域与Smad4的相互作用从而招募HDAC5调控TGF-β信号通路[12]。因此,纯化与表达Pokemon的锌指结构域,不仅有助于阐述Pokemon的作用机理,而且也有助于丰富Pokemon蛋白的相互作用网络。本研究通过原核表达Pokemon基因的锌指结构域,纯化获得GST-Zinc finger融合蛋白,旨在为后续生物学研究奠定基础。
1 材料与方法
1.1 材料
pGEX-4T-1质粒、大肠杆菌DH5α、大肠杆菌BL21(DE3)均为本实验室保存;高保真、热启动Taq聚合酶购于NEB公司;质粒提取试剂盒、胶回收试剂盒、PCR纯化试剂盒购于MN公司;反转录试剂盒购于Invitrogen 公司;各种限制性内切酶购于NEB公司;针对Pokemon锌指结构域的抗体购于Sigma公司;MagneGST particles购于Promega公司;异丙基-β-D-硫代半乳糖(IPTG)、考马斯亮蓝R-250购于北京普利莱公司;预染分子量标准蛋白marker购于Thermo公司;引物合成由北京奥克鼎盛生物科技有限公司进行。
1.2 方法
1.2.1 T98G细胞总RNA的提取 将培养的T98G细胞用PBS洗3遍,加入1 mL的Trizol,充分裂解,将裂解液转移至无RNase的离心管中。加入0.2 mL的氯仿,震荡混匀,室温放置3 min。4℃,12 000×g离心10 min,将上层水相转移至无RNase的离心管中。加入0.5 mL的异丙醇,室温静置20 min。4℃,12 000×g离心10 min,并用75%的乙醇洗涤RNA沉淀,等沉淀干燥后,加入50 μL无RNase的水,使沉淀溶解。利用紫外分光光度计测定总RNA的浓度,用甲醛变性胶检测总RNA的质量。
1.2.2 T98G细胞总RNA的反转录 在一个无RNase的离心管中加入3 μg的总RNA,1 μL的Oligo-dT,并用无RNase的水调节体积到12 μL。70℃水浴变性6 min后,将离心管快速置于冰上。加入4 μL的 5×reaction buffer,1 μL的RNase inhibitor,2 μL 10 mmol/L dNTP和 1 μL的 SuperScript® III Reverse Transcriptase,42℃水浴60 min。加入1 μL RNase H,37℃温浴10 min。将RT产物稀释到100 μL,-20℃保存。
1.2.3 质粒的构建 构建pGEX-4T-1-Zinc fing载体的上游引物为:5'-TACTCGGATCCCGAGCCAAGGCCTTCCAGAAG-3',下游引物为:5'-ATCACGTCGACCAGTCTATTAGGCGAGTCCGGCTGTGAA-3'(下划线分别为BamH I和Sal I酶切位点)。以T98G细胞的cDNA为模板,利用以上引物,进行PCR扩增。将扩增到的PCR产物和pGEX-4T-1载体分别用Sal I内切酶和BamH I内切酶进行双酶切,并将酶切后的PCR片段与剩余载体片段用T4 DNA连接酶连接,转化大肠杆菌DH5α,菌落PCR验证阳性克隆,并酶切鉴定,然后将阳性克隆送往北京奥克鼎盛科技有限公司进行测序。
1.2.4 GST-Zinc finger融合蛋白的诱导表达 将构建成功的pGEX-4T-1-Zinc finger载体转化大肠杆菌BL21(DE3)原核表达菌中,37℃培养至OD600=0.6时,分别加入1 mol/L的IPTG,至终浓度分别为0.2、0.4、0.6、0.8和1.0 mmol/L。30℃诱导4 h,同时设未经IPTG诱导的菌液做对照。取1 mL诱导后的菌液,6 000 r/min离心3 min,收集菌体,然后加入40 μL的1×SDS上样缓冲液,沸水煮5 min,然后6 000 r/min离心2 min,取上清用于SDS-PAGE凝胶电泳和考马斯亮蓝染色,检测GST-Zinc finger融合蛋白的表达情况。
1.2.5 GST-Zinc finger融合蛋白的纯化 收集1 mL诱导后的细菌,加入1 mL的裂解液,混匀,在室温摇动40 min。同时,在另一个离心管中加入20 μL的MagneGST particles,利用磁架,将上清吸去,再加入250 μL的Binding/Washing buffer,悬浮磁粉,利用磁架,吸去上清,平衡磁粉。将平衡好的MagneGST particles加 入100 μL的Binding/Washing buffer,再加入100 μL的细菌裂解液,室温摇动60 min。利用磁架,吸去上清,加入250 μL的Binding/ Washing buffer洗涤3次,吸取上清。用30 μL的0.1 mol/L谷胱甘肽洗脱融合蛋白,并在洗脱液中加入8 μL的5×SDS上样缓冲液,沸水煮6 min,6 000 r/min离心2 min,利用SDS-PAGE凝胶电泳检测融合蛋白的纯化效果。
1.2.6 GST-Zinc finger融合蛋白的鉴定 将纯化后GST-Zinc finger融合蛋白和T98G细胞总蛋白经SDSPAGE凝胶电泳后,电转至PVDF膜上。用5%的BSA封闭1 h,按1∶2 000的比例加入Pokemon的多克隆抗体,孵育2 h后,洗去一抗,再加入辣根过氧化物酶标记的羊抗兔IgG二抗,孵育40 min后,洗去二抗,再利用ECL显色发光试剂盒并结合胶片显影观察试验结果。
2 结果
2.1 Pokemon基因Zinc finger区段的PCR扩增
使用Invitrogen公司的Trizol试剂,提取T98G细胞的总RNA,电泳检测RNA完整性良好,可用于反转录试验。以T98G细胞的cDNA为模板,使用已合成的Zinc finger区段的上、下游引物,利用NEB公司的高保真、热启动的Taq聚合酶,PCR扩增Pokemon的Zinc finger结构域(第376-584位氨基酸)。扩增条件为:94℃预变性3 min;94℃ 30 s,53℃ 30 s,72℃ 1 min 45 s,31个循环。扩增产物用1%的琼脂糖凝胶电泳检测,观察到600 bp左右的扩增产物,与Pokemon基因Zinc finger结构域区段的大小一致(图1)。
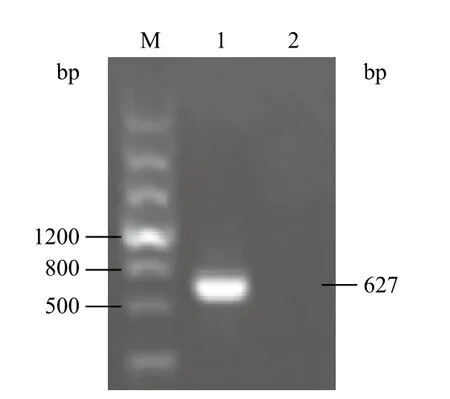
图1 Pokemon基因Zinc finger区段的PCR扩增结果
2.2 pGEX-4T-1-Zinc finger原核表达载体的构建
将扩增的Pokemon基因的Zinc finger片段和pGEX-4T-1载体分别用Sal I内切酶和BamH I内切酶进行双酶切,电泳并回收酶切后的Zinc finger片段和pGEX-4T-1载体的大片段,通过T4 DNA连接酶将Zinc finger片段正向插入pGEX-4T-1载体中。将菌落PCR鉴定为阳性的1个重组子进行酶切鉴定,这个重组子经酶切鉴定后得到两条目的带(图2),约为600 bp和4 900 bp,初步证明重组载体构建正确,并将此重组子进行测序。经过与GenBank的序列对比后,证明Zinc finger片段已经成功插入pGEX-4T-1载体,pGEX-4T-1-Zinc finger载体构建成功。

图2 重组质粒pGEX-4T-1-Zinc finger酶切的鉴定
2.3 GST-Zinc finger融合蛋白的诱导表达及可溶性分析
将重组载体pGEX-4T-1-Zinc finger转化大肠杆菌BL21(DE3)。37℃下,培养至OD600=0.6后,分别用终浓度为0.2、04、0.6、0.8和1.0 mmol/L的IPTG在30℃下诱导4 h,同时以未诱导的表达菌为对照。分别收集菌体,进行SDS-PAGE凝胶电泳,再用考马斯亮蓝染色。结果(图3)显示,5个GST-Zinc finger诱导组在43 kD处均出现明显条带,与预期结果相符,而未诱导的GST-Zinc finger表达菌在相应位置几乎无目的蛋白条带出现,说明融合基因在大肠杆菌中得到有效的表达。但是,随着IPTG浓度的增高,融合蛋白的表达量并未增强。同时,分别将上述不同浓度的IPTG诱导下的表达菌进行裂解,并收集上清和沉淀,再利用SDS-PAGE凝胶电泳检测其可溶性。结果(图4)显示,GSTZinc finger的融合蛋白主要在上清中表达,其中0.2 mmol/L IPTG诱导的可溶性融合蛋白相对较多。
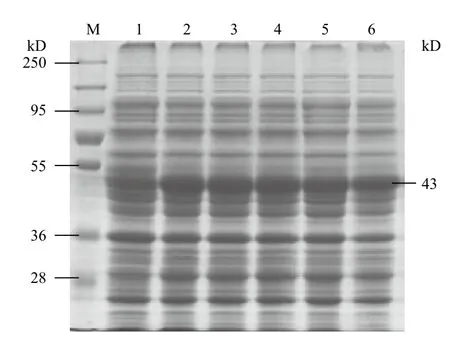
图3 不同浓度IPTG诱导下GST-Smad4 融合蛋白的表达分析

图4 不同浓度 IPTG诱导下GST-Zinc finger 融合蛋白在上清和沉淀中的对比
2.4 GST-Zinc finger融合蛋白的纯化
将0.2 mmol/L IPTG诱导的GST-Zinc finger表达菌在-80℃放置1 h,将其融化,加入1 mL裂解液,超声破碎后,收集上清,加入MagneGST particles,通过结合、洗涤等步骤后,用0.1 mol/L的谷胱甘肽洗脱GST-Zinc finge融合蛋白,并将纯化的GST-Zinc finger融合蛋白进行SDS-PAGE电泳,然后考马斯亮蓝染色。结果(图5)显示,GST-Zinc finger融合蛋白得到较好的纯化,纯度较高。
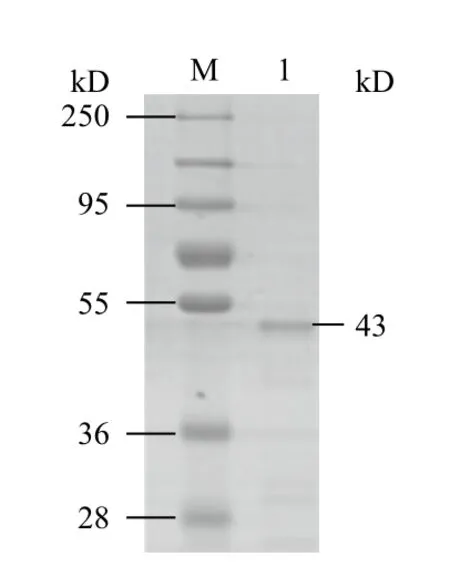
图5 GST-Zinc finger 融合蛋白的纯化
2.5 GST-Zinc finger融合蛋白的鉴定
为了验证纯化的GST-Zinc finger融合蛋白具有Pokemon蛋白锌指结构域的免疫学特性,分别将T98G细胞总蛋白和纯化的GST-Zinc finger融合蛋白进行SDS-PAGE凝胶电泳,再将其转移到PVDF膜上,通过Western blot,检测融合蛋白能否被Pokemon抗体特异识别。由于GST-Zinc finger蛋白比Zinc finger蛋白多了一个GST标签(约20 kD),其分子量预计在43 kD左右。如图6所示,GST-Zinc finger融合蛋白的条带出现在预期位置,说明识别锌指结构域的Pokemon特异性抗体可以识别GST-Zinc finger融合蛋白,暗示GST-Zinc finger融合蛋白可用于后续的研究。

图6 GST- Zinc finger 融合蛋白的鉴定
3 讨论
Pokemon是POK家族的重要成员,作为一种转录抑制因子,参与多种生物学过程。目前,已经在人类基因中发现了40多种POK蛋白。现已证明POK蛋白在胚胎的发生、分化和肿瘤形成中起到十分重要的作用[7,13,14]。Pokemon基因位于第19号染色体短臂1区3带中的第3亚带(19p13.3),具有2个外显子和2个内含子,mRNA全长4 456 bp,其编码的产物具有BTB/POZ结构域和锌指结构域,其锌指结构属于Krüppel型的锌指结构。
Pokemon的BTB/POZ结构域是一段高度保守的蛋白与蛋白的相互作用域,介导同源或异源二聚体的形成,主要招募转录的负阻遏物和组蛋白去乙酰化酶。其C-末端的锌指结构介导特异的DNA的识别和结合,并通过增加HDAC的招募和调控染色质重构而发挥转录抑制作用[7]。
最早的研究发现Pokemon在前脂肪的分化中有着重要的作用。如果在鼠脂肪细胞系3T3-L1中持续表达Pokemon,可以导致脂肪形成加速,并降低有丝分裂相关蛋白,如:cyclinA等蛋白的表达[15]。2005年,Maeda等[7]发现过量表达Pokemon可以引起细胞的转化,同时也可以特异性的抑制抑癌基因ARF的表达,进而抑制ARF-p53通路,从而影响肿瘤的发生和发展。因此,Pokemon在细胞的分化和肿瘤的发生和发展中起到重要的作用。
Pokemon除了在淋巴瘤中高水平表达外,在一些实体瘤中,如:乳腺癌、肺癌、结肠癌、前列腺癌等表达水平也很高[3-7]。研究发现敲低Pokemon的表达通过抑制PI3K/Akt信号通路而抑制肝癌细胞HepG2和Huh-7的增生[16]。我们近期的研究发现,过量表达Pokemon可以增加前列腺癌LNCaP细胞的增生[10]。因此,Pokemon对肿瘤细胞的增殖有着重要的调节作用。
前期的研究表明Pokemon主要作为一种转录因子而调节下游基因的表达。如:Pokemon通过与Sp1蛋白的相互作用而干扰Sp1蛋白与Sp1位点的结合而降低ADH5/FDH基因的表达[17],通过竞争Sp1蛋白与Sp1位点的结合和募集转录负阻遏物而降低抑癌基因Rb的表达[8],通过抑制Sp1蛋白和p53蛋白的转录激活和募集转录负阻遏物而降低p21CIP1的表达[9]。但是,我们最近的研究发现Pokemon可以通过与AR的相互作用和招募转录负阻遏物SMRT和NCOR而调控AR信号通路[10]。因此,Pokemon可以通过两种方式来调节下游基因的表达。
锌指蛋白作为一种重要的转录因子,在基因的表达调控中发挥了重要的作用。锌指蛋白主要通过其C-末端的锌指结构域负责识别特异的DNA序列,进而调控下游基因的表达。但是,越来越多的研究表明锌指结构域也可介导蛋白与蛋白的相互作用[11]。鉴于Pokemon在细胞分化和肿瘤中的重要作用,表达和纯化其C-末端的锌指结构域,有助于进一步阐明Pokemon的作用机理。
IPTG的浓度对外源蛋白的表达影响很大,但过高浓度的IPTG会对细胞产生毒性,同时也影响蛋白的表达量和表达形式。本研究摸索了不同浓度的IPTG对GST-Zinc finger融合蛋白表达的影响。研究发现,随着IPTG浓度的增加,GST-Zinc finger融合蛋白表达变化不大。因此,本试验选择0.2 mmol/L为IPTG诱导的浓度。同时,分别检测了在不同浓度IPTG诱导下,GST-Zinc finger融合蛋白在BL2(DE3)表达菌裂解液的上清和沉淀的分布,发现低浓度的IPTG诱导下,GST-Zinc finger融合蛋白可溶性表达的丰度较高。
4 结论
本研究成功构建了pGEX-4T-1-Zinc finger原核表达载体,摸索了GST-Zinc finger融合蛋白诱导表达的适宜条件,并获得了具有Pokemon免疫活性的GST-Zinc finger融合蛋白。
[1] Davies JM, Hawe N, Kabarowski J, et al. Novel BTB/POZ domain zinc-finger protein, LRF, is a potential target of the LAZ-3/BCL-6 oncogene [J]. Oncogene, 1999, 18(2):365-375.
[2] Roh HE, Lee MN, Jeon BN, et al. Regulation of pokemon 1 activity by sumoylation [J]. Cell Physiol Biochem, 2007, 20(1-4):167-80.
[3] Aggarwal A, Hunter WJ 3rd, Aggarwal H, et al. Expression of leukemia/lymphoma-related factor(LRF/POKEMON) in humanbreast carcinoma and other cancers [J]. Exp Mol Pathol, 2010, 89(2):140-148.
[4] Aggarwal H, Aggarwal A, Hunter WJ 3rd, et al. Expression of leukemia/lymphoma related factor(LRF/Pokemon) in human benign prostate hyperplasia and prostate cancer [J]. Exp Mol Pathol, 2011, 90(2):226-230.
[5] Zhao ZH, Wang SF, Yu L, et al. Overexpression of Pokemon in nonsmall cell lung cancer and foreshowing tumor biological behavior as well as clinical results [J]. Lung Cancer, 2008, 62(1):113-119.
[6] Hahn SA, Schutte M, Hoque AT, et al. Pokemon expression in malignant glioma:an application of bioinformatics methods [J]. Neurosurg Focus, 2005, 19(4):E8.
[7] Maeda T, Hobbs RM, Merghoub T, et al. Role of the proto-oncogene Pokemon in cellular transformation and ARF repression [J]. Nature, 2005, 433(7023):278-285.
[8] Jeon BN, Yoo JY, Choi WI, et al. Proto-oncogene FBI-1(Pokemon/ ZBTB7A) represses transcription of the tumor suppressor Rb gene via binding competition with Sp1 and recruitment of co-repressors[J]. J Biol Chem, 283(48):33199-33210.
[9] Choi WI, Jeon BN, Yun CO, et al. Proto-oncogene FBI-1 represses transcription of p21CIP1 by inhibition of transcription activation by p53 and Sp1 [J]. J Biol Chem, 2009, 284(19):12633-12644.
[10] Cui JJ, Yang YT, Zhang CF, et al. FBI-1 functions as a novel AR co-repressor in prostate cancer cells [J]. Cell Mol Life Sci, 2011,68(6):1091-1103.
[11] Leon O, Roth M. Zinc fingers:DNA binding and protein-protein interactions [J]. Biol Res, 2000, 33(1):21-30.
[12] Wang D, Long J, Dai F, et al. BCL6 represses Smad signaling in transforming growth factor-beta resistance [J]. Cancer Res, 2008,68(3):783-789.
[13] Barna M, Hawe N, Niswander L, Pandolfi PP. Plzf regulates limb and axial skeletal patterning [J]. Nat Genet, 2000, 25(2):166-172.
[14] Costoya JA, Hobbs RM, Barna M, et al. Essential role of Plzf in maintenance of spermatogonial stem cells [J]. Nat Genet, 2004,36(6):653-659.
[15] Laudes M, Christodoulides C, Sewter C, et al. Role of the POZ zinc finger transcription factor FBI-1 in human and murine adipogenesis[J]. J Biol Chem, 2004, 279(12):1171-1178.
[16] Lin CC, Zhou JP, Liu YP, et al. The silencing of Pokemon attenuates the proliferation of hepatocellular carcinoma cells in vitro and in vivo by inhibiting the PI3K/Akt pathway [J]. PLoS One, 2012, 7(12):e51916.
[17] Lee DK, Suh D, Edenberg HJ, Hur MW. POZ domain transcription factor, FBI-1, represses transcription of ADH5/FDH by interacting with the zinc finger and interfering with DNA binding activity of Sp1 [J]. J Biol Chem, 2002, 277(30):26761-26768.
(责任编辑 马鑫)
Prokaryotic Expression and Purification of Zinc Finger Domain of Human Pokemon Protein
Liu Li1Li Yueting1Zhang Mengmeng2Yang Yutao1Xu Zhiqing1
(1. School of Basic Medical Sciences,Capital Medical University,Beijing 100069;2. Jiaxing Entry-Exit Inspection and Quarantine,Jiaxing 314001)
It was to express human Zinc finger domain of Pokemon gene in prokaryotic cells and purify the GST-Zinc finger fusion protein. The segment of zinc finger domain of Pokemon gene was amplified by PCR and cloned into prokaryotic expression vector pGEX-4T-1. The recombinant plasmid pGEX-4T-1-Zinc finger was transformed into E.coli BL21(DE3)and exogenous protein was induced by IPTG. After purification using MagneGST particles, the GST-Zinc finger fusion protein was further identified by Western blot. Results showed that the recombinant plasmid pGEX-4T-1-Zinc finger was constructed successfully. When BL21(DE3) cells transformed with pGEX-4T-1-Zinc finger were cultured at 30℃ and induced with 0.2 mmol/L IPTG, GST-Zinc finger protein was obtained in a large quantity in supernatant. The purified GST-Zinc finger was further identified specifically by Pokemon antibody. Therefore, it proved that GST-Zinc finger fusion protein was successfully expressed and purified, and could be used for further study of the function of Pokemon.
Pokemon;Zinc finger;prokaryotic expression;protein purification
10.13560/j.cnki.biotech.bull.1985.2015.02.033
2014-08-08
国家“973”计划(2010CB912003),国家自然科学基金项目(31271154,31171032),高等学校博士学科点专项科研基金项目(20111107120011),北京市教委科技发展计划(KM201310025001)
刘莉,女,硕士研究生,研究方向:神经生物学;E-mail:emil_lily@163.com
杨予涛,博士,副教授,研究方向:神经生物学;E-mail:yutaoy@ccmu.edu.cn徐志卿,博士,教授,研究方向:神经生物学;E-mail:zhiqingx@ccmu.edu.cn

