甘肃西门塔尔牛甘州类群MSTN基因外显子多态性分析
李积友梁春花刘霞孙雪婧杜晓华1,
(1.甘肃省草食动物生物技术重点实验室,兰州 730070;2.甘肃农业大学动物医学院,兰州 730070;3.甘肃农业大学生命科学技术学院,兰州 730070;4.甘肃省畜牧业产业管理局,兰州 730030)
甘肃西门塔尔牛甘州类群MSTN基因外显子多态性分析
李积友1,4梁春花2刘霞1,3孙雪婧2杜晓华1,2
(1.甘肃省草食动物生物技术重点实验室,兰州 730070;2.甘肃农业大学动物医学院,兰州 730070;3.甘肃农业大学生命科学技术学院,兰州 730070;4.甘肃省畜牧业产业管理局,兰州 730030)
采用PCR-SSCP方法检测50头甘肃西门塔尔牛甘州类群MSTN基因3个外显子的遗传多态性,并对群体内各等位基因进行测序,旨为探讨西门塔尔牛MSTN基因与肉质性状关联等方面的研究提供理论依据。结果显示,甘肃西门塔尔牛甘州类群MSTN基因3个外显子中,外显子2受B、C等位基因控制,形成BB、CC和BC 3种基因型,基因型频率分别为0.22(11/50)、0.64(32/50)、0.14(7/50);外显子1和外显子3分别受A等位基因与D等位基因控制,形成AA和DD基因型,基因型频率均为1(50/50)。序列分析表明,甘肃西门塔尔牛甘州类群MSTN基因3个外显子中,外显子2在第41 bp处发生了C→T的突变,但并没有导致氨基酸发生改变,属于同义突变;外显子1和3均无突变。统计结果表明,甘肃西门塔尔牛甘州类群MSTN基因3个外显子中,外显子2为中度多态,其余均无变化。
MSTN基因;外显子;遗传多态性;西门塔尔牛
肌肉生长抑制素(Myostatin,MSTN)属于转化生长因子超家族的一员,对动物肌肉的分化和生长具有重要的负调控功能[1]。研究发现,该基因不同位点的单一变异均可能导致其活性的降低或丧失,从而表现出“双肌”性状[2],在肉用家畜的品种选育方面有重要作用。截至目前,已有学者对猪、绵羊、普通牛和牦牛等家畜MSTN基因多态性进行了相关的研究报道[3-8]。本研究采用PCR-SSCP方法对甘肃甘州地区西门塔尔牛MSTN基因3个外显子进行多态性分析,探讨西门塔尔牛甘州类群MSTN基因的分子遗传特征,旨为丰富西门塔尔牛MSTN基因的遗传数据以及甘肃西门塔尔牛品种选育提供理论参考。
1 材料与方法
1.1 材料
本试验随机选取甘肃省张掖市甘州区的50头西门塔尔牛,每头牛颈静脉采血10 mL,ACD(酸性柠檬酸葡萄糖)抗凝,用常规苯酚-氯仿法从血样中提取甘州西门塔尔基因组DNA,-20℃冻存。
蛋白酶K、Tris平衡酚购自大连宝生物工程有限公司;丙烯酰胺、硼酸、乙二胺四乙酸(EDTA)购自Amersco公司;过硫酸铵购自烟台市双双化工有限公司;去离子甲酰胺、TEMED购自Sigma公司;甲叉购自上海生工生物工程股份有限公司;2×Power Taq PCR Master Mix购自北京百泰克生物技术公司;DNA marker购自上海捷瑞生物工程有限公司;其他常规试剂均为进口或国产分析纯级产品。
梯度PCR仪:美国ABI公司生产;PROTEANⅡ xi Cell双垂直电泳槽、PowerPac Universal电泳仪:美国Bio-Rad公司生产;F32加热/制冷循环仪:德国Julabo公司生产。
1.2 方法
1.2.1 引物设计与PCR扩增 参考GenBank中的牛(AC_000159)MSTN基因序列,用Primer 3.0软件设计3个外显子引物,其引物序列及预扩增片段的长度详见表1,引物由北京六合华大基因科技股份有限公司合成。

表1 西门塔尔牛甘州类群MSTN基因3个外显子的引物序列及预扩增片段长度
PCR反应体系为20 μL:其中ddH2O 7.4 μL,引物F和R各0.4 μL,预混酶11 μL,模板DNA0.8 μL,反应条件:94℃预变性4 min;94℃变性30 s,退火30 s,外显子1、2、3的退火温度分别是57℃、56℃、58℃,72℃延伸30 s,共35个循环,最后72℃延伸10 min,4℃保存。PCR产物用1%的琼脂糖凝胶电泳检测。
1.2.2 SSCP检测 取2 μL的PCR产物加入8 μL的变性上样缓冲液(980 mL/L去离子甲酰胺,0.25 g/L溴酚蓝,0.25 g/L二甲苯青,pH8.0、0.01 mol/L EDTA),105℃变性10 min,立即冰浴10 min。外显子1、2、3均用交联度39∶1、浓度14%的非变性聚丙烯酰胺凝胶,150 V电泳24 h,温度分别4℃、10℃、10℃,银染法显色后拍照。
1.2.3 序列分析 PCR产物送北京六合华大基因科技股份有限公司进行测序。利用DNAStar软件包中的EditSeq和MegAlign程序进行DNA序列的剪切校对、比对和翻译,碱基组成一致的序列判定为同种等位基因。
1.2.4 数据统计分析 基因型频率、基因频率统计和χ2检验,基因杂合度(Heterozygosity,He)及有效等位基因数(Effective number of alleles,Ne)检测利用POPGENE(版本1.32)软件完成,多态信息含量(Polymorphism information content,PIC)利用PIC_Calc(版本0.6)软件进行分析。
2 结果
2.1 PCR扩增
甘肃西门塔尔牛甘州类群MSTN基因3个外显子用琼脂糖凝胶电泳检测(图1),扩增产物与预期扩增片段的长度相符,且条带清晰明亮无杂带,可直接用于SSCP分析。
2.2 SSCP检测
SSCP分析结果显示,所检测的50头西门塔尔牛甘州类群中外显子1仅发现了AA一种基因型,外显子3只发现了CC一种基因型,二者均无多态性(图2、图4);外显子2共发现了BB、CC、BC 3种基因型,受B和C等位基因控制(图3)。
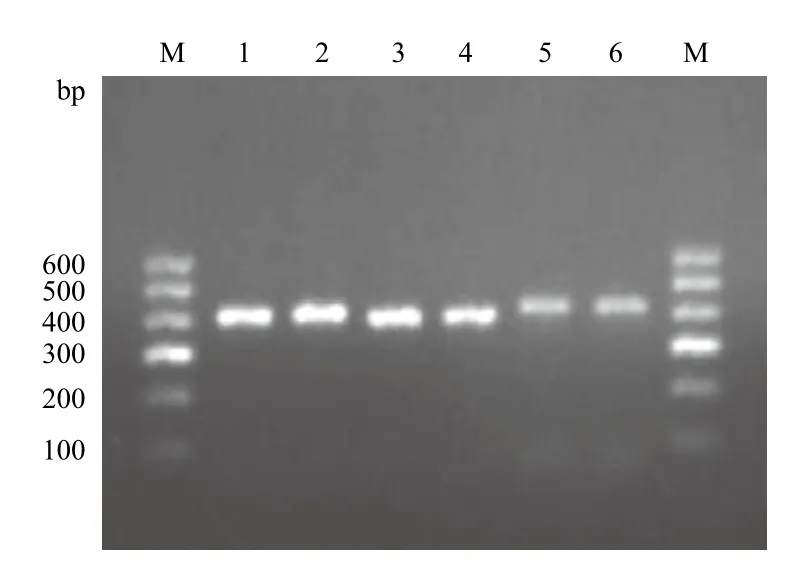
图1 西门塔尔牛甘州类群MSTN基因3个外显子的PCR扩增

图2 西门塔尔牛甘州类群MSTN基因外显子1的PCRSSCP检测
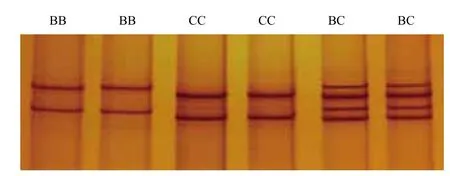
图3 西门塔尔牛甘州类群MSTN基因外显子2的PCRSSCP检测

图4 西门塔尔牛甘州类群MSTN基因外显子3 PCR-SSCP检测
2.3 序列分析
对具有多态性的PCR产物进行克隆测序,得到甘肃西门塔尔牛甘州类群MSTN基因3个外显子的核苷酸序列。将测序结果与GenBank中普通牛(AC_000159)的序列进行比较分析,外显子1只发现了AA一种基因型,且AA型与普通牛的相应序列一致;外显子3只发现了DD一种基因型,且DD型与普通牛的相应序列一致,外显子1和3均无多态性;外显子2发现了BB、CC、BC三种基因型,受B和C等位基因控制,且BB等位基因与普通牛的相应序列一致。外显子2的C等位基因与B等位基因相比,在41 bp处发生C→T突变(图5),但未引起氨基酸序列的变化,为同义突变。
2.4 遗传多态性分析
对50头甘肃西门塔尔牛甘州类群MSTN基因3个外显子等位基因的基因型频率和基因频率进行了统计,结果显示,外显子1仅存在AA一种基因型,外显子3只存在CC一种基因型,外显子1和3的基因型频率均为1(50/50);外显子2具有BB、CC、BC三种基因型,其基因型频率分别为0.22(11/50)、0.64(32/50)、0.14(7/50),其中CC基因型为优势基因型。B、C两个等位基因的基因频率频率分别为0.29、0.71,C等位基因是甘肃西门塔尔牛甘州类群的优势等位基因。χ2检测结果显示,MSTN基因3个外显子的3种基因型在甘肃西门塔尔牛甘州类群中处于Hardy-Weinberg平衡状态(P>0.05)。甘肃西门塔尔牛甘州类群MSTN基因外显子2突变位点的杂合度(He)、有效等位基因数(Ne)及多态信息含量(PIC)的值分别为0.1400、1.7001和0.32706,表现为中度多态。
3 讨论
MSTN基因对骨骼肌的生长具有负调节作用,该基因虽然在进化过程中很保守,但也存在一定的多态性。目前研究结果证实,MSTN基因突变可以导致牛具有双肌性状,表型特征是臀部、大腿、上臂、胸及起支撑作用的中前端肌肉群异常发达,皮下脂肪少,而有更多的脂肪沉积于肌纤维之间,皮肤薄[9]。迄今为止,已经在14种牛中发现了双肌现象。在肉牛中,MSTN基因的3个外显子上已发现9个影响氨基酸序列的变异,其中6个可导致“双肌”。Lee等[10]在皮埃蒙特牛MSTN基因中发现某些单核苷酸替换导致了MSTN蛋白质功能的丧失。Kambadur等[11]和Miranda等[12]在研究比利时蓝牛“双肌”性状时发现,其MSTN基因第3外显子处一个11 bp的缺失是造成比利时蓝牛产生“双肌”性状的原因。Grobet等[13]检测了10个欧洲牛品种的32头双肌牛,结果发现了7个DNA多态性,其中5个推测造成了蛋白质功能的改变,1个为保守氨基酸替换,另一个为沉默DNA突变;在内含子中检出了4个DNA多态型。冀德君等[14]研究了中国普通牛、瘤牛、大额牛和牦牛4个牛属该基因外显子区核苷酸序列的变异,结果显示,4个中国牛种的MSTN基因发现7个核苷酸多态位点。

图5 BB、BC和CC基因型位于41 bp处突变的测序峰图
本研究利用PCR-SSCP方法分析了甘肃西门塔尔牛甘州类群MSTN基因3个外显子的多态性,结果显示,外显子1仅检测出A等位基因,形成一种AA基因型;外显子2在其第41 bp处存在单碱基的突变,有B、C两个等位基因,其中C等位基因为优势等位基因,形成BB、BC和CC三种基因型;外显子3只检测到D等位基因,形成一种DD基因型;在对50头甘肃西门塔尔牛甘州类群群体基因型的检测中,外显子1仅发现1例AA型突变纯合体,外显子3也只检测到1例DD型突变纯合体,外显子1和3均未检测到杂合基因型,这一结果与吕文发等[15]报道的中国西门塔尔群体中外显子1发现了AC、CC两种基因型的结果不一致。原因可能是本实验的研究对象为50头甘州地区的西门塔尔牛类群,其样本数量不够多、样本来源比较集中、地理条件差异、气候温度等有关,也可能是由于引进西门塔尔牛的代数不长或是随着西门塔尔牛与甘州当地的黄牛杂交代数的增加,经过自然淘汰或人工选择其基因型趋于稳定状态,外显子1的AA型和外显子3的DD型被保留了下来,具体原因有待进一步的实验证实。外显子2只发现7个BC基因型,其基因型频率远低于BB和CC型,同时纯合体CC基因型频率也远高于BB和BC型,结果表明C等位基因在长期的人工选育过程中受到正向选择,处于优势地位。在甘肃西门塔尔牛甘州类群MSTN基因外显子2中发现1处突变位点即第41 bp处C→T碱基的颠换,但并没有导致西门塔尔牛甘州类群MSTN基因氨基酸的改变,其是否会对整个MSTN的蛋白功能产生一定的影响,有待进一步的实验研究。
多态信息含量(PIC)和杂合度(He)都是群体内遗传变异的测度,其值的高低反映了群体内个体的均质度,遗传变异大,数值就高。Botstein等[17]提出了确定位点多态性的标准:PIC>0.5为高度多态,PIC<0.25为低度多态,0.25<PIC<0.5则为中度多态。本研究中,甘肃西门塔尔牛甘州类群MSTN基因外显子2基因座的多态信息含量是0.327 0,呈现中度多态,外显子1和3均无多态。通过对甘肃西门塔尔牛甘州类群MSTN基因3个外显子的遗传多态性分析发现,甘肃西门塔尔牛甘州类群处于Hardy-Weinberg平衡状态。这可能是由于甘肃西门塔尔牛甘州类群选择压力不强,因此在人工选择、迁徙和遗传漂变等各种因素的作用下该基因座处于动态平衡中。说明甘肃西门塔尔牛甘州类群群体内遗传比较稳定,这可能与甘肃西门塔尔牛甘州类群的本品种选育有关。
目前,对于MSTN的研究相当广泛。MSTN突变的动物不仅骨骼肌群分布广泛,且肉质性状优良,MSTN基因已成为畜禽肉质性状的最主要标记基因,因此在畜牧业上,可以筛选MSTN基因突变的个体,通过育种培育出产肉率高的优良畜禽品种。
4 结论
甘肃西门塔尔牛甘州类群MSTN基因外显子1由A等位基因控制,外显子3由D等位基因控制,外显子1和3分别形成AA基因型和DD基因型;外显子2由B、C两个等位基因控制,存在BB、CC和BC三种基因型,基因型频率分别为0.22,0.64,0.14。与其他牛相比,甘肃西门塔尔牛甘州类群MSTN基因仅外显子2在41 bp处发生了C→T的突变,外显子1和3均无多态,外显子2基因座的PIC值为0.3270,呈中度多态。
[1] Lee SJ, McPherron AC. Myostatin and the control of skeletal muscle mass:Commentary[J]. Current Opinion in Genet ic & Development, 1999, 9(5):604-607.
[2] McPherron AC. Lee SJ. Double muscling in cattle due to mutations in the myostatin gene[J]. Proc Natl Acad Sci USA, 1997, 94(23):12457-12461.
[3]鲍淑青. 重组肌肉生长抑制素的制备及主动免疫生长猪的研究[D]. 雅安:四川农业大学, 2007.
[4]Liu D, Xu Q, Zang L, et al. Identification and genetic effect of haplotypes in the promoter region of porcine myostatin gene[J]. Animal Cenetics, 2011, 42(1):6-14.
[5]刘晓琴, 马喜山, 唐中林, 等. 猪MSTN基因的多态性和生长性状关联分析[J]. 畜牧兽医学报, 2013, 44(7):1063-1069.
[6]Hu S, Ni W, Sai W, et al. Sleeping Beauty-mediated knockdown of sheep myostatin by RNA interference[J]. Biotechnol Lett, 201l,33(10):1949-1953.
[7] 李帅, 杨舒黎, 苟潇, 等. 肌肉生成抑制素(MSTN)基因研究进展[J]. 中国畜牧兽医, 2011, 38(2):60-63.
[8] 梁春年, 阎萍, 邢成峰, 等. 牦牛MSTN基因内含子2多态性及与生产性状的相关性[J]. 华中农业大学学报, 2011, 30(3):285-289.
[9] 徐良梅, 李仲玉, 单安山. 肌肉生成抑制素(MSTN)基因及其在畜牧业上的应用[J]. 东北农业大学学报. 2008, 39(6):141-144.
[10] Lee SJ, McPherron AC. Regulation of myostatin activity and muscle growth[J]. Proc Natl Acad Sci USA, 2001, 98(16):9306-9311.
[11]Kambadur R, Sharma M, Smith TP, et al. Mutations in myostatin(GDF-8)in double-muscled Belgian Blue and Piedmontese cattle[J]. Genome Res, 1997, 7(9):910-916.
[12] Miranda ME, Amigues Y, Boscher MY, et al. Simultaneous genotyping to detect myostatin gene polymorphism in beef cattle breeds[J]. Animal Breed Genet, 2002, 119(6):361-366.
[13]Grobet L, Poncelet D, Royo LJ, et al. Molecular definition of an allelic series of mutations disrupting the myostatin function and causing double- muscling in cattle[J]. Mammalian Genome,1998, 9(3):210-213.
[14]冀德君, 常洪, 常春芳, 等. 中国牛属4个物种MSTN基因的遗传变异研究[J]. 畜牧兽医学报, 2008, 39(6):701-704.
[15]吕文发, 杨连玉, 贺实伟, 等. 中国西门塔尔牛、利木赞牛和夏洛莱牛MSTN基因多态性分析[J]. 中国兽医学报, 2010,30(6):852-868.
[16]Botstein D, White RL, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980,32(3):314-331.
(责任编辑 李楠)
Polymorphism Analysis of MSTN Gene Exons of Ganzhou Simmental Cattle in Gansu Province
Li Jiyou1,4Liang Chunhua2Liu Xia1,3Sun Xuejing2Du Xiaohua1,2
(1. Gansu Key Laboratory of Herbivorous Animal Biotechnology,Lanzhou 730070;2. College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070;3. College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070;4 Gansu Provincial Bureau of Animal Husbandry Industry Management,Lanzhou 730030)
PCR-SSCP(single-strand conformational polymorphism)was used to detect the genetic polymorphism in 3 exons of myostatin(MSTN)gene in 50 individuals of Ganzhou Simmental cattle in Gansu. The alleles in a population were verified by sequencing, which provided the theoretical evidences for investigating the correlation between MSTN gene of Simmental cattle and meat quality. The results showed that the polymorphism in the exon 2 was controlled by B and C alleles, which formed 3 genotypes of BB, CC and BC with the frequencies at 0. 22(11/50),0. 64(32/50)and 0. 14(7/50)respectively. The polymorphism in the exon 1 and exon 3 was controlled by A and D allele respectively, which formed AA and DD genotypes with frequencies at 1(50/50). Sequence analysis indicated that there was one single nucleotide mutation of C to T at 41stnucleotide in the exon 2 of Ganzhou Simmental cattle;however this did not lead to the amino acid changed, so it was a synonymous mutation. There were no mutations in the exon 1 and exon 3. The statistical results showed that the exon 2 of MSTN gene in 50 individuals of Ganzhou Simmental cattle had a moderate level of polymorphism, and the exon 1 and exon 3 had no polymorphism.
MSTN gene;exon;genetic polymorphism;Simmental cattle
10.13560/j.cnki.biotech.bull.1985.2015.06.026
2014-10-29
甘肃省草食畜牧业发展行动(GNKJ-2009-11)
李积友,男,硕士,研究员,研究方向:动物遗传育种;E-mail:youjili@sina.com
杜晓华,男,博士,副教授,硕士生导师,研究方向:基础兽医学和动物发育生物学;E-mail:duxh@gsau.edu.cn

