嗜酸乳杆菌胞壁肽聚糖对小鼠肠黏膜的免疫调控
吴 振,潘道东,,*,郭宇星,曾小群,孙杨赢
(1.南京师范大学食品科学与营养系,江苏 南京 210097;2. 宁波大学海洋学院,浙江 宁波 315211)
嗜酸乳杆菌胞壁肽聚糖对小鼠肠黏膜的免疫调控
吴振1,潘道东1,2,*,郭宇星1,曾小群2,孙杨赢2
(1.南京师范大学食品科学与营养系,江苏 南京 210097;2. 宁波大学海洋学院,浙江 宁波 315211)
通过建立以致病性大肠杆菌感染小鼠为模型,研究氧化修饰前后嗜酸乳杆菌肽聚糖(peptidoglycan,PG)对小鼠肠道上皮细胞病理形态影响,及对感染大肠杆菌肠黏膜分泌sIgA、血清干扰素-γ(interferon-γ,IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的影响,发现灌胃PG后能够促进小肠黏膜分泌sIgA,降低IFN-γ及TNF-α的表达,且选择性氧化修饰PG比未修饰PG具有优势。可见,嗜酸乳杆菌在肠道免疫方面,可以通过其功能性PG提高对小肠黏膜的免疫调控作用。
嗜酸乳杆菌;肽聚糖;肠黏膜;免疫调控
黏膜作为机体的首要防御屏障,其主要功能是排斥和清除有害外源粒子,保护机体免受外源损伤[1]。随着研究的深入,黏膜免疫保护机制的研究越来越受到国内外学者的广泛关注。在肠道中,诱导黏膜免疫的调控主要发生在肠道相关淋巴组织,特别是淋巴集结(peyer's patches,PP),以及在肠系膜内存在的淋巴结[2]。有关研究表明,益生菌如乳酸杆菌、双歧杆菌能够通过释放细胞因子白细胞介素-10(interleukin-10,IL-10),抑制肠道致病菌对肠道上皮细胞的黏附作用,保护肠道免受致病菌伤害[3-4]。
急性肠炎是盆腹腔肿瘤放疗过程中最常见并发症,以腹痛、腹泻、里急后重、黏液血便为主要表现[5]。临床中急性肠炎发病率高达50%~70%,不仅影响原发病的治疗,而且可以引起肠道吸收不良,导致贫血、消瘦,严重者导致全身炎症反应,多器官功能衰竭,甚至死亡[6-7]。“肠道内分泌功能障碍”是指肠道内分泌功能不足或紊乱所导致的机体肠组织器官功能改变。这种情况下的肠道损伤,需要补充营养和水及电解质来维持机体健康成长[8]。小肠黏膜的组织结构与其功能状态有着密切联系,肠黏膜形态结构发生变化可以通过小肠绒毛高度、黏膜厚度及肠腺深度间接推测出肠道的病变情况[9]。乳酸杆菌等有益菌的代谢产物可以通过肠黏膜处的吞噬细胞进入PP激活Th2细胞,从而产生大量的IL-10,而IL-10能够进一步促进免疫球蛋白IgA因子的分泌。在Ig产生过程中,肠黏膜上皮细胞分泌物可以与IgA结合形成sIgA并排列在肠道黏膜上[10-11]。因此,当sIgA与肠黏膜表面的益生菌共同存在时,就可以抑制致病菌在肠黏膜表面的黏附,进而限制了有害菌的繁殖,对肠道菌群及肠黏膜功能的正常发挥都起到了很好的保护作用[12-13]。
乳酸菌细胞壁中肽聚糖的免疫学研究,目前主要集中在双歧杆菌细胞壁肽聚糖方面,口服或非胃肠道途径使肽聚糖进入宿主体内,可使宿主免疫监视功能得到提高,并且促使免疫器官体内淋巴细胞产生各种细胞因子和抗体,同时提高巨噬细胞和自然杀伤细胞活性,达到提高机体特异与非特异免疫功能,从而发挥自身稳定的细胞调节和抗感染的效果[14-15]。1-氧基-2,2,6,6,-四甲基哌啶(2,2,6,6-tetramethylpiiperidine-1-oxyl,TEMPO)是近年来发现的一种新型稳定的含氧自由基,它在自旋标记法及理论上被广泛应用,目前已成为自由基化学主要发展方向之一[16]。TEMPO与NaClO/NaBr构成一种新型催化氧化体系,此体系具有高度选择性氧化功能,将糖类物质中的伯羟基氧化成相应的羧酸盐,从而赋予了糖类物质一些特殊的性能,如溶解性;而对来源于嗜酸乳杆菌肽聚糖的氧化修饰未见报道。本实验通过建立以致病性大肠杆菌(Escherichia coli 0111:B4)感染小鼠为模型,研究选择性氧化修饰前后嗜酸乳杆菌肽聚糖(peptidoglycan,PG)对小鼠肠道上皮细胞病理形态学及PG对感染大肠杆菌肠黏膜分泌sIgA、血清干扰素-γ(interferon-γ,IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)细胞因子的影响,探讨PG对感染致病性大肠杆菌小鼠肠黏膜的免疫调节作用。
1 材料与方法
1.1动物、试剂与仪器
健康成年雄性ICR小鼠(动物合格许可证编号:批号SCXK(HU)2012-0002),平均体质量(20±2)g,由宁波大学动物中心提供。
sIgA、IFN-γ、TNF-α ELISA试剂盒 南京建成生物工程公司;PG由本实验室从嗜酸乳杆菌中提取,氧化PG由TEMPO/NaClO/NaBr选择性氧化,保存于-20 ℃备用;BCA蛋白检测试剂盒、RIPA强蛋白裂解液 江苏碧云天生物试剂公司。
Thermo MK3全波长扫描多功能酶标仪 热电(上海)仪器有限公司;DW-86L490型超低温保存箱青岛海尔特种电器有限公司;W H-3微型漩涡混合仪 上海沪西分析仪器厂有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;低速冷冻离心机 北京医用离心机厂;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)仪 北京六一仪器厂。
1.2方法
1.2.1分组与造模
ICR小鼠随机分为对照组、感染组(E. coli 0111:B4感染组)、PG治疗组(高剂量0.5 mg/g,中剂量0.25 mg/g,低剂量0.125 mg/g)及氧化PG治疗组(高剂量0.5 mg/g,中剂量0.25 mg/g,低剂量0.125 mg/g);每组7 只,共计8 组。饲养5 d后,对照组每只灌服生理盐水0.2 mL;感染组每只用改良的注射器灌胃0.2 mL E. coli 0111:B4菌液(1×109CFU/mL),次日起每天灌服肽聚糖溶液0.2 mL,连续5 d;治疗组第5天灌服0.2 mL E. coli 0111:B4菌液(1×109CFU/mL),1 h后,灌服肽聚糖溶液0.2 mL,次日起每天灌服肽聚糖溶液0.2 mL,连续5 d。末次灌胃后12 h处死动物,采集组织样本[17]。
1.2.2肠黏膜形态学观察
取ICR小鼠2~3 cm回肠组织,迅速用新配制的生理盐水冲洗肠内容物,并用质量分数为3%的明胶溶液包埋,放入液氮中冰冻切片,染色,显微镜下观察组织学变化(放大倍数为×100),图像分析仪随机全盲测量肠绒毛高度,隐窝深度及黏膜厚度[18]。
1.2.3小肠相关蛋白SDS-PAGE分析
取不同处理组相同部位的小肠组织1 g,迅速用无菌磷酸盐缓冲溶液冲洗肠内容物,之后用无菌手术剪剪碎组织,并用蛋白裂解液进行裂解处理(4 ℃,30 min)。收取裂解液,12 000 r/min离心15 min,回收上清液,经BCA试剂盒测定,统一各组的蛋白质量浓度为5 mg/mL。之后蛋白样品加入缓冲液后水浴5 min。处理好的蛋白样本放入-20 ℃冰箱备用[19]。
1.2.4细胞因子检测
取ICR小鼠回肠末端5 cm,平铺于滤纸上,纵行剪开,无菌磷酸盐缓冲溶液反复冲洗肠腔表面后,刮下黏膜,研磨成质量分数为10%的匀浆,4 000 r/min、4 ℃离心15 min,取0.2 mL上清液至-80 ℃冰箱待检。取上清液及标准品各100 μL置于96 孔板中,37 ℃温育30 min,甩干液体,洗涤液进行反复洗涤5 次后,加入酶标耦合液100 μL,37 ℃条件下温育30 min后,甩干液体,洗涤液进行反复冲洗5 次,每孔加入底物A、B液各50 μL,37 ℃条件下反应15 min,之后加入终止液50 μL,于450 nm波长处用酶标仪测定sIgA、IFN-γ和TNF-α含量。以上实验步骤均严格按照试剂盒说明操作。
1.3统计学分析
2 结果与分析
2.1小肠形态学指标的测定
实验小鼠灌服大肠杆菌后均有不同程度的腹泻。感染组小鼠精神萎靡、饮食活动量减少、嗜睡、对外界反应迟钝,其中有3 只小鼠出现死亡;而PG及氧化PG治疗组均未出现小鼠死亡现象。光镜观察结果如图1所示:感染组小鼠绒毛水肿,部分小鼠绒毛上皮细胞脱落,绒毛高度和隐窝深度降低。PG治疗组(高剂量0.5 mg/g)及氧化PG治疗组(高剂量0.5 mg/g)小肠绒毛均完整,水肿较轻,绒毛高度和隐窝深度较大。

图1 不同处理下的小肠黏膜形态Fig.1 Morphology of intestinal mucosa in mice observed under different treatment conditions
感染组小肠绒毛高度、隐窝深度及黏膜厚度均低于对照组,差异显著(P<0.05)。感染组和治疗组均高于对照组(P<0.05),说明PG能够提高小鼠肠绒毛高度、隐窝深度及黏膜厚度。感染组与治疗组之间没有显著差异(P>0.05),说明感染组与治疗组疗效相当;而修饰前后PG治疗组与感染组没有显著差异(P>0.05),说明选择性氧化修饰前后PG对预防与治疗大肠杆菌感染肠黏膜疗效没有差异,结果如表1所示。由于氧化修饰后PG的提高了PG的溶解性,因此,PG的选择性氧化修饰对于PG的溶解性能改良是一种很好的方式。

表1 各组小肠组织形态学指标的比较Table1 Comparison of intestinal morphology in different groups
2.2氧化修饰PG对小肠相关蛋白表达量的影响
根据对照组、感染组及氧化PG治疗组的SDS-PAGE分析,通过上样同等浓度的蛋白样本(5 μg),结果发现在70 kD和45 kD的分子质量区域,治疗组与感染组的部分蛋白表达存在差异,而且这种差异与氧化PG的剂量存在依赖性。由此可见,氧化PG对于小肠黏膜的免疫调控作用是存在的,而且这种调控作用可能与NF-κB通路蛋白相关[20]。
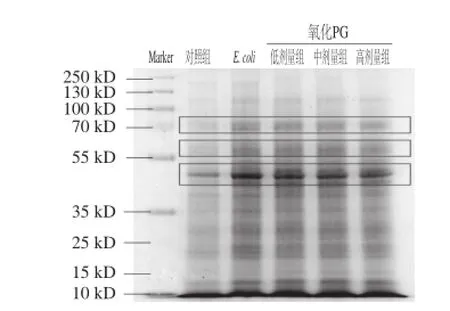
图2 不同条件下小肠蛋白变化的SDS-PAGE分析Fig.2 Changes in total protein abundance in mouse small intestine after different treatments
2.3氧化修饰前后PG对肠黏膜分泌细胞因子的影响
2.3.1不同浓度肽聚糖对小鼠肠黏膜分泌sIgA的影响
sIgA是肠黏膜上皮细胞分泌产生的小体IgA与双体IgA分子结合形成,能降低肠道蛋白酶的分解,从而形成黏膜上的抗体。由于多糖含有其他菌群的共同抗原,因此sIgA能与肠道内有害物质进行免疫反应,阻止这些物质在肠道上皮的黏附和穿透,中和毒素、缓解腹泻、胃炎及过敏反应等症状[21]。由图3可知:低剂量肽聚糖与感染组相比没有明显差异;原PG与氧化后PG都能够促进黏膜分泌sIgA(0.01<P<0.05),且PG灌胃浓度越高,分泌sIgA因子越多;氧化后PG促进分泌sIgA的能力优于原PG,与感染组之间存在极显著差异(P<0.01)。通过灌胃PG及氧化PG,都能很好的降低E. coli 0111:B4引起的肠道炎症反应,而且PG氧化后没有对其功能产生影响,且氧化PG对sIgA分泌的促进作用更加明显。可见PG可以通过促进sIgA的生成来提高肠道的抗炎调节作用。

图3 PG及氧化PG对小鼠肠黏膜组织sIgA的影响Fig.3 Effect of PG and oxidized PG on the release of sIgA in mouse intestinal mucosa
2.3.2不同肽聚糖对小鼠肠黏膜分泌IFN-γ的影响
在生物体内,IFN-γ调控一系列的生化过程,发挥着抗菌、抗癌以及相关免疫调节活性。IFN-γ的这些生物活性发挥依赖于胞内信号途径参与的基因调控[22]。由图4可知:感染组与低剂量组比较,IFN-γ含量无显著变化;中剂量组与高剂量组相对感染组,IFN-γ含量显著下降(P<0.05);感染大肠杆菌后,小肠黏膜层细胞释放IFN-γ细胞因子的含量升高;但随着PG给药浓度的升高,IFN-γ含量逐渐减低,且氧化PG治疗组的效果更加显著。表明氧化修饰对于PG功能的发挥具有很好的促进作用。

图4 PG及氧化PG对小鼠肠黏膜组织IFN--γ的影响Fig.4 Effect of PG and oxidized PG on the release of IFN-γ in mouse intestinal mucosa
2.3.3不同浓度肽聚糖对小鼠肠黏膜分泌TNF-α的影响
大肠杆菌感染诱发肠黏膜巨噬细胞等分泌TNF-α,启动肠道内炎症反应,导致黏膜脱落、坏死,肠道机械屏障功能受损[23]。由图5可知,与感染组比较,低剂量组中TNF-α含量变化不大,无显著的统计学差异。中剂量组与高剂量组相对感染组,TNF-α含量显著下降(P<0.05)。实验小鼠灌胃E. coli 0111:B4后,肠道细胞内TNF-α含量升高,但随着PG的浓度梯度治疗作用,TNF-α含量逐渐降低。TNF-α作为重要的炎症释放因子,对于炎症的产生,具有重要作用,它可以介导响应NF-κB信号途径,激活一系列的炎症因子释放[24]。本实验中的氧化PG,作为炎症因子的抑制剂,对于E. coli 0111:B4介导的小鼠肠黏膜炎症反应具有显著的抑制作用,为研究嗜酸乳杆菌对肠道菌群平衡的免疫调节活性提供了良好的理论依据。

图5 PG及氧化PG对小鼠肠黏膜组织 TNF-α的影响Fig.5 Effect of PG and oxidized PG on the release of TNF-α in mouse intestinal mucosa
3 结 论
在嗜酸乳杆菌胞壁肽聚糖对小鼠肠黏膜的免疫调控中,相比E. coli 0111:B4感染的小肠绒毛水肿,部分小鼠绒毛上皮细胞脱落, 绒毛高度和隐窝深度降低。PG及氧化PG能够保持小肠绒毛均完整,降低大肠杆菌感染引起的水肿,绒毛高度和隐窝深度也较感染组深。在小肠黏膜免疫因子的检测中,结果发现,氧化后PG促进分泌sIgA的能力优于原PG,与对照组之间存在极显著差异(P<0.01)。灌胃PG后能够降低IFN-γ及TNF-α的表达,且选择性氧化修饰后PG在抑制肠炎反应较PG具有优势;氧化PG不仅提高了PG的溶解度,同时高剂量组的氧化修饰PG可以显著降低IFN-γ及TNF-α的释放。
[1] WILSON B A, SALYERS A A, WHITT D D, et al. Bacterial pathogenesis: a molecular approach[M]. 3rd ed. Washington:American Society for Microbiology, 2011: VV055.
[2] BRANDTZAEG P. The mucosal immune system and its integration with the mammary glands[J]. Journal of Pediatrics, 2010, 156(Suppl 2):8-15.
[3] WELLS J. Mucosal vaccination and therapy with genetically modifi ed lactic acid bacteria[J]. Annual Review of Food Science and Technology, 2011, 2: 423-445.
[4] IVANOV I I, LITTMAN D R. Modulation of immune homeostasis by commensal bacteria[J]. Current Opinion in Microbiology, 2011, 14(1):106-114.
[5] 黎轶丽, 王细文. 健康教育保留灌肠法治疗急性放射性肠炎25例效果观察[J]. 齐鲁护理杂志: 外科护理, 2010, 16(4): 115-116.
[6] CASTILLO N A, de LEBLANC A M, GALDEANO C M, et al. Probiotics: an alternative strategy for combating salmonellosis:immune mechanisms involved[J]. Food Research International, 2012,45(2): 831-841.
[7] GARDEN A S. Mucosittis: current management and investigations[J]. Seminars in Radiation Oncology, 2003, 13(3): 267-273.
[8] 李幼生. 肠道内分泌功能障碍:肠功能障碍重要组成[J]. 肠外与肠内营养, 2014, 21(1): 1-3.
[9] KI Y, KIM W, CHO H, et al. The effect of probiotics for preventing radiation-induced morphological changes in intestinal mucosa of rats[J]. Journal of Korean Medical Science, 2014, 29(10): 1372-1378.
[10] MANTIS N J, ROL N, CORTH☒SY B. Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut[J]. Mucosal Immunology, 2011, 4(6): 603-611.
[11] 雷春龙, 董国忠. 肠道菌群对动物肠黏膜免疫的调控作用[J]. 动物营养学报, 2012, 24(3): 416-422.
[12] 王克俭, 曹玉根. 益生菌肠内营养制剂在胃癌术后患者应用的临床研究[J]. 实用医技杂志, 2007, 14(29): 5977-5979.
[13] 王友湘, 陈庆森. 益生菌和肠道粘膜免疫关系的研究进展[J]. 食品科学, 2007, 28(8): 537-542.
[14] 孙进, 常桂芳, 乐国伟, 等. 乳杆菌肽聚糖调节小鼠免疫细胞基因表达的通路分析[J]. 细胞与分子免疫学杂志, 2008, 24(6): 553-556.
[15] 谯仕彦, 侯成立, 曾祥芳. 乳酸菌对猪肠道屏障功能的调节作用及其机制[J]. 动物营养学报, 2014, 26(10): 3052-3063.
[16] 杨贯羽, 郭彦春, 武光辉, 等. 氮氧自由基 TEMPO: 选择氧化醇的高效有机小分子催化剂[J]. 化学进展, 2007, 19(11): 1727-1735.
[17] CRONIN J G, TURNER M L, GOETZE L, et al. Toll-like receptor 4 and MYD88-dependent signaling mechanisms of the innate immune system are essential for the response to lipopolysaccharide by epithelial and stromal cells of the bovine endometrium[J]. Biology of Reproduction, 20 12, 86(2): 51. doi: 10.1095/biolreprod.111.092718.
[18] 潘耀谦, 刘兴友, 陈金山, 等. 急性犬瘟热伴发寄生性肠炎的病理形态学观察[J]. 中国兽医科学, 2012, 41(11): 1182-1186.
[19] 兰海燕, 李立会. 蛋白质凝胶电泳技术在作物品种鉴定中的应用[J].中国农业科学, 2002, 35(8): 916-920.
[20] ABREU M T, FUKATA M, ARDITI M. TLR signaling in the gut in health and disease[J]. Journal of Immunology, 2005, 174(8): 4453-4460.
[21] FAMULARO G, MORETTI S, MARCELLIN I, et al. Stimulation of immunity by probiotics[M]. London: Chapman and Hill, 1997: 133-161.
[22] NGIOW S F, von SCHEIDT B, AKIBA H, et al. Anti-TIM3 antibody promotes T cell IFN-γ-mediated antitumor immunity and suppresses established tumors[J]. Cancer Research, 2011, 71(10): 3540-3551.
[23] 李永渝. 肠道屏障功能障碍的病理生理机制[J]. 胃肠病学, 2006,11(10): 629-630.
[24] 秦琦瑜, 李勇, 陈虎, 等. TNF-α与IL-6在大鼠急性重症胰腺炎并发全身炎性反应综合征中的作用[J]. 河北医药, 2008, 2(3): 140-141.
Immunoregulatory Activity of Lactobacillus acidophilus Peptidoglycan in Mouse Intestinal Mucosa
WU Zhen1, PAN Daodong1,2,*, GUO Yuxing1, ZENG Xiaoqun2, SUN Yangying2
(1. Department of Food Science and Nutrition, Nanjing Normal University, Nanjing 210097, China;2. School of Marine Science, Ningbo University, Ningbo 315211, China)
As an important immune system, mucosal immune system is the first line to protect the mucous membranes against colonization and invasion by potentially dangerous microbes that may be encountered. In this study, the immunoregulatory activity of Lactobacillus acidophilus peptidoglycan (PG) was investigated on pathogenic Escherichia coli(E. coli)-induced mouse model. Compared with PG, the oxidative modification of PG had a significant effect on the secretion of sIgA, reduced the expression of interferon-γ (IFN-γ) and tumor necrosis factor-α (TNF-α) in the intestinal mucosa. PG derived from Lactobacillus acidophilus had the capability of enhancing immune regulation of intestinal mucosa.
Lactobacillus acidophilus; peptidoglycan; intestinal mucosa; immunoregulatory activity
TS201.3
A
1002-6630(2015)13-0207-04
10.7506/spkx1002-6630-201513038
2014-12-26
国家自然科学基金面上项目(41276121;31471598);江苏省自然科学基金面上项目(BK20141447);浙江省自然科学基金青年基金项目(Q16C200005)
吴振(1985—),男,博士研究生,研究方向为乳品科学。E-mail:woodsen@163.com
潘道东(1964—),男,教授,博士,研究方向为乳品科学。E-mail:daodongpan@163.com

