玉米中霉菌的分离纯化及鉴定
徐艳阳,于静,繆彬彬,关欢欢
(吉林大学生物与农业工程学院,吉林长春130022)
玉米中霉菌的分离纯化及鉴定
徐艳阳,于静,繆彬彬,关欢欢
(吉林大学生物与农业工程学院,吉林长春130022)
从储藏玉米中分离纯化得到霉菌的单菌落,并对菌种进行鉴定。对玉米进行5次取样,分离到60个单菌落,其中曲霉属检出率最高,青霉属次之。采用点植法对霉菌在察氏培养基和高盐察氏培养基上的生长情况,包括菌落直径、质地、颜色、渗出物有无等进行记录,同时在光学显微镜下对菌体结构进行观察,参照菌落标准图谱,鉴定出5种霉菌,分别为黑曲霉、烟曲霉、产黄青霉、桔青霉和缓生青霉,为今后玉米储藏中的菌相研究提供参考。
玉米;霉菌;分离;纯化;鉴定
霉菌是引起粮食变质的主要微生物类群,无论粮食储藏的品种、条件、期限等方面有多大的不同,其储藏的安全性都将受到霉菌的威胁。粮食经霉菌及毒素污染后,轻者食用品质下降,重者危害人体健康。全球每年受到霉菌污染的农作物约有25%,有2%的粮食由于霉变丧失使用价值[1],我国粮食霉菌及毒素污染情况也十分严重[2-3]。
玉米是全世界重要的粮食作物和的饲料来源,是我国年产量最大的农作物[4],其产量高达2亿t左右[5]。玉米在收获、储藏和加工过程中都易受到霉菌的污染。相对于其他粮食,玉米的胚部较大、营养成分丰富、原始水分高、成熟度不均匀[6],在储藏过程中更易发生霉变。在玉米储藏过程中的霉菌污染以青霉属、曲霉属、根霉属和镰刀霉属为主,其中青霉属和曲霉属是优势菌属[7],曲霉属[8]、青霉属[9]和镰刀霉[10-11]属均可产生毒素。因此本文对玉米中的霉菌进行分离纯化,找到玉米储藏中常见的霉菌,通过霉菌菌落在察氏培养基和高盐察氏培养基上生长情况以及对其在光学显微镜下的结构观察进行鉴定,为今后玉米储藏中菌相研究以及抑菌方法的研究提供试验菌种。
1材料与方法
1.1材料与仪器
玉米:由本院玉米实验基地提供。察氏培养基(CA)、高盐察氏培养基(CD)、孟加拉红培养基、棉兰石碳酸染液:生物与农业工程学院食品理化分析实验室自制。
硝酸钠,磷酸氢二钾,磷酸二氢钾,硫酸镁,氯化钾,硫酸亚铁,蔗糖,琼脂,葡萄糖,氯化钠,乳酸(比重1.21),吐温-80等均为分析纯试剂;蛋白胨,孟加拉红,氯霉素等均为生物试剂。
JA3003A电子精密天平:上海精天电子仪器有限公司;DSX-280A不锈钢手提式高压蒸汽灭菌锅:上海申安医疗器械厂;DHP060恒温培养箱:上海实验仪器厂有限公司;SW-CJ-1DF洁净工作台:上海博讯实业有限公司医疗设备厂;SHA-C水浴恒温振荡器:金坛市恒丰仪器厂;DMXY数码生物显微镜:宁波舜宁仪器有限公司;BCD-L45冰箱:合肥荣事达电冰箱有限公司;LD4-2A低速离心机:北京雷勃尔离心机有限公司。
1.2方法
1.2.1玉米霉菌的分离及纯化
在无菌条件下,将25 g玉米放入到装有225 mL无菌水的三角瓶中,在恒温水浴振荡器上振荡20 min,然后进行梯度稀释至合适浓度。取0.5 mL稀释样品转移到孟加拉红培养基上,用无菌涂布棒涂匀后,放入恒温培养箱中,(28±1)℃条件下培养3 d~5 d。
待长出菌落后,用接种针挑取疑似霉菌菌落,在孟加拉红培养基上做划线分离,置于恒温培养箱内(28±1)℃培养5 d,镜检后,接种于试管马铃薯斜面培养基内于4℃冰箱内进行保存。
1.2.2玉米霉菌的鉴定
菌落形态观察:采用点植法将分离到的疑似霉菌菌落接种于察氏培养基和CD内,(28±1)℃培养5 d~7 d,期间测量菌落直径、观察菌落形态并拍照记录。
菌落显微结构观察:将上述得到的菌种制成水浸片,在载玻片上滴加一滴乳酸石碳酸棉兰染液,用解剖针从生长有霉菌的平板中挑取少量带有孢子的菌丝,用50%的乙醇浸润,再用蒸馏水将浸润过的菌丝清洗一遍,然后放入载玻片的染液中,用解剖针将菌丝仔细分散开来,盖上盖玻片,在光学显微镜下进行微观形态观察。
鉴定方法:参照GB/T4789.16-2003《食品卫生微生物学检验常见产毒霉菌的鉴定》[12]。
鉴定结果:参照GB/T 26628.1-2011《粮油检验储粮真菌标准图谱》[13]、《真菌鉴定手册》[14]和《中国气传真菌图谱鉴定》[15]等资料。
1.2.3霉菌检出率的测定
对分离霉菌时培养基上长出的单菌落进行计数,并在光学显微镜下进行观察,确定其菌属。霉菌检出率公式:
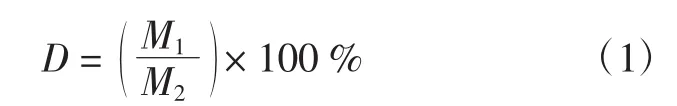
式中:D为菌属检出率;M1为各菌属单菌落数量;M2为总的单菌落数量。
2结果与分析
2.1霉菌鉴定结果
对玉米中的霉菌进行分离、纯化,得到5种霉菌,分为菌落特征和显微观察两部分进行研究。菌落特征包括:菌落生长速度、颜色、质地,渗出物和气味的有无,以在培养基上的颜色变化。显微观察包括:分生抱子形状、分生抱子梗的特征、小梗的着生方式等。
2.1.1黑曲霉(Aspergillus niger)鉴定
菌落生长较快,在高盐CD察氏培养基上生长5 d~7 d,直径为27.8 mm~41.2 mm;CA上生长5 d~7 d,直径29.9 mm~46.7 mm。菌落初期正反面均为白色,随培养时间增长,正面逐渐变为为黑色,致密厚绒状,无明显凸起;反面颜色加深,有褶皱及放射性沟纹,无气味,无渗出,菌落形态见图1。光镜下观察发现菌丝无色,分生孢子梗长且光滑,从壁厚而膨大的菌丝细胞垂直生出,无横隔,上部较粗大,顶端膨大成泡囊(球形、椭圆形或半圆形);从泡囊的表面丛生出小梗,小梗双层(初期为单层),分生孢子生于小梗顶端,黑色穗球状,初期光滑,后期较粗糙,微观形态见图2。参照标准图谱图3鉴定结果为黑曲霉。

图1 黑曲霉形态图(CA)Fig.1Form figure of A.niger(in CA)

图2 黑曲霉光学显微镜下形态图Fig.2Microscopic morphology of A.niger

图3 黑曲霉标准图Fig.3Standard figure of A.nigers
2.1.2烟曲霉(Aspergillus fumigatus)鉴定
CD上菌落生长较局限,培养5d~7d,直径2.1mm~9.9 mm;CA上菌落生长较为迅速,培养5 d~7 d,直径达到23.8 mm~33.2 mm。菌落正面为烟绿色或暗绿色,菌落绒絮状,无褶皱及沟纹;反面初期为白色至淡黄色,后期变为烟绿色或暗绿色,无渗出物,有霉味,有褶皱,菌落形态见图4。光镜下观察到其分生孢子穗圆筒状,呈绿色,分生孢子梗短且光滑;顶囊烧瓶装,仅上半部分或三分之二出产生孢子,分生孢子球状小梗单层,微观形态见图5。参照标准图谱图6鉴定结果为烟曲霉。

图4 烟曲霉形态图(CD)Fig.4Form figure of A.fumigatus(in CD)

图5 烟曲霉显光学微镜下形态图Fig.5Microscopic morphology of A.fumigates
2.1.3产黄青霉(Penicillium chrysogenum)鉴定

图6 烟曲霉标准图Fig.6Standard figure of A.fumigatus
菌落生长较较快,CD上生长5d~7d,直径13.0mm~16.4 mm;CA上生长5 d~7 d,直径18.4 mm~20.1 mm。菌落蔓延,表面致密绒状,出去呈白色,后颜色加深变为蓝绿色,具有明显的放射状沟纹,边缘白色;有渗出液扩散至培养基,背面呈黄色,菌落形态见图7。光镜下观察分生孢子梗光滑,帚状枝不对称,作2~3次分支,分支长短不等;分生孢子为椭圆形,显微结构见图8。参照标准图谱图9鉴定结果为产黄青霉。

图7 产黄青霉形态图(CA)Fig.7Form figure of P.chrysogenum(in CA)

图8 产黄青霉光学显微镜下形态图Fig.8Microscopic morphology of P.chrysogenum
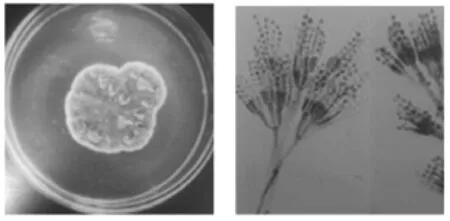
图9 桔青霉标准图Fig.9Standard figure of P.citrinum
2.1.4桔青霉(Penicillium citrinum)鉴定
菌落生长较局限,CD上生长5d~7d,直径8.6mm~10.7 mm;CA上生长5 d~7 d,直径9.8 mm~12.3 mm。表面绿色或艾绿色,呈绒状且致密,有放射状沟纹,边缘白色;反面淡黄色,与培养基颜色相仿,菌落形态见图10。光镜下观察分生孢子梗光滑由基质生出,不分支;帚状枝由三四个轮生略散开的梗基构成,每个基梗上簇生6个~10个密集平行的小梗;分生孢子球状或近球状,显微结构见图11。参照标准图谱图12鉴定结果为桔青霉。
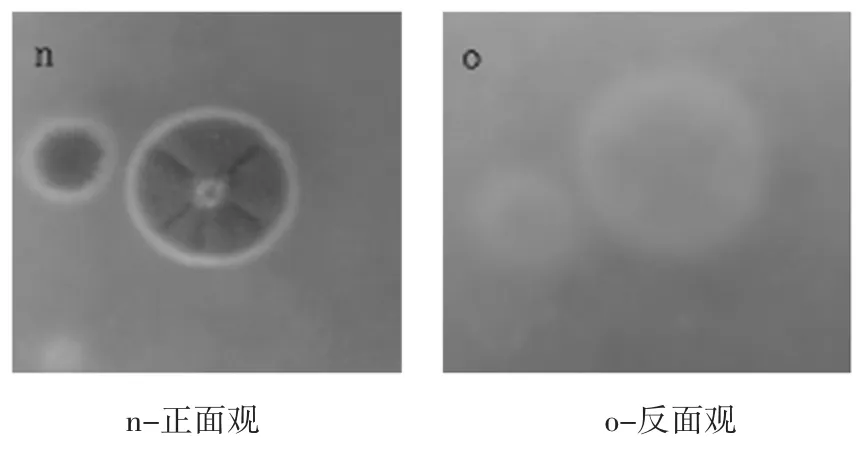
图10 桔青霉形态图(CD)Fig.10Form figure of P.citrinum(in CD)
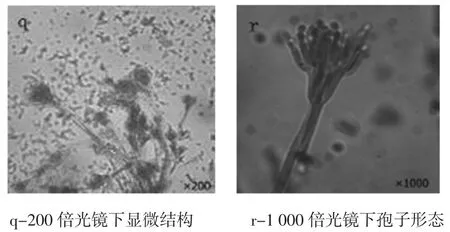
图11 桔青霉显光学微镜下形态图Fig.11Microscopic morphology of P.citrinum
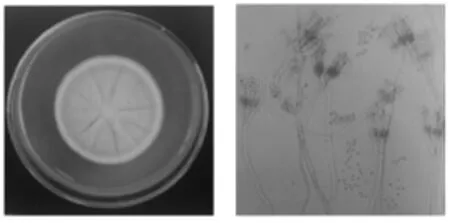
图12 桔青霉标准图Fig.12Standard figure of P.citrinum
2.1.5缓生青霉(Penicillium tardum)鉴定
菌落生局限,CD上生长5 d~7 d,直径2.6 mm~3.4 mm;CA上生长5 d~7 d,直径1.9 mm~3.1 mm。菌落薄且平坦,表面无褶皱,渐变灰绿色,中间絮状凸起,边缘白色;反面颜色较淡,中央黄色,与培养基颜色相仿,菌落形态见图13。光镜下观察分生孢子梗光滑由基质生出,2~3次分支,分支长短接近,分支上簇生出5个~8个密集小梗,分生孢子梗光滑;分生孢子椭圆形,光滑,显微结构见图14。参照标准图谱图15鉴定结果为缓生青霉。

图13 缓生青霉形态图(CA)Fig.13Form figure of P.tardum(in CA)

图14 缓生青霉显光学微镜下形态图Fig.14Microscopic morphology of P.tardum

图15 缓生青霉霉标准图Fig.15Standard figure of P.tardum
2.2霉菌检出率
玉米取样5次,分离到60个霉菌单菌落,各种菌属单菌落数和检出率见表1,其中曲霉属和青霉属检出率最高。

表1 霉菌检出率Table 1Detective rate of molds
3结论
使用孟加拉红培养基对玉米中的霉菌进行分离,对玉米进行5次取样,分离到60个霉菌单菌落,其中曲霉属检出率最高,青霉属次之。通过对霉菌在察氏培养基和高盐察氏培养基上的生长情况观察,包括菌落直径、颜色、质地、气味和有无渗出以及光学显微镜下对霉菌菌丝形态和分生孢子形态的观察,鉴定出5种霉菌,分别为黑曲霉、烟曲霉、产黄青霉、桔青霉和缓生青霉。
[1]周闯,何成华,司慧民.2012年国内饲料及原料霉菌毒素污染调查分析[J].畜牧与兽医,2014,46(1):81-84
[2]王金勇,刘颖莉,关舒.2013年1-7月中国玉米及小麦霉菌毒素检测报告[J].中国畜牧杂志,2013,4(18):1-7
[3]单安山,周长路,张圆圆,等.东北地区不同饲料原料中霉菌毒素污染情况调查[J].东北农业大学学报,2013,44(6):1-6
[4]申洪源.我国2012年玉米市场分析及2013年行情展望[J].粮食与油脂,2013,26(4):39-43
[5]文峰,张虎.2012年中国玉米行情回顾及2013年行情分析[J].粮食加工,2013,38(4):4-27
[6]李林轩.安全储藏玉米技术探讨[J].西部粮油科技,2007,32(3): 69-70
[7]程芳,陈伟.不同储藏条件下玉米真菌多样性研究[J].中国粮油学报,2011,26(10):83-87
[8]Riba A,Mokrane S,Mathieu F,et al.Mycoflora and ochratoxin A producing strains of Aspergillus in Algerian wheat[J].International Journal of Food Microbiology,2008,122(1):85-92
[9]Udagawa S,Tatsuno T.Safety of rice grains and mycotoxins-a historical review of yellow rice mycotoxicoses[J].Yakushigaku Zasshi. The Journal of Japanese History of Pharmacy,2003,39(2):321-342
[10]Omurtag G Z.Fumonisins,trichothecenes and zearalenone in cereals[J].International Journal of Molecular Sciences,2008,9(11):2062-2090
[11]Songsermsakul P,Sontag G,Ciehna-Markl M,et al.Determination of zearalenone and its metabolites in urine,plasma and faces of horses by HPLC-APCI-MS[J].Journal of Chromatography B,2006,843(2):252-261
[12]中华人民共和国卫生部.GB/T 4789.16-2003食品卫生微生物学检验常见产毒霉菌的鉴定[S].北京:中国标准出版社,2003:109-131
[13]中华人民共和国国家质量监督检验检疫总局.GB/T 26628.1-2011,粮油检验储粮真菌标准图谱第1部分:曲霉属[S].北京:中国标准出版社,2011:1-36
[14]魏景超.真菌鉴定手册[M].上海:科学技术出版社,1979:495-512
[15]乔秉善.中国气传真菌彩色图谱[M].北京:中国协和医科大学出版社,2012:46-120
Separation Purification and Identification of Molds in Corn
XU Yan-yang,YU Jing,MIAO Bin-bin,GUAN Huan-huan
(College of Biological and Agricultural Engineering,Jilin University,Changchun 130022,Jinlin,China)
Molds derived from corn were separated and purified by single colony,and identified.Corn samples were taken for 5 times from stored corn,and 60 single colonies were isolated.The highest detection rate was of Aspergillus,the higher was Penicillium.The growth situations of molds from corn were recorded,which included colony's diameter,texture,color,and exudates presence of molds in czapek's medium and high salt czapek's medium separately.And the microscopic morphology of molds from corn were observed by optical microscope.Compared with the standard figures,five kinds of molds from corn were identified as follows:Aspergillus funigatus,Aspergillus niger,Penicillium chrysogenu,Penicillium citrinum and Penicillium tardum. This result will provide reference to study further microflora in corn.
corn;molds;separation;purification;identification
10.3969/j.issn.1005-6521.2015.16.035
2014-06-10
吉林省科技发展计划项目(20120717);吉林大学开放性创新实验项目(456OEP16)
徐艳阳(1972—),女(汉),副教授,博士,主要从事食品营养与安全研究。

