阳离子纤维素与十二烷基苯磺酸钠的相互作用
韩 晶, 江笑丹
(国家知识产权局专利局专利审查协作江苏中心,江苏 苏州 215011)
与单一表面活性剂或聚合物体系相比,聚合物/表面活性剂复合体系具有优良的表面活性、溶解性、粘度、润湿性及发泡性能等。因此,研究聚合物与表面活性剂间的相互作用具有重要意义。
PQ-10(阳离子纤维素)是一种经阳离子改性的羟乙基纤维素的季铵盐衍生物,由于具有良好的生物相容性、亲水性和杀菌性能而被广泛地应用于日化产品中。目前,PQ-10/阴离子表面活性剂复合体系的相行为和流变行为[1-4]的研究较多。但是,关于 PQ-10/表面活性剂溶液在整个相变区域的微极性变化,以及聚集特性如溶液微极性的变化过程中所对应的表面活性剂聚集数的变化均未见报道。
本文通过稳态流变研究了PQ-10/SDBS复合物的结构,并用稳态荧光法研究了PQ-10/SDBS体系的微极性和聚集数。此外,还通过浊度滴定和电导率研究了PQ-10/SDBS体系的相行为和临界浓度。
1 实验
1.1 试剂和仪器
十二烷基苯磺酸钠,95%(上海晶纯实业有限公司);PQ-10,1%(wt)PQ-10溶液的电荷浓度约为12 mM(南京斯拜科生化实业有限公司);芘(Acros Organics公司);二苯甲酮(Alfa Aesar公司);二次蒸馏水(实验室自制)。
T6新世纪紫外可见分光光度计(北京普析通用有限公司);DDS-11A型数显电导率仪(上海雷磁仪器厂);Cary Eclipse型荧光分光光度计(美国VARIAN公司);AR2000型旋转流变仪(美国TA公司)。
1.2 实验方法
1.2.1 样品配制
将PQ-10溶液和SDBS溶液按照一定比例混合,最后用二次蒸馏水定容,在室温下放置72 h后再进行测试。
1.2.2 浊度滴定
溶液浊度以 100-T%表示,通过透光率来表征浊度,透光率越小则浊度越大,采用紫外可见分光光度计进行测试,测试波长为420 nm,温度为25℃。浊度滴定过程中,移取一定体积的PQ-10溶液(浓度为0.05%,w/V),然后滴入SDBS溶液(143 mM),同时补加与SDBS相同体积的PQ-10溶液(浓度为0.1%,w/V)。0.1%、0.2%、0.5% PQ-10/SDBS体系的测定方法类似。
1.2.3 电导率测定
测试温度为25℃,将电极浸入被测溶液中,温度稳定后记录读数。
1.2.4 稳态荧光测试
芘的浓度为2.5×10-6M,二苯甲酮的浓度为1.5×10-4M,芘在335 nm处激发,发射光谱扫描范围为350~450 nm,测试温度为25℃。荧光光谱中第一与第三振动峰的强度比I1/I3为溶液的微极性指数,由未添加和添加淬灭剂后的荧光强度来计算表面活性剂的聚集数Ns,如式(1)所示。

式中,[S]为表面活性剂浓度,[Q]为淬灭剂浓度,cac为复配体系的临界聚集浓度,I0和I分别为未添加淬灭剂和添加淬灭剂后的荧光强度。
1.2.5 稳态流变测试
选用平板夹具,夹具直径为40 mm,间隙为1 mm。测试过程中剪切速率控制在0.001~1 000 s-1,测试温度为25℃。
2 结果与讨论
2.1 复合体系的相行为
本实验在PQ-10浓度恒定(选取四个浓度:0.05%、0.1%、0.2%和0.5%)的情况下,增加SDBS的浓度,研究了复合体系的相行为。图1a为复合体系的浊度-SDBS浓度依赖曲线。复配体系临界点的确定(见图1b),C0为浊度开始增长的起点,C1为浊度迅速增长的点,对应于浊度微分曲线的最大值,C2为浊度达最大值的点,C3为最终浊度基本保持不变的点,PQ-10/SDBS复合体系的C0、C1、C2及C3值如表1所示。

图1 a. PQ-10/SDBS复配体系在不同PQ-10浓度下的浊度曲线(%,w/V);b. 复合体系C0、C1、C2和C3的确定
对于0.05%、0.1%和0.2% PQ-10/SDBS体系,开始时溶液浊度很小(<1)且保持不变,当SDBS浓度大于C0时,溶液浊度随SDBS浓度增大开始缓慢上升;当SDBS浓度达C1时,溶液浊度迅速上升且在SDBS浓度为C2时达最大值;之后,浊度开始下降,当SDBS浓度大于C3时,浊度又基本保持不变。对于0.5% PQ-10/SDBS复合体系,浊度在SDBS浓度很低时就开始上升,本实验条件下未检测到C0点。
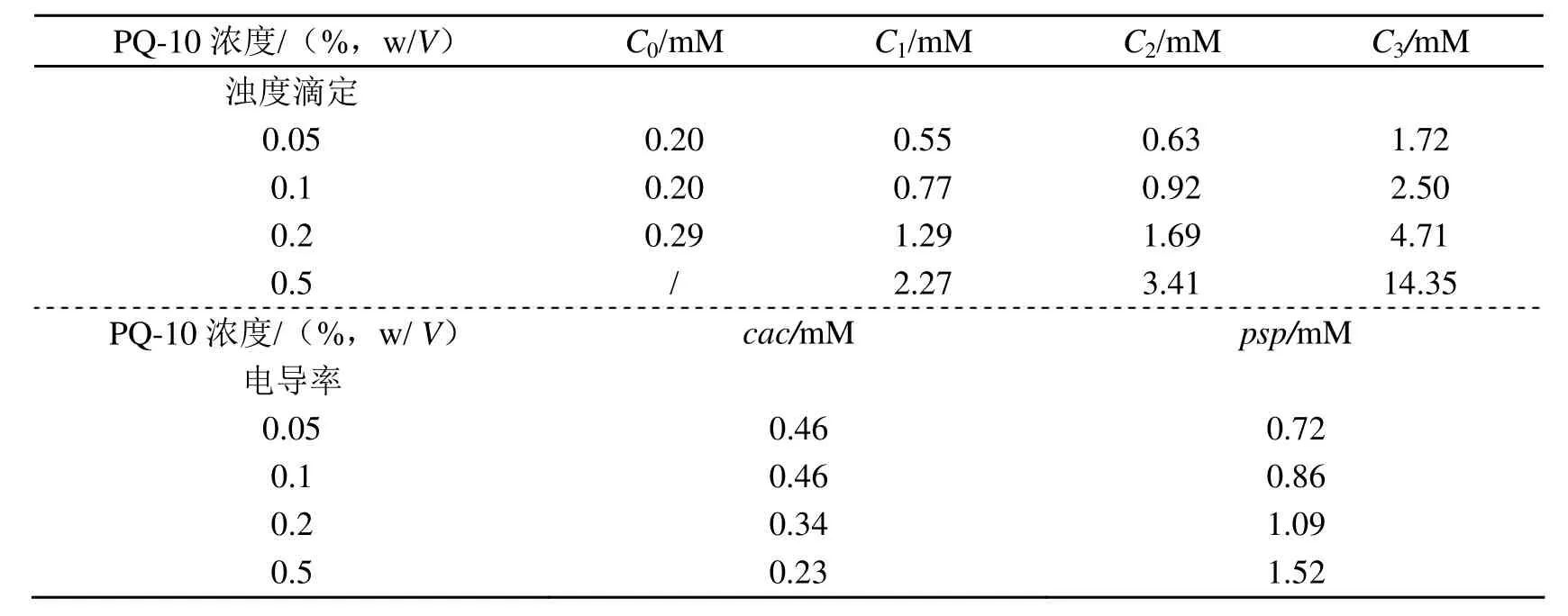
表1 PO-10/SDBS体系在水溶液中的临界浓度
C0对应于开始形成PQ-10/SDBS复合物的临界浓度。当SDBS浓度低于C0时,PQ-10链上并未形成类胶束聚集体[5-6],溶液是澄清的;当SDBS浓度达C0时,吸附在PQ-10链上的SDBS分子开始通过分子链间的疏水作用进行缔合,形成类胶束聚集体,溶液开始变浊。PQ-10/SDBS体系的C0值随聚合物浓度变化很小。增加SDBS浓度至C1时,溶液已经很浑浊,随后溶液分为明显的两相,沉淀相和上清液。此处浊度迅速上升就是沉淀出现所导致的,C1对应于复合体系出现沉淀的起点。如图 1(B)所示,C1可由浊度曲线的微分曲线确定,其对应于微分曲线的最大值处的SDBS浓度。PQ-10/SDBS复合体系的C1值随PQ-10浓度的增大而增大,这是由于对于带相反电荷的聚合物和表面活性剂复合体系,其相互作用的主要驱动力[7]为静电作用力,沉淀出现在电中性点附近[8],则PQ-10浓度越大,则需要越多的SDBS来中和阳离子电荷。溶液在SDBS浓度为C2时沉淀最多,随后沉淀开始溶解,且在SDBS浓度大于C3时又变澄清。复合体系的C2和C3值均随PQ-10浓度的增大而增大。C1-C3之间的区域为沉淀区域。
此外,还由目视法绘制了不同PQ-10浓度下复合体系的相图,如图2所示。

图2 PQ-10/SDBS复合体系相图(虚线代表电中性点)
每个相图均包括两个单相区及两个相分离区域,相分离区域包括沉淀区域和浑浊区域,沉淀区域中复合物从溶液中沉淀析出,浑浊区域中不溶物分散在溶液中。由目视法所得相图中沉淀区域的边界与浊度法确定的沉淀区域的边界基本一致,且沉淀区域随PQ-10浓度增大而变宽。
2.2 复合体系的电导率
图3a、3b分别为PQ-10/SDBS复合体系在不同聚合物浓度下和纯SDBS的电导率曲线。图3b中转折点即对应于SDBS的临界胶束浓度(cmc),约1.32 mM,与其它文献报道类似[9]。所有电导率曲线均出现两个转折点,符合聚合物和阴离子表面活性剂体系[10,11-17]的电导率曲线变化规律。其中,第一个转折点为临界聚集浓度(cac),第二个转折点为聚合物饱和浓度(psp)。PQ-10/SDBS复合体系的cac和psp值列于表1,由表1可知复合体系的cac值随PQ-10浓度增大而减小,psp值随PQ-10浓度增大而增大。此外,PQ-10/SDBS复合体系的电导率均高于纯 SDBS的电导率,且当 SDBS浓度一定时,PQ-10浓度越高,PQ-10/SDBS复合体系电导率越高。复合体系的电导率取决于聚电解质PQ-10和表面活性剂SDBS所解离的阳离子和阴离子,复合物中Na+的移动性要高于纯SDBS胶束中Na+的移动性[18-20],而且当SDBS结合到PQ-10聚合物链上时,聚合物会释放部分Cl-反离子。因此,PQ-10/SDBS复合体系的电导率会升高。
2.3 复合体系的微极性和聚集数
荧光光谱中的第一峰与第三峰荧光强度之比(I1/I3)称为疏水因子,其对芘分子所处环境的微极性非常敏感,疏水因子越大,则芘分子所处环境的极性越强;反之亦然。图4为0.5% PQ-10/SDBS复合体系的微极性曲线,纯 PQ-10的 I1/I3(解释)值约为1.7,与纯水的几乎一致,表明溶液中不存在疏水微区。随着SDBS的加入,溶液的I1/I3值开始下降。纯PQ-10链由于沿聚合物链分布的正电荷间的静电排斥作用,其构象较为伸展。当添加少量 SDBS后(低于 cac),SDBS分子通过静电作用力吸附在PQ-10链上,中和了部分正电荷,减小了静电排斥力,聚合物链由较为伸展的构象转变为卷曲的构象,形成部分疏水微区,因此溶液微极性下降。当SDBS浓度达到cac时,沿PQ-10链分布的SDBS分子开始形成类胶束聚集体,溶液中产生了更多、疏水性更强的疏水微区。因此,复合体系在0.03~0.86范围内,I1/I3值由1.58降为1.24。但当SDBS浓度位于0.86~1.43 mM范围内,溶液微极性不再随表面活性剂浓度的增大而下降,出现了一个平台区。在该区域内,芘处于类胶束聚集体的包围中,所处微环境中的极性相同,因此溶液的微极性保持不变。之后溶液的I1/I3值又开始下降,表明胶束内部疏水性增强。当SDBS浓度在2.87~4.30 mM范围内时,溶液的I1/I3值呈上升趋势,这是由于此时溶液中形成了沉淀,PQ-10/SDBS体系中的PQ-10和SDBS从溶液中析出,溶液极性变强所致。随着SDBS浓度继续增大,溶液中的沉淀开始溶解,相应地溶液的微极性又开始下降。

图4 0.5%PQ-10/SDBS溶液的微极性―SDBS浓度依赖关系
表2为0.5%PQ-10/SDBS复合体系在不同SDBS浓度下的聚集数。由表2可知,当表面活性剂浓度从0.43 mM增大到0.86 mM时,SDBS胶束的聚集数由3增大到13,表明PQ-10/SDBS中类胶束聚集体的尺寸增大内部疏水性增强,因此溶液微极性随SDBS浓度的增大而减小,如图4所示。而当SDBS浓度为0.86~1.43 mM时,胶束的聚集数基本不变(13到15),该浓度范围恰好对应于微极性曲线中的平台区域,表明此时类胶束聚集体的形成已结束,此时继续加入表面活性剂,只是增加了复合体系中类胶束聚集体的数目,而不是使类胶束聚集体的尺寸增大,类胶束聚集体内部环境中的极性没有发生变化,因此溶液微极性保持不变。此后,随SDBS浓度的继续增大, SDBS的聚集数从15增大到29,表明此时类胶束聚集体内部的疏水性增强,同时在该区域内溶液的微极性曲线呈下降趋势。这可能是由于随SDBS浓度增大,PQ-10上的结合位点逐渐变少,当SDBS过量时,PQ-10上的结合位点已全部被SDBS类胶束聚集体所占据,加入的SDBS只能进入已形成的类胶束聚集体中,使其尺寸增大形成更大的胶束,而不是引发新的类胶束聚集体的形成,因此溶液的微极性进一步下降。

表2 PQ-10/SDBS复合体系在不同SDBS摩尔浓度下的聚集数
2.4 稳态流变

图5 1%PQ-10/SDBS体系的h0与表面活性剂浓度关系图
图 5为 1% PQ-10/SDBS体系的零剪切粘度(h0)-SDBS浓度依赖关系曲线。如图5所示,随表面活性剂浓度增大,复合体系的h0呈现先缓慢增加(CSDBS<C1),而后迅速增大(C1<CSDBS<C2),最后又迅速下降的变化趋势(CSDBS>C2),C1值为2.87 mM,C2值为 3.73 mM。未添加 SDBS时溶液的h0值约为34 mPa·s,当加入SDBS后(浓度低于2.87 mM,对应于图 5中的 CSDBS<C1区域),溶液的h0值开始缓慢增加。SDBS首先以单分子的形式通过静电作用力结合在PQ-10分子链上,随着表面活性剂浓度的增大,结合在PQ-10上的SDBS分子中的疏水链通过疏水作用力缔合形成胶束,同时将不同的PQ-10分子链结合在一起,分子链运动受到阻碍,因此溶液粘度升高。当SDBS浓度为2.87~3.73 mM时(对应于图5中的C1<CSDBS<C2区域),PQ-10/SDBS体系的h0值迅速上升,这是由于越来越多的PQ-10分子链结合在一起形成网络结构所致。当SDBS浓度大于3.73 mM时,复合体系粘度开始下降,这是由于随表面活性剂浓度的继续增大,沿PQ-10链分布的SDBS胶束聚集体的电荷密度增大,在复合物之间和胶束内部均产生了强烈的静电排斥作用力,最终导致网络结构坍塌、复合物分解为小的聚集体,因此溶液的h0值下降。
3 结论
研究了带相反电荷的聚电解质PQ-10和阴离子表面活性剂SDBS的相行为、临界浓度、聚集性能、流变性能及体系微观结构。结果表明:复合体系的微极性和聚集数之间存在关联,微极性曲线下降部分对应聚集数增长区域,微极性曲线平台区对应的聚集数基本保持不变;稳态流变研究表明复合体系的粘度随表面活性剂浓度增加呈现先增大后减小的变化趋势,其中复合体系粘度增大的过程对应于网络结构的形成,复合体系粘度减小对应于网络结构坍塌的过程。
[1] Chronakis I S, Alexandridis P. Rheological properties of oppositely charged polyelectrolyte-surfactant mixtures: Effect of polymer molecular weight and surfactant architecture[J]. Macromolecules, 2001, 34(14): 5005-5018.
[2] Kästner U, Hoffmann H, Dönges R, et al. Interactions between modified hydroxyethyl cellulose (HEC) and surfactants[J].Colloids Surf A, 1996, 112(2-3): 209-225.
[3] Liu Y H, Yang R M, Zhang J X, et al. Rheological and self-assembly behavior of cationized hydroxycellulose with ionic surfactants[J]. Fiber Polym, 2010, 11(5): 744-748.
[4] Patruyo L G, Müller A J, Sáez A E. Shear and extensional rheology of solutions of modified hydroxyethyl celluloses and sodium dodecyl sulfate[J]. Polymer, 2002, 43(24): 6481-6493.
[5] Wang X Y, Li Y J, Li J X, et al. Salt effect on the complex formation between polyelectrolyte and oppositely charged surfactant in aqueous solution[J]. J Phys Chem B, 2005, 109(21): 10807-10812.
[6] Matsuda T, Annaka M. Salt effect on complex formation of neutral/polyelectrolyte block copolymers and oppositely charged surfactants[J]. Langmuir, 2008, 24(11): 5707-5713.
[7] Dan A, Ghosh S, Moulik S P. Interaction of cationic hydroxyethylcellulose (JR400) and cationic hydrophobically modified hydroxyethylcellulose (LM200) with the amino-acid based anionic amphiphile sodium N-dodecanoyl sarcosinate (SDDS) in aqueous medium[J]. Carbohydr Polym, 2010, 80(1): 44-52.
[8] Miyake M, Kakizawa Y. Study on the interaction between polyelectrolytes and oppositely charged ionic surfactants. Solubilized state of the complexes in the postprecipitation region[J]. Colloid Polym Sci, 2002, 280(1): 18-23.
[9] Greshman J W. Physico-chemical properties of solutions of para long chain alkylbenzenesulfonates[J]. J Phys Chem, 1957,61(5): 581-584.
[10] Ali M S, Suhail M, Ghosh G, et al. Interactions between cationic gemini/conventional surfactants with polyvinylpyrrolidone:Specific electric conductivity and dynamic light scattering studies[J]. Colloids Surf A, 2009, 350(1-3): 51-56.
[11] Ghosh S. Physicochemical and conformational studies of papain/sodium dodecyl sulfate system in aqueous medium[J].Colloids Surf A, 2005, 264(1-3): 6-16.
[12] Ghosh S, Banerjee A. A multitechnique approach in protein/surfactant interaction study: physicochemical aspects of sodium dodecyl sulfate in the presence of trypsin in aqueous medium[J]. Biomacromolecules, 2002, 3(1): 9-16.
[13] Minatti E, Zanette D. Salt effects on the interaction of poly(ethylene oxide) and sodium dodecyl sulfate measured by conductivity[J]. Colloids Surf A, 1996, 113(3): 237-246.
[14] Ruzza A A, Froehner S J, Minatti E, et al. Quantitative treatment of ketal hydrolysis in aqueous solutions containing polymer-surfactant complexes using a pseudophase kinetic model[J]. J Phys Chem, 1994, 98(47): 12361-12366.
[15] Witte F M, Engberts J B F N. Perturbation of SDS and CTAB micelles by complexation with poly(ethy1ene oxide) and poly(propy1ene oxide)[J]. J Org Chem, 1987, 52(21): 4767-4772.
[16] Zanette D, Ruzza  A, Froehner S J, et al. Polymer-surfactant interactions demonstrated by a kinetic probe: Degree of ionization[J]. Colloids Surf A, 1996, 108(1): 91-100.
[17] Faustino C M C, Calado A R T, Garcia-Rio L. Gemini surfactant-protein interactions: effect of pH, temperature, and surfactant stereochemistry[J]. Biomacromolecules, 2009, 10(9): 2508-2514.
[18] Winnik M A, Bystryak S M, Chassenieux C, et al. Study of interaction of poly(ethylene imine) with sodium dodecyl sulfate in aqueous solution by light scattering, conductometry, NMR, and microcalorimetry[J]. Langmuir, 2000, 16(10):4495-4510.
[19] Khan M Y, Samanta A, Ojha K, et al. Interaction between aqueous solutions of polymer and surfactant and its effect on physicochemical properties[J]. Asia-Pac J Chem Eng, 2008, 3(5): 579-585.
[20] Bystryak S M, Winnik M A. Unusual conductivity changes for sodium dodecyl sulfate solutions in the presence of polyethyleneimine and polyvinylamine[J]. Langmuir, 1999, 15(11): 3748-3751.

