超声波-酶法提取牛跟腱胶原蛋白
张云凤
(太原工业学院化学与化工系,山西 太原 030008)
超声波-酶法提取牛跟腱胶原蛋白
张云凤
(太原工业学院化学与化工系,山西 太原 030008)
分别采用胃蛋白酶法与超声波-酶法提取牛跟腱胶原蛋白,比较了两种方法胶原蛋白的产率,并对胶原蛋白进行光谱测试。实验证明,超声波酶法的产率明显较高。
超声波;提取;红外 光谱;紫外光谱
世界经济的快速发展,需要新型的能源来代替化石燃料,其中生物质资源是一种很不错的清洁能源,胶原就是一种可再生的动物生物质清洁能源。胶原是动物细胞外基质的重要组成部分,胶原的排列方式对维护组织和细胞的状态、结构完整和强度起到及其重要的作用[1]。
超声波辐射作为一种促进传质的方法,被应用于提取、共混和染色中[2-5],主要的机理是迅速形成和破裂的空化泡形成热效应、化学作用、机械效应[6]。但是,空化形成的高温高压,容易使蛋白质变质。一些学者指出,控制超声波频率和功率,一些酶的活性会得到提高,因此,超声波和酶的组合在酚类降解[7]、废水处理[8]、纺织等方面得到广泛的应用。不过,超声波对酶的活性影响方面的研究还非常欠缺。
本文分别用胃蛋白酶法与超声波辅助酶法提取牛跟腱胶原蛋白,在相同条件下,比较两者的提取率,并将两种方法得到的胶原蛋白进行红外和紫外测试,对胶原蛋白进行鉴定。主要目的是研究温和的超声波对生物大分子的影响,并探明超声波是否可以作为一种提高胶原酶提得率的有效手段。
1 实验部分
1.1主要实验材料与仪器
牛跟腱(bovine tendon),胃蛋白酶(1∶3000),其他试剂均为分析纯。
FA2104型电子天平,JB300D型强力电动搅拌机,智能磁力搅拌机,KQ-50DB型数控超声波清洗器,Spectrum 100型FT-IR红外光谱仪,TU1901型双光束紫外可见分光光度计。
1.2实验操作
1.2.1预处理
将买来的新鲜牛跟腱清洗干净,并且除去附着在牛跟腱表面的白色黏膜后,再次清洗干净,切成小于5mm的小块,倒于烧杯中,用1mol·L-1的氯化钠溶液持续搅拌24h,除去跟腱中的盐溶性杂质以及其他的可溶性杂质,再用去离子水清洗数次。再将处理后的牛跟腱用丙酮溶液进行浸泡,时间为12h,丙酮具有毒性而且易于挥发,此步骤应放入通风橱操作,加入丙酮的目的是除去跟腱中的脂类物质,浸泡之后取出并将其清洗干净,放在室温下自然风干,待用。
1.2.2胃蛋白酶提取法

其中,Vc是胶原提取液的体积,mL;Cc是通过紫外法测得的胶原提取液的浓度, g·mL-1;Wt是提取使用的牛跟腱的重量,g。每次测试都进行2~3次重复。
1.2.3超声波-胃蛋白酶提取法
胶原的超声波-胃蛋白酶法提取过程中,提取装置放在具有超声波发生器和可以控温的水浴中。用温度计对水浴的温度进行检测。为了防止超声空化作用引起提取液过热现象,在提取的3d时间里超声波采取运行30min暂停30min的方式。提取过程除了增加超声波辐照外,其他步骤与胃蛋白酶法相同。
1.2.4紫外测试
打开双光束紫外分光光度计,并预热0.5h,备好待测样品,准备测试。将提取好的胶原蛋白用0.5M的醋酸溶液进行溶解,配置成一定浓度的溶液,配置好的溶液必须为澄清状态。用配置好的溶液及醋酸溶液润洗比色皿2~3次,将两种溶液装入比色皿中,按照顺序依次放到仪器中进行测试。打开软件进行测定,将得到的紫外谱图仔细分析,找出最大的吸收波长。胶原溶液浓度的定量检测是在浓度与吸光度标准曲线的参照下进行的。
1.2.5红外测试
打开红外测试仪的开关,并且预热0.5h左右,等待测试。将干燥好的胶原蛋白从培养皿中取出来一些,小心放到红外测试仪中进行测试,检测范围400~4000cm-1,检测带宽4cm-1。完成后将放药品的地方擦拭干净。对得到的谱图进行分析。
2 结果与分析
2.1超声处理对料液温度的影响
将预处理好的牛跟腱放入超声波清洗器中,并且设定温度20℃,温度不要太高,以免胶原蛋白发生变质,频率为40Hz,实验时间为8h,超声波采取运行30min暂停30min的方式。

表1 超声波处理牛跟腱温度变化
在对牛跟腱进行超声波处理时,由于超声波具有机械效应与空化效应,所以会使超声波清洗器中水的温度升高,从而使烧杯内的温度也升高,但是只要不超过胶原蛋白的变质温度就可以。
2.2胶原的紫外谱图与提取液中胶原浓度的检测方法
对胶原标准品及实验所得胶原溶液进行全扫描,结果见图1。由图1可知,本实验的特征吸收峰在280nm左右,这主要是酪氨酸(278 nm)和苯丙氨酸(259 nm)对紫外的吸收叠加[9]。

图1 两种方法提取胶原的紫外谱图
图2 为胶原醋酸溶液浓度于280nm处紫外吸收的依赖性曲线,通过对不同浓度胶原溶液在280nm处吸光度的检测,可以得到胶原浓度于280nm的吸光度标准曲线,用于检测提取过程胶原浓度的变化。
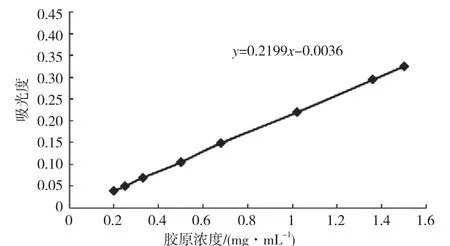
图2 胶原醋酸溶液浓度于280nm处紫外吸收的依赖性
2.3超声波对于胶原提取的影响
酶法提取胶原和超声波-酶法提取胶原过程中胶原浓度的变化趋势见图3。结果显示,在这个提取过程中,超声波-酶法提取得到的胶原溶液浓度始终高于传统的酶提取法。两种方法提取过程中胶原得率值如表2所示。胶原提取2d后,相比传统的酶法,超声波-酶提取法的胶原得率由24.93%提高到30.86%。这说明传统的酶法提取胶原需要浪费更多时间而得到较少产品,而超声波-酶提取法可以加快天然胶原纤维水解从而得到胶原分子。另外,超声波-酶法提取中胶原浓度在提取过程的前16h增加迅速,24h时浓度基本平衡,说明此方法的提取时间可由传统方法的2d缩短到不足1d。显然,提取时间的减少对节约能源和保持胶原活性都是好的。
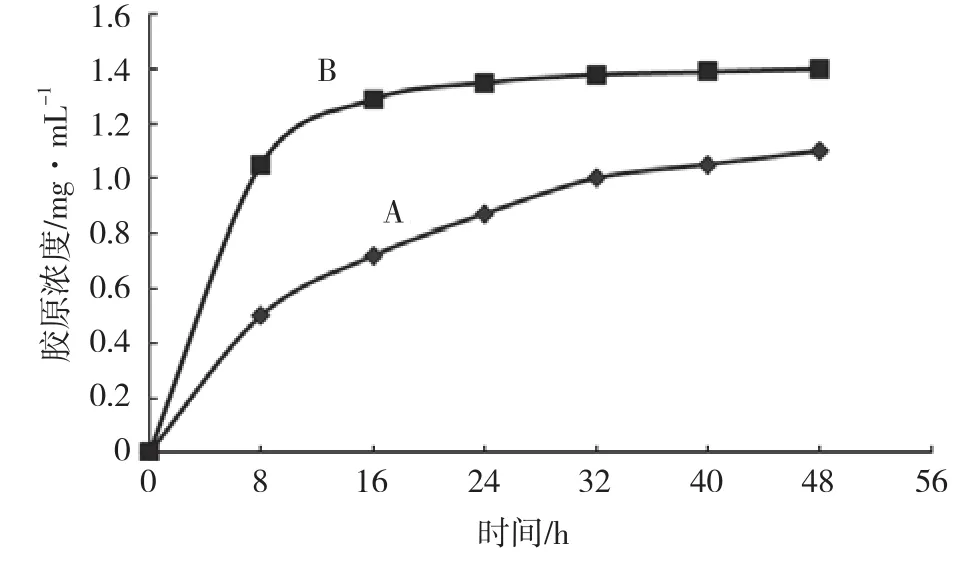
图3 提取液浓度随时间的变化(λ=280nm)

表2 超声波-酶法与胃蛋白酶法的胶原提取率
2.4单独搅拌和超声波对胶原提取率的影响
单独搅拌和超声波对胶原液浓度的变化趋势如图4所示。由图4可知,没有胃蛋白酶存在的情况下,超声波提取只能得到很少的胶原,搅拌提取得到的胶原更少。结果说明超声波可以打散胶原纤维,使更多的酸溶胶原溶出,但这个作用是有限的,16h后几乎没有酸溶胶原再溶出。
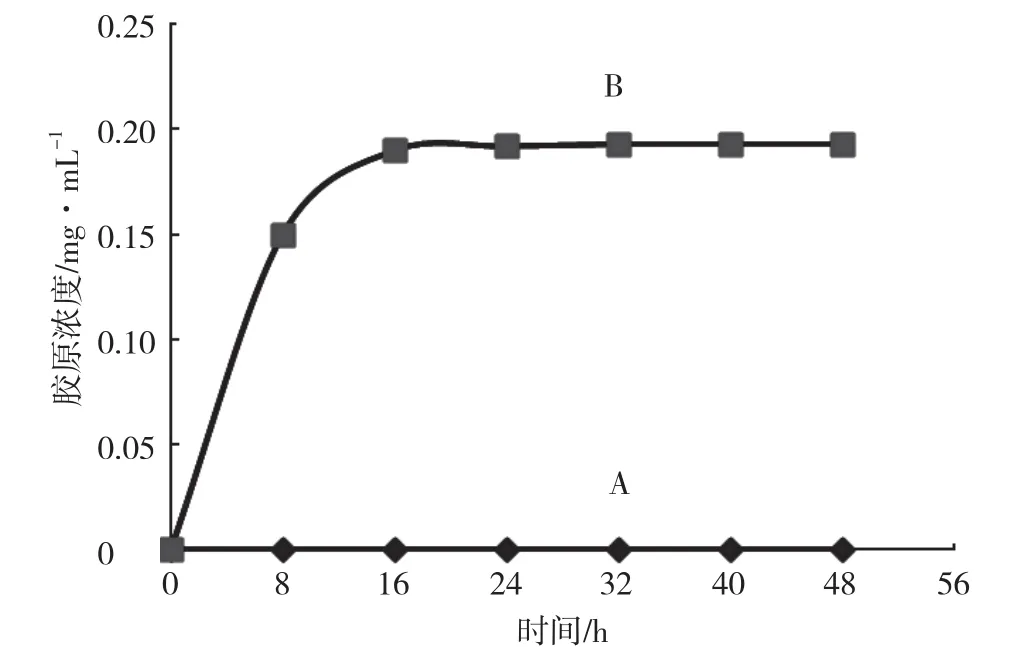
图4 胶原浓度随时间的变化曲线
2.5胶原的红外谱图与分析
胶原蛋白有4个特征吸收峰,为3330 cm-1、2930 cm-1、1636~1661 cm-1和1450~1230cm-1。由图5可以看出,胃蛋白酶法与超声波酶法提取得到的胶原蛋白都有这4个主要的吸收峰,3346cm-1、3329cm-1和2937cm-1、2935cm-1附近是N-H伸缩振动,1645cm-1附近是酰胺Ⅰ带的C=O伸缩振动,1394和1387cm-1是N-H伸缩振动[10],说明超声波不会破坏胶原蛋白的结构。

图5 胶原蛋白的红外谱图
3 结论
多次的实验结果可以得出,用超声波-酶法提取出来的胶原蛋白产率要比胃蛋白酶法的产率高,且提取时间短。红外与紫外测试谱图显示,超声波-酶法提取得到的胶原相比传统酶法提取得到的胶原,其主要特征吸收峰与标准吸收峰基本一致,均保留了其三股螺旋结构。
[1] Cameron G J, Alberts I L, Liang J H, et al. Structure of Type I and Type III Heterotypic Collagen Fibrils: An X-Ray Diffraction Study [J]. Journal of Structural Biology, 2002: 15-22.
[2] Sivakumar V, Rao P G. Studies on the use of power ultrasound in leather dyeing [J]. Ultrasonics Sonochemistry,2003(10): 85-94.
[3] Yachmenev V G, Bertoniere N R, Blanchard E J. Intensification of the bio-processing of cotton textiles by combined enzyme/ ultrasound treatment [J] Journal of Chemical Technology and Biotechnology, 2002(77): 559-567.
[4] Yachmenev V G, Blanchard E J, Lambert A H. Use of ultrasonic energy for intensification of the bio-preparation of greige cotton [J]. Ultrasonics Ultrasonics, 2004(42): 87-91.[5] Vajnhandl S, Le Marechal A M. Ultrasound in textile dyeing and the decolourization/mineralization of textile dyes [J]. Dyes and PigmentsDyes Pigments, 2005(65): 89-101.
[6] Basto C, Silva C J, Gübitz G, et al. Stability and decolourization ability of trametes villosa laccase in liquid ultrasonic fields [J]. Ultrasonics Sonochemistry, 2007(14):355-362.
[7] Entezari M H, P é trier C. A combination of ultrasound and oxidative enzyme: sono-enzyme degradation of phenols in a mixture [J]. Ultrasonics Sonochemistry, 2005(12): 283-288.
[8] Sangave P C, Pandit A B. Ultrasound and enzyme assisted biodegradation of distillery wastewater [J]. Journal of Environmental Management, 2006(80): 36-46.
[9] Li H, Chen H L, Luo R, et al. The interaction between collagen and an aluminum tanning agent [J]. Macromolecular Bioscience, 2003(3): 344-346.
[10] 刘芳.冷冻凝胶法制备双醛淀粉改性胶原基生物医用材料[D].成都:四川大学,2008.
Extraction of Collagen from Bovine Tendon by Ultrasonic - Enzymatic Method
ZHANG Yun-feng
(Department of Chemistry and Chemical Engineering, Taiyuan Institute of Technology, Taiyuan 030008, China; )
This study compared the collagen yield which extracted from bovine tendon by stomach protein enzymatic method and ultrasonic-enzymatic method. The collagen was teste d by infrared spectrum and ultraviolet spectrum. Experiments showed that the yield of ultrasonic-enzymatic method was signifi cantly higher than stomach protein enzymatic method.
ultrasound; extraction; infrared spectrum; ultraviolet spectrum
TQ 93
A
1671-9905(2015)12-0023-03
张云凤(1987-),女,硕士
2015-10-09

