快速溶剂萃取-超高效液相色谱-串联质谱法测定蜂花粉中氯霉素
祝子铜,雷美康,彭 芳,李 东,陈玉娇,章应俊(衢州出入境检验检疫局综合技术服务中心,浙江衢州324002)
快速溶剂萃取-超高效液相色谱-串联质谱法测定蜂花粉中氯霉素
祝子铜,雷美康,彭芳,李东,陈玉娇,章应俊
(衢州出入境检验检疫局综合技术服务中心,浙江衢州324002)
建立了快速溶剂萃取-超高效液相色谱-串联质谱法(UPLC-MS/MS)测定蜂花粉中氯霉素的分析方法。样品以乙酸乙酯为萃取溶剂经快速溶剂萃取仪(ASE)萃取,硅胶固相萃取柱净化,采用液质联用多反应监测负离子模式测定,同位素内标法定量。方法线性范围0.5~10 ng/mL,相关系数为R2=0.9936,回收率在88.3%~110.0%之间,相对标准偏差在5.3%~8.9%之间,检出限为0.1 μg/kg。该方法具有效率高、试剂用量少、选择性好、灵敏度高等优点。
蜂花粉,快速溶剂萃取,超高效液相色谱-串联质谱法,氯霉素
氯霉素是一种应用广泛的广谱抗生素,对各类家禽、家畜、水产品及蜜蜂的各种传染性疾病的控制和治疗起重要作用[1]。同时,氯霉素具有严重的毒副作用,且化学性质稳定,残留于动物源性食品中的氯霉素严重威胁着人类健康。因此,美国、欧盟、日本和我国等国家都将该类药物列入禁止使用的兽药名单中,并制定出相关的最高残留限量(MRL)[2]。
对于出口蜂花粉,美国、欧盟、日本等国家都要求检测其中的抗生素,如氯霉素、硝基咪唑类化合物等。目前氯霉素检测主要集中在蜂蜜、蜂王浆、水产品、化妆品、肉制品等基质中[3-8],前处理主要采用乙酸乙酯、乙腈等有机试剂进行人工提取[9-11],操作步骤繁琐,耗时。对于蜂花粉中氯霉素等抗生素检测文献报道较少[12-13]。因此,为了解决蜂花粉中氯霉素检测技术问题,保证蜂花粉出口顺畅,急需建立一套蜂花粉中氯霉素的检测方法。
快速溶剂萃取法是近年新发展的一种前处理技术,在固体样品中污染物、动物源性食品中兽药残留等的提取中有广泛的应用,具有溶剂用量少、提取时间短和样品提取自动化等优点[14-17]。超高效液相色谱-串联质谱法采用1.8 μm填料色谱柱,同时采用三重四级杆串联质谱仪进行检测,具有分析速度快、分离度大、灵敏度高、定性准确等优点。因此,本研究采用快速溶剂萃取法进行萃取,硅胶固相萃取柱进行净化,超高效液相色谱-串联质谱法检测,同位素内标法定量分析蜂花粉中氯霉素。
1 材料与方法
1.1材料与仪器
硅胶固相萃取柱500 mg,6 mL,上海安谱公司;C18固相萃取柱500 mg,6 mL,上海安谱公司;甲醇、乙酸乙酯色谱纯,德国默克公司;乙酸乙酯、正己烷分析纯,上海国药;实验用水超纯水;氯霉素标准品德国Dr公司;氘代氯霉素标准品德国Dr公司;蜂花粉一部分为企业送检样品,一部分从浙江江山健康蜂业有限公司购买。
1260-6460液相色谱串联四级杆质谱仪美国安捷伦科技有限公司;E-916快速溶剂萃取仪、R-210旋转蒸发仪瑞士BUCHI公司;MS3 Digital漩涡振荡器德国IKA公司;固相萃取装置德国CNW公司;N-EVAPTM111氮吹仪美国organomation公司;BARNSTEAD NANOPURE超纯水仪美国赛默飞科技中国有限公司。
1.2实验方法
1.2.1标准溶液的配制和曲线绘制标准储备液:分别精密称取适量的氯霉素(CAP)标准品和氘代氯霉素(CAP-D5)标准品,用甲醇溶解并定容,配制成0.1 mg/mL的标准储备液。该溶液在4℃的冰箱中保存。中间标准储备液:分别准确吸取适量标准储备液,用甲醇逐级稀释成1.0 μg/mL中间标准储备液。标准工作溶液:吸取不同体积的中间标准储备液,用甲醇水溶液(体积比2∶8)稀释成0.5、1.5、3.0、5.0、10.0 ng/mL的标准工作溶液,其中内标为5.0 ng/mL,现配现用。按照1.2.3和1.2.4建立的液相色谱条件和质谱条件进行测定,作待测物与其同位素内标物峰面积比对浓度比的标准曲线,求出直线回归方程。
1.2.2样品前处理方法准确称取蜂花粉样品2 g(精确至0.01 g)于150 mL烧杯中,加入100 μL浓度为100 ng/mL的氘代氯霉素内标溶液,加入2 g硅藻土,将样品与硅藻土混合均匀,将混和好的样品转移至底部铺有石英砂的萃取池中,上部再铺一层石英砂,加盖拧紧,将萃取池放入快速溶剂萃取仪中进行萃取,萃取液收集于240 mL收集瓶中,将萃取液转移至鸡心瓶中,45℃下旋蒸至近干。加入5 mL乙酸乙酯-正己烷(体积比2∶8)溶解残渣,待净化。
硅胶固相萃取柱用5 mL乙酸乙酯-正己烷(体积比2∶8)进行活化,将上述溶液转移至萃取柱中,再加入5 mL乙酸乙酯-正己烷(体积比2∶8)洗涤鸡心瓶,洗涤液转移至萃取柱中,弃去流出液,用8 mL乙酸乙酯进行洗脱,接收全部洗脱液,45℃下氮气吹干,加入1 mL甲醇水溶液(体积比2∶8),超声1 min,涡旋混合1 min,过0.22 μm滤膜,待分析。
快速溶剂萃取仪萃取效率受萃取溶剂、温度、压力、循环次数等影响,因此,本研究对上述影响因素进行优化。在考察萃取温度时,使用乙酸乙酯作为萃取溶剂、压力90 bar、循环次数3次,实验选取90、100、110、120℃4个温度进行单因素实验。在考察萃取压力时,将萃取温度设定为100℃、使用乙酸乙酯作为萃取溶剂、循环次数3次,实验选取90、100、110、120 bar 4个萃取压力进行单因素实验。在萃取试剂为乙酸乙酯,萃取压力100 bar,萃取温度100℃,氮吹60 s,溶剂洗涤30 s条件下,分别选取静态萃取循环次数2次和3次进行实验。
对样品净化条件进行优化,取6支50 mL离心管,分别加入10 mL乙酸乙酯-正己烷(体积比2∶8)溶液,加入50 ng氯霉素标准溶液,将上述溶液转移至已活化的硅胶固相萃取柱中,固相萃取柱用5 mL乙酸乙酯-正己烷(体积比2∶8)进行活化,再加入5 mL乙酸乙酯-正己烷(体积比2∶8)进行淋洗,弃去流出液,分别用5、6、7、8、9、10 mL乙酸乙酯进行洗脱,接收全部洗脱液,45℃下氮气吹干,加入1 mL甲醇水溶液(体积比2∶8),超声1 min,涡旋混合1 min,过0.22 μm滤膜,待分析。
1.2.3液相色谱条件色谱柱:Zorbax SB-C18(2.1 mm× 50 mm,1.8 μm);流动相:A相为超纯水;B相为甲醇;柱温40℃;流速:0.3 mL/min;进样量10 μL;液相色谱流速及梯度洗脱见表1。
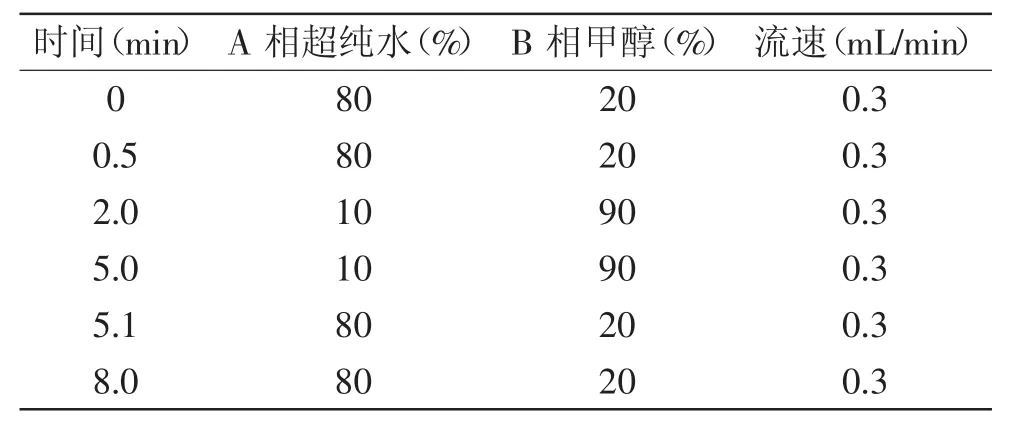
表1 液相色谱流速及梯度洗脱程序Table 1 HPLC flow rate and gradient elution program
1.2.4质谱参数离子源:电喷雾离子化源(ESI),负离子模式;干燥气温度:350℃;干燥气流速:5 L/min;喷雾气压力:50 psi;鞘气温度:400℃;鞘气流速:12 L/min;毛细管电压:3000 V;多反应监测扫描(MRM)采集参数见表2。
2 结果与分析
2.1提取条件优化
2.1.1萃取溶剂选择经过查阅大量文献,提取氯霉素类抗生素的试剂主要有乙酸乙酯和乙腈[18-20]。但是乙腈的毒性较大,在对样品进行高温高压提取过程中挥发出的乙腈会对人体产生毒害。而乙酸乙酯毒性相对较小,且在后续的浓缩过程中易蒸干,经过实验验证,乙酸乙酯能够很好地将氯霉素从蜂花粉基质中提取出来,因此,本实验选用乙酸乙酯为萃取溶剂。
2.1.2萃取温度优化温度是快速溶剂萃取的重要参数。随着温度的升高,溶剂的粘度下降,溶剂浸润基质和溶解目标分析物的能力增强。但是随着温度的进一步提高,可能会促进部分抗生素的分解[21],导致回收率降低。经实验优化,本实验选择100℃作为萃取温度。
2.1.3萃取压力优化 加压的目的是使溶剂在高温下仍然处于液态[22]。经实验优化,当萃取压力120 bar时,由于压力较高,仪器易发生警报不能进行萃取。由图2可知,萃取压力为100 bar时萃取效率最高,本实验选择100 bar作为萃取压力。

图1 萃取温度对氯霉素萃取效率的影响Fig.1 Effect of extraction temperature in ASE on extraction efficiency of chloramphenicol
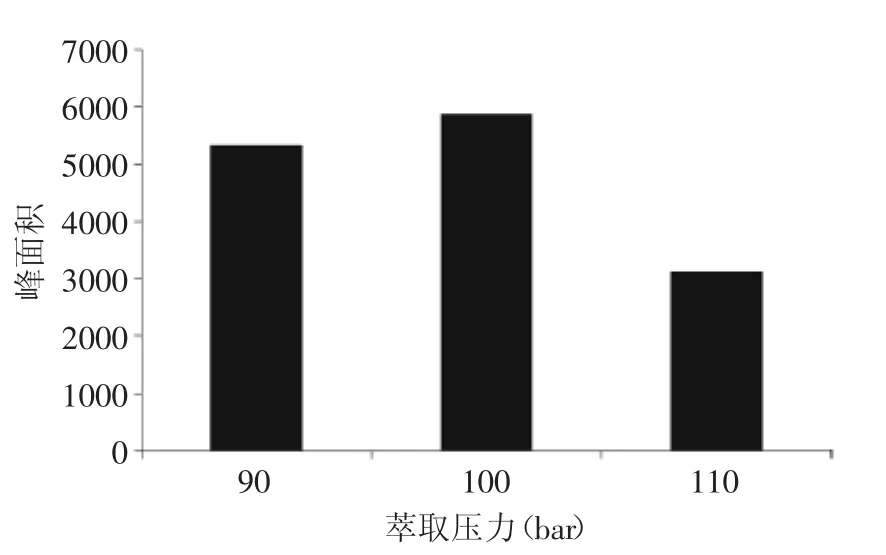
图2 萃取压力对氯霉素效率的影响Fig.2 Effect of extraction pressure in ASE on extraction efficiency of chloramphenicol
2.1.4循环次数优化静态循环次数优化结果表明静态萃取循环2次就基本能够将氯霉素萃取完全。因此,本实验选择使用静态萃取循环次数为2次。

图3 萃取循环次数对氯霉素萃取效率的影响Fig.3 Effect of extraction cycle index in ASE on extraction efficiency of chloramphenicol
2.2净化条件优化
由于蜂花粉基质复杂,含有大量的天然色素、黄酮和纤维成分,在液质分析中存在严重的基质抑制作用。因此,需要通过一定的净化方法去除干扰物质,降低基质抑制作用。本研究分别选取硅胶固相萃取柱和C18固相萃取柱进行比较,在净化过程中发现C18固相萃取柱很容易被堵塞。而使用硅胶固相萃取柱没有发生堵塞现象且净化效果良好。因此,本研究选用硅胶固相萃取柱进行净化。图4为洗脱溶剂体积对氯霉素洗脱效果影响的比较。由图4可以看出当洗脱体积为7和8 mL时,氯霉素的峰面积最大。当洗脱体积大于8 mL时,氯霉素峰面积反而减小。可能是由于洗脱体积增大,在后续氮吹等实验过程中目标物损失较多。因此,本实验室选择使用8 mL洗脱液进行洗脱。

图4 洗脱溶剂体积对洗脱效果影响的比较Fig.4 The comparison of elution effect with different eluting volume
2.3色谱条件优化
色谱柱是色谱分析技术的核心[23],本研究比较了Agilent Zorbax SB-C18(2.1 mm×50 mm,1.8 μm)和Agilent Eclipse XDB-C18(2.1 mm×100 mm,1.8 μm)2款色谱柱。2款色谱柱在实际的样品检测中均能将目标分析物和基质干扰物分离,且目标物峰型对称、尖锐。Agilent Eclipse XDB-C18因其柱子较长产生的反压比较大,且增加了分析时间,而Zorbax SB-C18具有更低的反压、更快的分析速度,能够大大的提高工作效率。因此,本实验选择Agilent Zorbax SB-C18作为液相色谱分析柱。
2.4质谱参数建立
本研究采用液相色谱进样方式在负离子模式下对待测化合物的标准溶液进行母离子全扫描,确定准分子离子峰[M-1]-,再分别以待测化合物的准分子离子为母离子进行碎裂,进行二级子离子扫描,选择2个特征子离子,选择信噪比大、峰形好、干扰小的离子对作为定量离子对。优化后的质谱参数见表2,利用优化后的色谱和质谱条件对氯霉素进行分析。

表2 氯霉素液质测定条件Table 2 The optimized spectrometric parameters for chloramphenicol residue
2.5内标物选择
应用液质联用技术分析样品中痕量兽药残留时,基质效应是时常遇到的现象,基质效应的出现可导致测试结果重复性差,定量结果难以保证[24]。同位素内标法是目前液质联用分析中经常使用的一种定量技术,由于同位素内标物结构与目标分析物一致,受基质影响程度相同,在质谱中的碎裂行为相似[25]。因此,同位素内标法可有效的降低基质效应的影响,提高定量的准确性。本文选用氘代氯霉素(CAP-D5)作为内标物。
2.6方法的线性关系、检出限和定量限
在本研究所确定的条件下,以目标分析物与其同位素内标物浓度比值为横坐标x,以目标分析物与同位素内标物峰面积比值为纵坐标y,绘制氯霉素标准溶液工作曲线,氯霉素在0.5~10 ng/mL范围内呈良好的线性关系。该方法的检出限和定量限由空白样品添加回收实验获得,以3倍信噪比(RSN)为检出限、10倍信噪比(RSN)为定量限,氯霉素的检出限和定量限分别为0.1 μg/kg和0.3 μg/kg。

表3 氯霉素的线性方程及线性范围Table 3 Linear ranges and regression equations of Chloramphenicol residue
2.7精密度和回收率
为测定本方法的精密度和回收率,实验选用空白蜂花粉为样品基质,添加不同量的氯霉素标准溶液,进行加标回收实验,加标水平为0.3、0.6、1.0 μg/kg,每个添加水平均做6个平行样,其结果见表4。由表4可以看出,氯霉素的加标回收率在88.3%~110.0%之间,相对标准偏差在5.3%~8.9%之间,能够满足分析方法的要求。

表4 回收率与精密度实验结果(n=6)Table 4 Mean recovery rates and precision for 6 replicate determinations(n=6)
2.8实际样品分析
将本研究建立的方法编写成实验室的标准操作规程,应用于实验室的检测工作。按照1.2.2的前处理方法,对送检和购买的6批次蜂花粉样品进行检测,虽然有个别样品中有氯霉素峰,但是都小于方法检出限。其中有峰的两个样品,结果分别为0.08 μg/kg和0.05 μg/kg。下一步将继续使用该方法检测企业委托送检的样品,积累更多的数据。
3 结论
本研究建立了蜂花粉中氯霉素残留检测的超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法。通过对液相色谱、质谱、快速溶剂萃取仪、硅胶固相萃取柱条件进行优化。经方法学验证,方法线性范围0.5~10 ng/mL,相关系数为R2=0.9936,回收率在88.3%~110.0%之间,相对标准偏差在5.3%~8.9%之间,检出限为0.1 μg/kg。本研究与文献[12]中的方法相比,在萃取环节采用了快速溶剂萃取仪进行萃取,减少了人工操作,自动化水平大大提高。在净化过程中,文献[12]使用2种固相萃取柱进行净化,本研究仅使用1种固相萃取柱进行净化,大大降低了时间和物力成本。本研究使用同位素内标法进行定量,方法的灵敏度、准确度和精密度均能满足兽药残留分析方法的要求。
[1]宋巍巍,柴春彦,刘国艳,等.动物源性食品中氯霉素检测方法的研究进展[J].畜牧与兽医,2007,39(4):54-56.
[2]吴永宁,周宗灿,王绪卿.现代食品安全科学[M].北京:化学工业出版社,2003:153-182.
[3]沈崇钰,丁涛,陈惠兰.高效液相色谱-电喷雾多级质谱联用测定蜂产品中氯霉素残留[J].检验检疫科学,2003,13(6):26-28.
[4]孟宪双,马强,李晶瑞,等.高效液相色谱-串联质谱法同时测定祛痘化妆品中的3种氯霉素类抗生素[J].分析实验室,2014,33(3):332-336.
[5]王清,王国民,郗存显,等.复合免疫亲和柱净化-液相色谱-串联质谱法同时测定动物源性食品中6种玉米赤霉醇类化合物和氯霉素残留量[J].色谱,2014,32(6):640-646.
[6]谢世红,谢世涛,孟霞,等.液相质谱法同时测定水产品中氯霉素和硝基呋喃类代谢物残留量的研究[J].现代科学仪器,2014,3:232-238.
[7]王浩,杨红梅,郭启雷,等.液相色谱-串联质谱法同时测定婴幼儿配方乳粉中氯霉素、三聚氰胺、甲硝唑和洛硝哒唑[J].分析化学研究简报,2013,41(2):283-287.
[8]高洁.气相色谱-串联质谱法同时测定肉制品中氯霉素、甲砜霉素残留[J].中国酿造,2013,41(2):283-287.
[9]王立琦,贺利民,曾振灵,等.液相-串联质谱检测兽药残留中的基质效应研究进展[J].质谱学报,2011,32(6):321-332.
[10]彭涛,李淑娟,侯晓刚,等.高效液相色谱/串联质谱法同时测定虾中氯霉素、甲砜霉素和氟甲砜霉素残留量[J].分析化学,2005,33(4):463-466.
[11]Takino M,Daishima S,Nakahara T.Determination of chloramphenicol residues in fish meats by liquid chromatographyatmospheric[J].Journal of Chromatography:A,2003,1011:67-75.
[12]Fujita K,Ito H,Nakamuar M,et al.Determination of chloramphenicol residues in bee pollen by liquid chromatography/ tandem mass spectrometry[J].J AOAC Int,2008,91(5):1103-1109.
[13]杨雯筌,辛志宏,殷耀,等.LC-MS-MS检测蜂花粉中硝基呋喃类代谢物[J].食品科学,2013,34:183-190.
[14]左艳丽,孙汉文,魏立静.快速溶剂萃取-毛细管电泳法测定土壤和底泥中磺胺类药物残留[J].分析实验室,2012,31(2):62-66.
[15]杨洪生,孟勇,张美琴,等.快速溶剂萃取-超高效液相色谱-串联质谱法同时测定水产品中氯霉素和氟苯尼考[J].理化检验-化学分册,2012,48:1353-1356.
[16]Carabias-Martfnez R,Rodriguez-Gonzalo E,Revilla-Ruiz P,et al.Pressurized liquid extraction in the analysis of food and biological samples[J].Journal of Chromatography:A,2005,1089(1/2):1-17.
[17]Mendiola J A,Herrero M,Cifuentes A,et al.Use of compressed fluids for sample preparation:Food applications[J]. Journal of Chromatography:A,2007,1152(1/2):234-246.
[18]冯民,魏云计,朱臻怡,等.高效液相色谱-串联质谱法同时测定饲料中氯霉素、甲砜霉素与氟甲砜霉素残留量[J].分析测试学报,2013,32(1):117-121.
[19]罗辉泰,黄晓兰,吴慧勤,等.QuEChERS/液相色谱-串联质谱法同时测定鱼肉中30种激素类及氯霉素类药物残留[J].分析测试学报,2011,30(12):1329-1337.
[20]胡雪,李翠枝,刘丽君,等.UPLC-MS-MS法测定饲料、原料乳及乳制品中3种氯霉素类药物残留[J].食品科学,2014,35(16):110-113.
[21]Carretero V,Blasco C,Pico Y,et al.Multi-class determination of antimicrobials in meat by pressurized liquid extraction and liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography:A,2008,1209(1/2):162-173.
[22]刘静.ASE快速溶剂萃取-解决固体、半固体样品前处理的新技术[J].现代科学仪器,2002(3):59-61.
[23]郝昀,李挥,孙汉文,等.加速溶剂萃取在动物源食品农兽药残留分析中的应用进展[J].河北大学学报:自然科学版,2012,32(4):434-448.
[24]石先哲,李攻科,梁振,等.色谱研究最新进展[J].化学通报,2014,77(7):720-730.
[25]向平,沈敏,卓先义.液相色谱-质谱分析中的基质效应[J].分析测试学报,2009,28(6):753-756.
Determination of chloramphenicol residue in bee pollen by accelerated solvent extraction-ultra performance liquid chromatography-tandem mass spectrometry
ZHU Zi-tong,LEI Mei-kang,PENG Fang,LI Dong,CHEN Yu-jiao,ZHANG Ying-jun
(Comprehensive Technology Center of Quzhou Entry-Exit Inspection and Quarantine Bureau,Quzhou 324002,China)
A method for analysis of chloramphenicol residue in bee pollen was developed.Sample was extracted using accelerated solvent extraction with ethyl acetate as extraction reagent and purified by Silica solid phase. Mass spectrometer was operated in the negative ion mode using select reaction monitoring.Isotope internal standard was used for quantitative analysis.The linearity of the calibration curve was from 0.5 to 10 ng/mL with correlation coefficient was 0.9936.Recovery rates for chloramphenicol in a negative bee pollen sample spiked at three levels were between 88.3%and 110.0%,with RSD range of 5.3%~8.9%.The limit of detection in the method was 0.1 μg/kg.This method proved to be of high efficiency,small amount of reagent,good selectivity and high sensitivity.
bee pollen;accelerated solvent extraction(ASE);ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);chloramphenicol(CAP)
TS201.1
A
1002-0306(2015)20-0068-05
10.13386/j.issn1002-0306.2015.20.005
2015-01-20
祝子铜(1985-),男,硕士,工程师,研究方向:食品及动物源性产品中兽药残留检测,E-mail:zztzzt1124@163.com。

