小麦麸皮抗冻蛋白的纯化及理化性质的研究
金周筠,刘宝林(上海理工大学医疗器械与食品学院,生物系统热科学研究所,上海200093)
小麦麸皮抗冻蛋白的纯化及理化性质的研究
金周筠,刘宝林*
(上海理工大学医疗器械与食品学院,生物系统热科学研究所,上海200093)
本文纯化了一种小麦麸皮抗冻蛋白,并对其氨基酸组成、二级结构进行了分析。采用粗分离、饱和硫酸铵沉淀、离子交换色谱(DEAE-cellulose-26)、凝胶过滤色谱(Sephadex G75)四步对其进行纯化,纯化倍数为449.99倍,产率为4.17%,分子量为11.2 ku,热滞活性为0.169℃(5 mg/mL)。氨基酸组成结果表明:其甘氨酸含量较高(52.08 mol%),亲水性好。将其与几种常见抗冻糖蛋白进行相关性分析,推断其是一种与冷诱导相关的蛋白。采用傅里叶红外光谱检测,获得其二级结构为:α-螺旋:25.96%~26.52%,β-折叠:21.69%~23.78%,β-转角:35.31%~37.61%,无规卷曲:13.69%~15.08%。
抗冻蛋白,纯化,热滞活性,氨基酸组成,二级结构
抗冻蛋白(AFP)是一种能够抑制冰晶生长和重结晶的蛋白,具有热滞活性(THA)。热滞活性是指在结晶过程中,冰点与熔点之间的温度差异。热滞活性对确定所提取的蛋白是否为抗冻蛋白有指导意义。1992年,Griffith第一次明确提出获得植物内源抗冻蛋白,从经低温锻炼能够忍受细胞外结冰的冬黑麦叶片质外体中纯化得到了该蛋白[1]。目前,多种植物抗冻蛋白已被分离纯化和表征,包括冬黑麦(Secalecereale L.)、胡萝卜(Daucus carota)、沙冬青(Ammopiptanthus mongolicus)等[2]。
抗冻蛋白在冷冻食品行业内有广阔的应用前景,在GB 2760-2011中被列为新型食品添加剂,可用于冷冻食品的生产,但高昂的价格[3],严重制约了其在食品工业中的应用。我国作为小麦生产大国,每年仅小麦加工副产物—小麦麸皮的产量即达2000万吨以上。小麦麸皮因其资源丰富、营养价值高等优点,已广泛利用于健康食品、副产品开发等多种方面;但其在抗冻蛋白开发方面的报道仍较少。从中提取出高活性、制备兼顾低成本、适合大规模生产且安全性高等优点的抗冻蛋白,是一个很有潜力的项目。
本文采用小麦麸皮为原材料制备粗提wbAFP,采用传统工艺方法,经四个步骤:粗分离、饱和硫酸铵沉淀、离子交换色谱法、凝胶过滤色谱法,对wbAFP进行纯化,分析其氨基酸组成,并与其他常见抗冻蛋白进行比较。为进一步了解该wbAFP的抗冻机理,本文借助傅里叶红外光谱仪,测定了该小麦麸皮抗冻蛋白的二级结构,确定了其二级结构的范围,对其二级结构进行了初探。该研究对于小麦麸皮的再利用及抗冻蛋白的生产都具有较好的实践意义。
1 材料与方法
1.1材料与仪器
小麦麸皮产于上海市崇明县堡镇小漾村,蛋白质含量14.22%,水分含量11.82%,总灰分4.52%,粉碎过100目筛,常温下储藏备用;低分子量标准蛋白Marker碧云天生物技术研究所;透析膜(MWCO 3.5 ku)美国Spectrumlabs公司;DEAE-cellulose-26柱、Sephadex G75柱美国GE公司;牛血清白蛋白、硫酸铵、盐酸、磷酸氢二钠、磷酸二氢钾、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、丙烯酰胺、甘油、β-巯基乙醇、溴酚蓝、甲醇、冰醋酸、考马斯亮蓝G250等上海国药集团化学试剂有限公司。
Mini Trans-Blot Cell型垂直电泳仪美国Bio-Rad公司;Pyris Diamond差示扫描量热仪美国Perkin-Elmer公司;ATKA purifier 100UPC型蛋白纯化仪美国GE公司;L-8900型自动氨基酸分析仪日本Hitachi公司;VERTEX 70型傅里叶红外光谱仪德国Bruker公司;PyrisⅠ型热重分析仪美国Perkin-Elmer公司。
1.2小麦麸皮抗冻蛋白的分离纯化
参考前人方法稍作改动[4]。
1.2.1粗分离称取100 g小麦麸皮溶于750 mL磷酸盐缓冲液(PBS 30 mmol/mL、pH7.8)中,搅拌4 h,然后在25℃、5000 r/min条件下离心15 min,获得上清液。
1.2.2饱和硫酸铵沉淀上清液用100%饱和硫酸铵溶液在室温下沉淀12 h,然后在25℃、5000 r/min条件下离心15 min。沉淀复溶于蒸馏水中,并用截流相对分子质量3.5 ku的透析膜(MWCO)对纯水透析12 h、冷冻干燥得冻干粉。
1.2.3离子交换色谱法纯化将经饱和硫酸铵沉淀的冻干粉100 mg复溶于5 mL 10 mmol/mL PBS(pH7.8)中,溶液用DEAE柱(2.6 cm×18 cm)以2 mL/min的速度用0~1.0 mol/L的NaCl梯度洗脱,柱子预先用10 mmol/mL PBS(pH7.8)平衡。检测波长为280 nm。收集显示热滞活性的洗脱峰,用截流相对分子质量3.5 ku的透析膜(MWCO)对纯水透析12 h、冻干。
1.2.4凝胶过滤色谱法纯化将经离子交换色谱法纯化的冻干粉50 mg复溶于3 mL 10 mmol/mL PBS(pH7.8)中,溶液用Sephadex柱(1.5 cm×50 cm)以0.2 mL/min的速度用0.9%NaCl洗脱,柱子预先用0.9%NaCl平衡。检测波长为280 nm。收集显示热滞活性的洗脱峰,用截流相对分子质量3.5 ku的透析膜(MWCO)对纯水透析12 h、冻干。冻干后的粉末即为高纯度的wbAFP。
1.3纯化参数的测定
将产率和纯化倍数作为纯化过程的主要参数。将粗分离蛋白的质量设为100%,后续纯化步骤获得的抗冻蛋白的质量与其的比值,即为产率。参照酶的比活力定义,将单位质量的wbAFP的热滞活性定义为特异性热滞活性(specific THA,THAs);将粗分离蛋白的THAs设为100%,后续纯化步骤获得的抗冻蛋白的THAs与其的比值,即为纯化倍数。
1.4热滞活性测定
采用DSC法,参照陈廷超等的方法稍作改动[5]。将10 μg样品(浓度为5 mg/mL)密封于铝制坩埚中,放置在样品池中央,降温至-30℃,然后升温至25℃,再降温至-30℃。接着,缓慢升温至样品体系为固液混合物状态,称为保留温度(Th),停留2 min,再将温度从Th降低至-30℃,重复上述过程,在不同的Th下停留2 min。记录不同Th下,样品结晶的起始温度(T0),上述过程中升降温的速率均为1.0℃/min。热滞活性参照如下公式计算:
1.5蛋白质分子量的测定
电泳参照LaemmLi的不连续系统[6],并稍作改进。按照1∶1(体积分数)的比例将样品与样品缓冲液充分混合,沸水浴5 min。浓缩胶浓度为4%,分离胶为15%。样品分别在80 V和120 V的恒压条件下迁移,总电泳时间约120 min。电泳结束后,凝胶在考马斯亮蓝染色液中染色约1 h,然后脱色至凝胶背景接近无色。
1.6氨基酸组成的测定
将150 mg经四步纯化脱盐后的抗冻蛋白样品定容至100 mL,用6 mol/L的盐酸溶液在110℃下真空水解24 h。借助自动氨基酸分析仪测定氨基酸组成,与标准氨基酸的洗脱峰进行一一对比、指认,求得氨基酸的组成。
1.7氨基酸相关性比较
参考Chou等[7]建立的以氨基酸残基的百分比组成为基础的统计方法。该方法认为:同一类蛋白质有相似的组成。搜索已在文献中报道的具有抗冻活性的蛋白,将其编号输入NCBI数据库(www.ncbi.nlm. nih.gov),获得各种抗冻蛋白的氨基酸组成,与小麦麸皮抗冻蛋白的氨基酸数量进行对比。相关系数大于0.05的定义为无相关,小于0.05的定义为弱相关,小于0.01的定义为强相关。
1.8傅里叶红外光谱检测
电气是电能的生产、传输、分配、使用和电工装备制造等学科或工程领域的统称。电气工程专业是电能,电气设施与电气技术为门径来建造,保持和完善有限制性范围与情景的一门课程,包含了电能的转变,利用与探究三个内容,包含基本理论、运用技能、设施设备等;电气工程是当今科技区域里的中心科学的一部分,也是如今高新技术区域里不能漏掉的关联学科。也是电子技术的重大进展才拉动了以计算机网络为背景的信息时代的来临,并且转变了人们的生活和工作方式。电气工程的发展前景同样很有潜力,使得当今的学生就业比率一直很高。
将高纯度的wbAFP置于干燥器中充分干燥20 min,称取1 mg样品与100 mg溴化钾研磨后充分混合,压制成1 mm厚的圆形薄片,置于样品池中进行傅里叶红外光谱检测。仪器进行空气、水蒸气校正,用纯溴化钾压片做空白样品。测定波数为4000~400 cm-1,分辨率为0.4 cm-1,扫描次数16次。

将原始图谱进行减差,减差原则为使2200~1800 cm-1范围内呈一条直线。取酰胺Ⅰ带(1700~1600 cm-1)和酰胺Ⅲ带(1340~1220 cm-1)为研究对象,采用Peakfit 4.12软件进行分析。首先对图谱段进行5点平滑处理,后进行两点基线校正,做二阶导数和傅里叶去卷积,采用高斯函数对图谱进行多次拟合,使残差最小,不同谱带完全分离,根据其积分面积计算各类二级结构的相对百分含量。
1.9数据处理
使用Microsoft Excel 2007进行数据处理及分析。
2 结果与分析
2.1分离纯化过程的分析
小麦麸皮抗冻蛋白的纯化经四个步骤:粗分离、饱和硫酸铵沉淀、离子交换色谱、凝胶过滤色谱。对各部分产物的各项指标进行测定,结果见表1。结果表明:蛋白纯化倍数为449.99倍,产率为4.17%。

表1 小麦麸皮抗冻蛋白纯化过程的参数变化Table 1 Parameters changes of purification peocess of wbAFP
在另一篇文章中,作者已考察了饱和硫酸铵浓度对热滞活性的影响,本文不再赘述。离子交换色谱法易受样品盐浓度的影响,盐浓度过高,会导致各组分提前被洗脱。因此,必须对上样的样品进行脱盐处理。将样品进行离子交换色谱操作后,共出现7个洗脱峰,依次编号为P1~P7(详见图1、表2)。
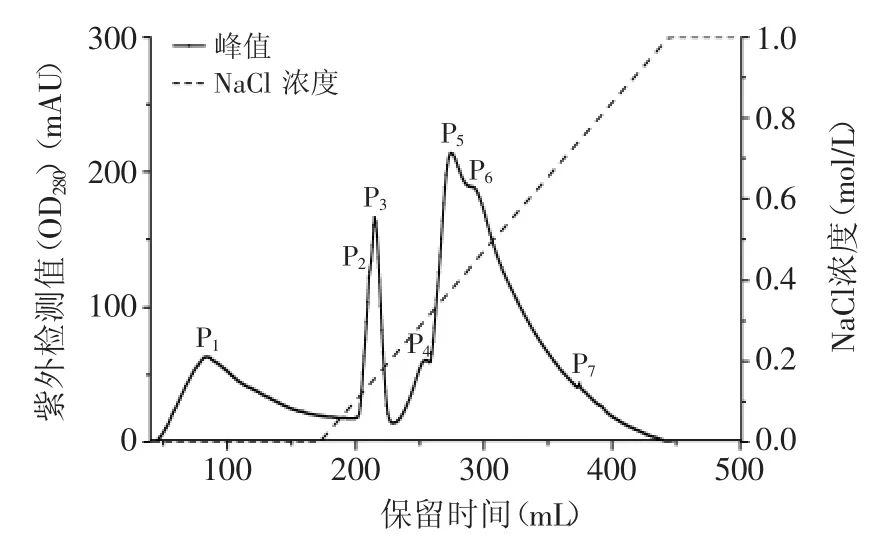
图1 小麦麸皮抗冻蛋白的离子交换图谱Fig.1 Anion-exchange chromatography profile of wbAFP

表2 小麦麸皮抗冻蛋白离子交换色谱步骤的参数变化Table 2 Parameters changes of anion-exchange chromatography of wbAFP
根据图1所示,P1的顶峰位置所对应的NaCl浓度为0 mol/L,即P1的出峰位置在NaCl梯度洗脱开始之前,有可能是因为蛋白未能吸附在色谱柱上。NaCl洗脱浓度达到0.75 mol/L之后,未洗脱出任何峰,可认为洗脱完全。其中P1、P3显示出了热滞活性,其热滞活性分别为0.097、0.135℃;其他洗脱峰的热滞活性极低,可认为是未检出。

图2 P1峰的凝胶过滤色谱图谱Fig.2 Size-exclusion chromatography profile of fraction P1

图3 P3峰的凝胶过滤色谱图谱Fig.3 Size-exclusion chromatography profile of fraction P3

表3 小麦麸皮抗冻蛋白凝胶过滤色谱步骤的参数变化Table 3 Parameters changes of size-exclusion chromatography of wbAFP
表3显示,次级峰P12、P32显示了热滞活性,而P11和P31未显示出活性。同时,P32的活性稍大于P12的活性(分别为0.177、0.161℃)。由于其本底存在差异,P1和P3在进行凝胶过滤色谱分离时,在基线位置存在较大差异,但并不影响其洗脱。由图2、图3可知,P12、P32的保留时间不同(47.44 min和56.64 min),但由于其洗脱条件完全相同,因此猜测这两个洗脱产物为同一种蛋白,而随后的电泳结果(图4)证明了这一猜测,该蛋白的分子量为11.2 ku。

图4 小麦麸皮抗冻蛋白的电泳结果Fig.4 SDS-PAGE of purified wbAFPs
该抗冻蛋白的热滞活性在5 mg/mL时为0.169℃,与植物源抗冻蛋白的活性相近(0.1~0.6℃)[8]。Duman报道,欧白英(Solanum dulcamara)抗冻蛋白的热滞活性在浓度为10~35 mg/mL时为0.3℃[9]。张超等在研究胡萝卜(Daucus carota)时发现,其热滞活性在浓度1 mg/mL时为0.1℃[10]。不同种类的抗冻蛋白在不同浓度处显示其最高的热滞活性,这可能与其本身的特性有关。由于抗冻蛋白能非依数性地降低溶液的冰点,因此,溶液的浓度对其活性会产生一定的影响。抗冻蛋白的纯度对其活性也有重要影响。表1显示经硫酸铵沉淀的抗冻蛋白的热滞活性为0.020℃,而经过离子交换色谱、凝胶过滤色谱步骤后,其热滞活性达到了0.169℃,这时的纯化倍数已达449.99倍。
2.2氨基酸组成分析
氨基酸组成分析结果见表4。由于采用酸水解,天冬酰胺(Asn)被水解,以天冬氨酸(Asp)形式出现,因此,天冬酰胺(Asn)显示未检出,含量为0。同理,谷氨酰胺(Gln)也以谷氨酸(Glu)形式出现,含量为0。色氨酸在酸水解过程中,吲哚环被破坏,因此为未检出,含量为0。为检测色氨酸含量,又采用碱水解法,在290 nm处检测色氨酸含量,其含量极低,可以忽略。

表4 小麦麸皮抗冻蛋白的氨基酸组成Table 4 Amino acid composition of wbAFP
假如在该蛋白中,含量最少的氨基酸(Met)仅出现1次,该蛋白应有152个残基。这些残基的分子量总和应为14.22 ku,经过脱水缩合反应,该蛋白的分子量理论上应为11.502 ku,与电泳结果相似(11.2 ku)。
在20种天然氨基酸中,有8种是必须氨基酸,分别为:异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、甲硫氨酸(Met)、苯丙氨酸(Phe)、苏氨酸(Thr)、色氨酸(Trp)、缬氨酸(Val),这8种必须氨基酸在该小麦麸皮抗冻蛋白中的总含量达14.32 mol%,含量较高,说明该蛋白有很高的利用价值。
根据侧链基团的极性,氨基酸一般分为非极性氨基酸和极性氨基酸。非极性氨基酸又称为疏水氨基酸。除丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、脯氨酸(Pro)、苯丙氨酸(Phe)、色氨酸(Trp)、甲硫氨酸(Met)外,其余12种天然氨基酸均为亲水氨基酸。根据氨基酸分析结果可知,该小麦麸皮抗冻蛋白富含大量亲水氨基酸,尤其是甘氨酸(Gly),含量达52.08 mol%,各类亲水氨基酸总量达82.3 mol%,可认为该蛋白具有很好的亲水性。有文献报道,大部分AFP都具有较高的亲水性[11]。Graham等也发现,一种来源于昆虫的抗冻蛋白有较强的亲水性[12]。来源胡萝卜的一种抗冻蛋白也有很高的亲水性[13]。

表5 小麦麸皮抗冻蛋白与几种抗冻蛋白的相关系数Table 5 Character correlation coefficients for wbAFP and other AFPs
2.3氨基酸相关性分析
由表5可知,经比较发现,该小麦麸皮抗冻蛋白与Q75QN9,一种来源于小麦的富甘氨酸冷休克蛋白相关性较高。同时,该蛋白与另一种来源于胡萝卜(Daucus carota)的富甘氨酸RNA结合蛋白Q03878[10]相关性也较高。这两种蛋白都与冷诱导相关。
同时,将该抗冻蛋白与几种常见的抗冻糖蛋白:Q9DFU2(Gymnodraco acuticeps)、Q1AMQ0(Eleginus gracilis)、Q8S5Z3(Oryza sativa)[7]进行比较,基本无相关性。另一方面,该抗冻蛋白与P43650,这种同样提取自小麦,但非冷诱导蛋白相关性较低。由此可推断,该抗冻蛋白是一种与冷诱导相关[14]的蛋白。
2.4傅里叶红外光谱分析
图5是该抗冻蛋白在4000~400 cm-1范围内的傅里叶红外光谱图。其在酰胺Ⅰ带(1700~1600 cm-1)和酰胺Ⅲ带(1340~1220 cm-1)中的图谱解析结果详见图6~图8。

图5 小麦麸皮抗冻蛋白的傅里叶红外光谱图Fig.5 FT-IR spectra of wbAFP

图6 酰胺Ⅰ带的高斯曲线拟合图谱Fig.6 Gaussian fitting curves in amideⅠregion

图7 酰胺Ⅲ带的高斯曲线拟合图谱Fig.7 Gaussian fitting curves in amideⅢregion

表6 小麦麸皮抗冻蛋白的傅里叶红外光谱测定二级结构Table 6 Secondary structure of wbAFP determined by FT-IR spectra
根据文献报道[15-17],在酰胺Ⅰ带中,1650~1660 cm-1是α-螺旋的特征吸收峰,1610~1640 cm-1是β-折叠的特征吸收峰,1660~1700 cm-1是β-转角的特征吸收峰,在酰胺Ⅰ带中,α-螺旋与无规卷曲特征吸收峰(1640~1650 cm-1)相邻,易于混淆。同样地,在酰胺Ⅲ带中,1330~1290 cm-1是α-螺旋的特征吸收峰,1250~1220 cm-1是β-折叠的特征吸收峰,1295~1265 cm-1是β-转角的特征吸收峰,1270~1245 cm-1是无规卷曲的特征吸收峰。其中,1245~1250、1265~1270、1290~ 1295 cm-1这3个区域是相邻二级结构的交盖区,在其特征峰归属方面需注意,视具体情况而定。因此,将酰胺Ⅰ带与酰胺Ⅲ带相结合,将更有利于分析蛋白的二级结构。
在酰胺Ⅰ带的谱带中,在α-螺旋与无规卷曲特征吸收峰的交界处,对区分其归属存在一定困难,在酰胺Ⅲ带中,由于α-螺旋与无规卷曲的特征吸收峰相距较远,其归属区分相对容易[18]。1649 cm-1处的特征峰恰处于酰胺Ⅰ带的谱带的α-螺旋与无规卷曲特征吸收峰的交界处。由酰胺Ⅲ带的峰归属可知,该抗冻蛋白的无规卷曲含量在15%左右,因此,将1649 cm-1处的特征峰划分为无规卷曲。
在酰胺Ⅲ带的谱带中,1296 cm-1处的特征峰在α-螺旋与β-转角特征吸收峰的交界处,结合酰胺Ⅰ带的峰归属,应将其划分为β-转角的峰。
根据峰归属情况,在酰胺Ⅰ带中,α-螺旋、β-折叠、β-转角、无规卷曲的比例为26.52%、23.78%、35.31%、13.69%;在酰胺Ⅲ带中,α-螺旋、β-折叠、β-转角、无规卷曲比例为25.96%、21.69%、37.61%、15.08%。
综合分析,该抗冻蛋白的二级结构为:α-螺旋:25.96%~26.52%,β-折叠:21.69%~23.78%,β-转角:35.31%~37.61%,无规卷曲:13.69%~15.08%。
3 结论
本文研究了一种小麦麸皮抗冻蛋白。该抗冻蛋白提取自小麦麸皮,经过离子交换色谱、凝胶过滤色谱步骤后,其热滞活性在5 mg/mL时为0.169℃,纯化倍数为449.99倍,产率为4.17%。该抗冻蛋白的分子量为11.2 ku,甘氨酸含量较高(52.08 mol%),亲水性好。将其与几种常见抗冻糖蛋白进行相关性分析,推断其是一种与冷诱导相关的蛋白。经过傅里叶红外光谱检测,推断其二级结构为:α-螺旋:25.96%~26.52%,β-折叠:21.69%~23.78%,β-转角:35.31%~37.61%,无规卷曲:13.69%~15.08%。
[1]Griffith M A P,Yang D S C.Antifreeze protein produced endogenously in winter rye leaves[J].Plant Physiol,1992,100(2):593-596.
[2]Sun X,Griffith M,Pasternak J,et al.Low temperature growth,freezing survival,and production of antifreeze protein by the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J].Canadian Journal of Microbiology,1995,41(9):776-784.
[3]张晖,张艳杰,王立,等.抗冻蛋白在食品工业中的应用现状及前景[J].食品与生物技术学报,2012,31(9):897-903.
[4]张超,赵晓燕,马越,等.冬小麦麸皮抗冻蛋白的筛选及其分离纯化[J].中国粮油学报,2009,24(5):16-20.
[5]陈廷超,张极震,叶文.差示扫描量热法直接测定沙冬青抗冻蛋白的热滞效应[J].生物物理学报,1996,12(1):39-42.
[6]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[7]Chou K-C.Prediction of protein structural classes and subcellular locations[J].Current Protein and Peptide Science,2000,1(2):171-208.
[8]Jia C,Huang W,Wu C,et al.Characterization and yeast cryoprotectiveperformanceforthermostableice-structuring proteins from Chinese Privet(Ligustrum Vulgare)leaves[J].Food Research International,2012,49(1):280-284.
[9]Duman J G.Purification and characterization of a thermal hysteresisproteinfromaplant,thebittersweetnightshade Solanum dulcamara[J].Biochimicaet Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1994,1206(1):129-135.
[10]Chao Z,Hui Z,Li W,et al.Effect of carrot(Daucus carota)antifreeze proteins on texture properties of frozen dough and volatilecompoundsofcrumb[J].LWT-FoodScienceand Technology,2008,41(6):1029-1036.
[11]Deng G,Andrews D W,Laursen R A.Amino acid sequence of a new type of antifreeze protein,from the longhorn sculpin Myoxocephalus octodecimspinosis[J].FEBS Letters,1997,402(1):17-20.
[12]Graham L A,Liou Y-C,Walker V K,et al.Hyperactive antifreeze protein from beetles[J].Nature,1997,388(6644):727-728.
[13]Worrall D,Elias L,Ashford D,et al.A carrot leucine-richrepeat protein that inhibits ice recrystallization[J].Science,1998,282(5386):115-117.
[14]Gualberto J M,Bonnard G,Lamattina L,et al.Expression of the wheat mitochondrial nad3-rps12 transcription unit:correlation between editing and mRNA maturation[J].The Plant Cell Online,1991,3(10):1109-1120.
[15]曹栋,史苏佳,张永刚,等.酰胺Ⅰ带和酰胺Ⅲ带测定花生磷脂酶D的α-螺旋和β-折叠含量[J].化学通报,2008,71(11):877-880.
[16]谢孟峡,刘媛.红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J].高等学校化学学报,2003,24(2):226-231.
[17]Arrondo J L R,Muga A,Castresana J,et al.Quantitative studies of the structure of proteins in solution by Fouriertransform infrared spectroscopy[J].Progress in biophysics and molecular biology,1993,59(1):23-56.
[18]Sundaraganesan N,Ilakiamani S,Saleem H,et al.FTRaman and FT-IR spectra,vibrational assignments and density functional studies of 5-bromo-2-nitropyridine[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2005,61(13):2995-3001.
Purification and physical-chemical characteristic of a novel antifreeze protein from wheat bran(wbAFP)
JIN Zhou-yun,LIU Bao-lin*
(Institute of Biothermal Science and Technology,School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China)
A novel antifreeze protein from wheat bran(wbAFP)was purified and the amino acid composition and the secondary structure were studied.This AFP was purified by four steps:crude extracted,ammonium sulfate precipitation,anion-exchange chromatography on a DEAE-cellulose-26 column,and size-exclusion chromatography on a Sephadex G75 column.As a result,wbAFP was purified 449.99 fold,yielding a productivity of 4.17%.The molecular weight was 11.2 ku and the thermal hysteresis activity(THA)was 0.169℃ at a concentration of 5 mg/mL.The result of amino acid composition of wbAFP showed that it was glycine-rich(52.08 mol%)and had a relatively high hydrophilicity.Compared with several common antifreeze glycoproteins(AFGPs)it was inferred that wbAFP was related with cold-inducible protein.The secondary structure was determined by FT-IR spectra.The results were summarized as α-helix of 25.96%~26.52%,β-sheet of 21.69%~23.78%,β-turn of 35.31%~37.61%and random coil of 13.69%~15.08%.
antifreeze protein;purification;thermal hysteresis activity;amino acid composition;secondary structure
TS210.1
A
1002-0306(2015)20-0159-06
10.13386/j.issn1002-0306.2015.20.025
2015-01-20
金周筠(1990-),女,硕士研究生,研究方向:食品冷冻冷藏,E-mail:frances900703@gmail.com。
刘宝林(1968-),男,博士,教授,主要从事低温生物医学技术方面的研究,E-mail:blliuk@163.com。
上海市东方学者跟踪计划。

