一株绿色素产生菌的筛选及鉴定
左 勇,傅 彬,叶碧霞,江 鹏,王小龙,杨小龙(四川理工学院生物工程学院,四川自贡643000)
一株绿色素产生菌的筛选及鉴定
左勇,傅彬,叶碧霞,江鹏,王小龙,杨小龙
(四川理工学院生物工程学院,四川自贡643000)
目的:从土壤中筛选绿色素产生菌株并对该菌株进行鉴定。方法:采用平板法分离产绿色素菌株,利用形态、生理生化及分子生物学的方法对菌株进行菌种鉴定。结果:从四川理工学院校园土壤中分离得到一株产绿色素的放线菌t9,在高氏一号培养基上,气生菌丝为灰白色,基内菌丝为绿色。该菌株基因序列与鼠灰链霉菌Streptomyces_murinus_NBRC_12799(T)相似度为99%,以Neighbor-Joining(N-J)法构建的系统发育树。结论:菌株t9的16S rDNA序列分析结果结合形态学特征及生理生化鉴定,确定该菌株为鼠灰链霉菌属(Streptomyces_murinu),并将其命名为Streptomyces_murinus t9。
绿色素,链霉菌,筛选
天然色素因其色泽自然、无毒、安全性高的特点,逐渐取代合成色素[1-3]。天然色素主要来自于植物组织、动物、矿物质及微生物。与植物、动物及矿物色素相比,微生物色素具有提取成本低、原料不受季节和气候限制的优势。相关文献报道[4-7],有些微生物色素不但可以作为食品添加剂,同时还具有抗癌的作用,如灵菌红色素、紫色杆菌素、放线紫红素等,因此开发微生物色素具有广阔的市场前景和研究价值。
目前,有关文献[8-12]对微生物产蓝色素、红色素、黄色素的报道较多,但对通过微生物发酵生产绿色素的报道却较少。因此,绿色素产生菌株的筛选及绿色素具有重要的研究价值。
本研究拟从不同土壤中进行菌株筛选,通过分离纯化,得到产绿色素菌株,然后进行培养,分别采用形态学特性,生理生化特性以及分子生物学方法对其中产绿色素的菌株进行鉴定,以期为生产绿色素的研究提供一定的指导。
1 材料与方法
1.1材料与仪器
泥土来源土样取自四川理工学院校园土壤(干燥的砂质土壤);rTaq酶、dNTPmixture、10×Pcrbuffer(free Mg2+)、MgCl2(25 mmol/L)、引物16F27/16R1492均购于TaKaRa公司;高氏一号培养基,察氏培养基,克氏培养基,甘油天门冬素培养基,燕麦营培养基,养琼脂培养基。
D3024台式高速微量(冷冻型)离心机大龙创新实验仪器(北京)有限公司;BD-30生物显微镜深圳市博视达光学仪器有限公司;GZ-250-HSH恒温恒湿培养箱韶关市广智科技设备有限公司。
1.2实验方法
1.2.1培养基的配制选择培养基:可溶性淀粉20 g,KNO31.5 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,K2HPO40.5 g,FeSO4·7H2O 0.01 g,K2Cr2O70.05 g,蒸馏水1 L,pH为7.2。碳源利用培养基[13]:各种碳源浓度均为1%。鉴定培养基:链霉菌标准培养基[13]。
1.2.2菌株的分离称取10 g土样(土样采集后自然条件下放置1 d)加入到盛有90 mL(含1 g无水CaCO3)无菌蒸馏水的250 mL三角瓶中(放入适量玻璃珠),在150 r/min、30℃条件下振荡30 min,静置10 min后取1 mL上清液依次进行10-1、10-2、10-3、10-4、10-5稀释,各取100 μL样液涂布在平板上,同时做平行和空白对照,然后在28℃恒温条件下倒置培养5 d。挑取产绿色素的菌落(待其产生孢子后挑取孢子),接种到高氏一号平板上进行划线分离。将菌株多次纯化后挑取单菌落接种到斜面上,4℃保藏。
1.2.3形态特征将筛选得到的菌株采用划线的方式接种到高氏一号培养基上,28℃插片培养3、5、7、15 d后,通过光学显微镜分别观察气生菌丝及基内菌丝发育情况。
1.2.4培养特性[13]将菌株分别接种到高氏一号、察氏、克氏、甘油天门冬素、燕麦、营养琼脂、无机盐琼脂、酵母膏麦芽膏、土豆块培养基上,28℃培养7、14、21、28 d后分别观察并记录气生菌丝,基内菌丝,可溶性色素以及生长情况。
1.2.5生理生化特性参照文献[13-16]进行生理生化特性鉴定,包括明胶液化、硝酸盐还原、纤维素水解、产H2S、酪氨酸酶、淀粉水解实验以及不同碳源的利用情况等。
1.2.6菌株DNA的提取、扩增及系统发育树分析
1.2.6.1链霉菌总DNA的提取菌株总DNA提取方法参照文献[17]。
1.2.6.216S rDNA扩增扩增引物1(27 F):AGAGTT TGATCCTGGCTCAG;引物2(1492R):GGTTACCTTG TTACGACTT。PCR反应体系(50 μL体系):模板DNA 2μL,10×Pcrbuffer(free Mg2+),MgCl2(25 μmol/L)4 μL,引物(10 μmol/L)各0.5 μL,dNTP(2.5 μmol/L)4 μL,Taq DNA聚合酶0.5 μL(5 U/μL),加ddH2O 35 μL。PCR反应条件为:94℃预变性5 min,94℃变性1 min,55℃复性1 min,72℃延伸1.5 min,35个循环,最后72℃温育10 min。PCR产物经1%琼脂糖凝胶电泳检测后,送至上海杰李生物有限公司进行克隆测序。将测得的基因序列去除掉杂峰的部分后拼接,在NCBI上进行Blast比对,筛选相似度较高(>97%)的16S rDNA序列,采用Neighbor-Joining(NJ)法构建系统发育树,使用ClustalX软件进行序列比对,MEGA5.05绘制发育树。
2 结果及分析
2.1菌株分离结果
通过平板法从采集的75个土样中筛选得到5株色素产生菌,分别命名为t8、t9、t10、t11、t12,结果见图1。
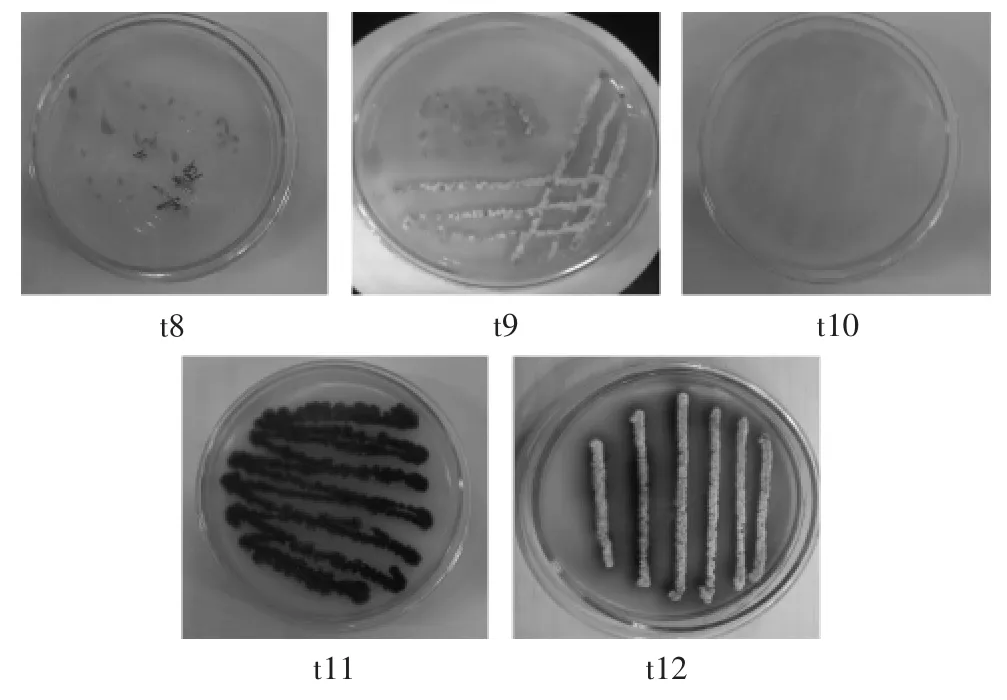
图1 色素产生菌株的固态培养特征Fig.1 The cultural characteristics of the bacteria produced pigment
2.2菌株的鉴定
2.2.1形态学特征将菌株t9通过划线的方法接种到高氏一号培养基上,培养5 d,观察菌落形态后,再采用插片法培养7 d,通过显微镜观察菌丝形态,结果见图2。
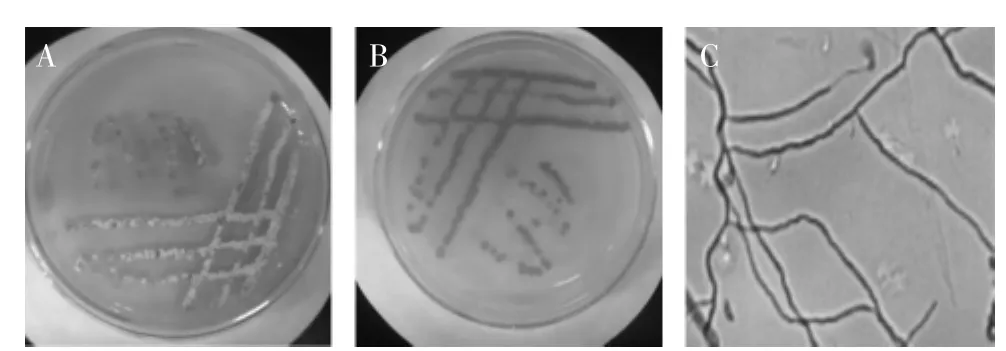
图2 链霉菌t9形态学特征Fig.2 The morphological of Streptomyces sp.t9
在高氏一号培养基中,28℃培养5 d后,观察到菌落较厚,有褶皱,孢子堆为灰白色。气生菌丝初为白色,后深灰色,生孢子,基内菌丝呈绿色。插片培养7 d后镜检观察气生菌丝直或弯曲,初为白色后为青色,末端有孢子丝,直或弯曲,孢子为圆形至椭圆形。通过形态学特征可以初步判定该菌株可能为链霉菌属。
2.2.2菌株t9在不同培养基上的培养特征将菌株t9接种到高氏一号、察氏、克氏、甘油天门冬素、燕麦、营养琼脂等培养基上,28℃培养7、14、21、28 d后分别观察并记录气生菌丝,基内菌丝,可溶性色素以及生长情况,其培养特征见表1。
由表1可知,菌株t9在高氏一号培养基上,气生菌丝为灰白色,基内菌丝初为黄色后为绿色,产绿色可溶性色素。在甘油天门冬素、燕麦琼脂、无机盐琼脂以及酵母膏麦芽膏琼脂培养基上均无可溶性色素产生。该菌株的培养特征结果与鼠灰链霉菌的培养特征一致,初步确定该菌株为鼠灰链霉菌属。
2.2.3生理生化特性实验将菌株t9接种到碳源利用培养基上,28℃培养7 d观察生长情况,其结果见表2。

表1 菌株t9培养特征Table 1 The cultural characteristics of t9
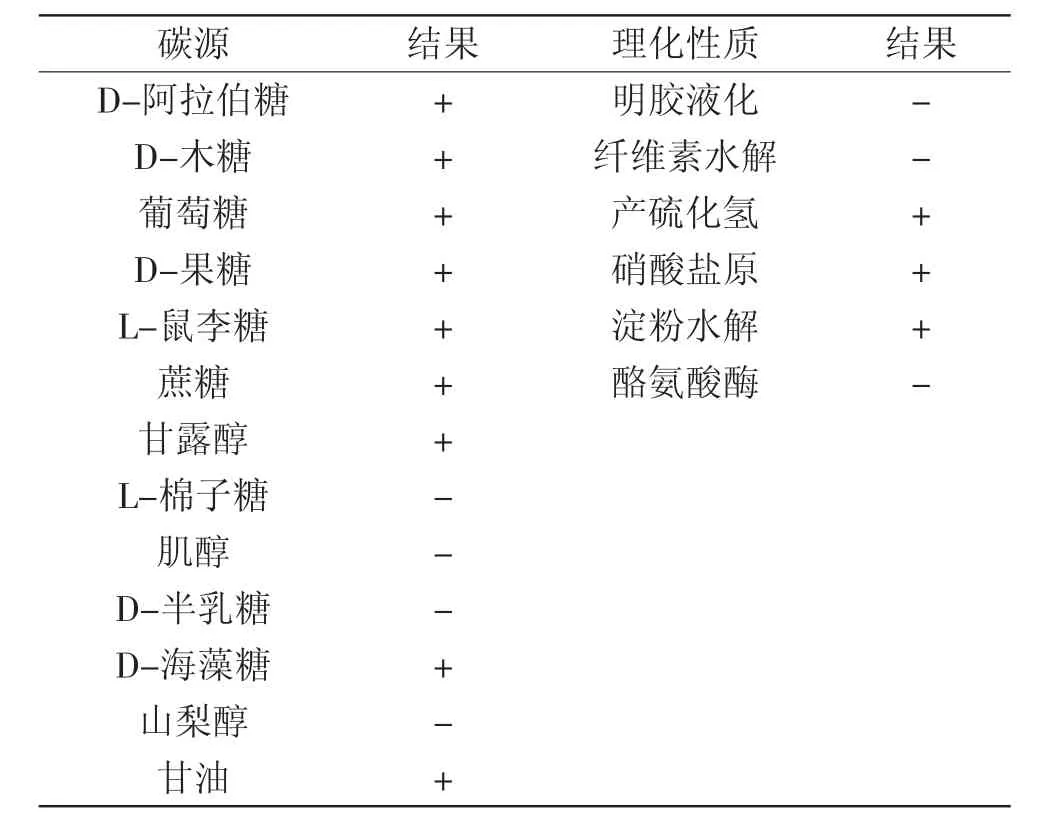
表2 菌株t9碳源利用和生理生化特征Table 2 Utilization of carbon sources and their physiological and biochemical characteristics of the strain t9
由表2可知,该菌株能降解淀粉,能使硝酸盐还原,能产生H2S,不能降解纤维素且不能使明胶液化。碳源利用结果表明,该菌株能很好的利用D-阿拉伯糖、葡萄糖、蔗糖、D-果糖、L-鼠李糖、甘油、D-海藻糖等大多数糖类,不能利用山梨醇、肌醇以及L-棉子糖等。通过菌株t9的碳源利用情况及生理生化实验结果可确定该菌株为鼠灰链霉菌。
2.2.4菌株16S rDNA扩增以菌株t9的总DNA为模板,27F/1492R为引物进行基因扩增并做阴性及阳性对照。结果见图3。
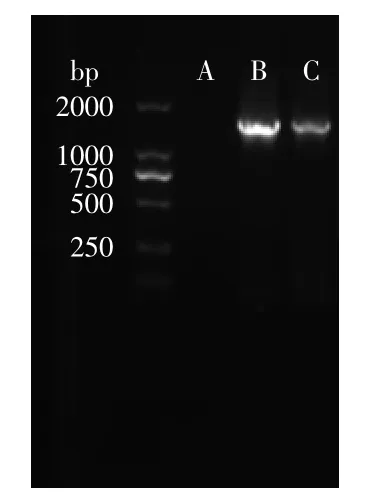
图3PCR扩增产物电泳图Fig.3 The electrophoresis of PCR products
由图3可知,菌株t9的16S rDNA扩增后得到的DNA序列长度在1500 bp左右,阴性及阳性对照结果表明扩增正常。
2.2.5系统发育树的构建菌株t9的16SrDNA测序后,结果在NCBI上进行Blast同源性比对,比对结果显示与Streptomyces_murinus_NBRC_12799(T)相似度为99%,并在Genbank上登陆注册,登陆号为KP231174。根据比对结果筛选出相似度较高(>97%)的16SrDNA序列,采用Clustal软件进行序列比对,采用Neighbor-Joining(N-J)法利用MAGE5.05软件绘制系统发育树,结果见图4。

图4 采用Neighbor-Joining(NJ)法构建的16S rDNA系统进化树Fig.4 Phylogenetic tree drawn from neighbor-joining analysis based on the 16S rDNA sequence alignment
由图4可知,菌株t9与Streptomyces_murinus_ NBRC_12799(T)处于同一聚类分支上,菌株t9属于鼠灰链霉菌属。
3 结论
从土壤中分离得到一株产绿色素的放线菌t9,通过对其形态学观察、生理生化及分子生物学鉴定,确定该菌株为鼠灰链霉菌(Streptomyces_murinus),该菌株能够产生两种绿色素,胞外为黄绿色素,胞内为色泽纯正的绿色素。对于其产生的绿色素的性质及安全性还有待进一步研究。
[1]李崇瑛,王安,杨涛,等.食用天然色素的纯化与研究进展[J].中国调味品,2007(9):18-22.
[2]邓祥元,王淑军,李富超,等.天然色素的资源和应用[J].中国调味品,2006(10):49-53.
[3]卢雪华,成坚,白卫东,等.我国食用色素工业的现状及对策[J].中国调味品,2010,35(5):35-39.
[4]毛得奖,朱亚玲.我国天然蓝色素研究现状[J].中国调味品,2011,36(10):109-114.
[5]王海胜,张晓霞.紫色杆菌素研究进展[J].化工进展,2008,27(3):315-321.
[6]李洪波,杜巍.灵菌红素究进展[J].生物技术通讯,2011,22(1):139-142.
[7]段学,辉傅,奇魏斌,等.一株灵菌红素产生菌的分离及其色素分析[J].安徽农业科学,2011,39(9):5064-6062.
[8]邓祥元,王淑军,侯竹美,等.海洋链霉菌M259高产蓝色素理化性质研究[J].食品科学,2006(7):35-39.
[9]张志东,楚敏,唐琦勇,等.一株蓝色素产生菌的鉴定及色素特性[J].食品科学,2012(19):236-239.
[10]张爱梅,牛世全,达文燕,等.一株产绿色素放线菌的初步鉴定及其色素稳定性的检测[J].西北师范大学学报:自然科学版,2010(3):89-93.
[11]张晓毅,崔英德,陆宁,等.绿色木霉菌产黄色素液态发酵条件的优化[J].化工学报,2010(12):3205-3212.
[12]王晓磊,荆康明,赵翠兰,等.一株产黄色素海洋细菌的筛选、鉴定及其发酵条件优化[J].资源开发与市场:实验与技术,2013,29(9):897-994.
[13]中国科学院微生物研究所放线菌分类组编著.链霉菌鉴定手册[M].北京:科学出版社,1975.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]R.E.布坎南,N.E.吉本斯等编著.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[16]阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1974.
[17]姜淑梅,张龙,戴世鲲,等.一种简单有效的适于PCR操作的放线菌DNA提取方法[J].生物技术,2007,17(9):39-41.
Isolation and identification of one strain of
stretomyces producing green pigment
ZUO Yong,FU Bin,YE Bi-xia,JIANG Peng,WANG Xiao-long,YANG Xiao-long
(College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China)
Objective:In order to isolation and identification of strain of producing green pigment.Methods:The microbial strains of producing pigment were isolated from soil by method with plate coating,biochemical and morphological characteristics and 16S rDNA gene sequence analysation.Results:An actinomycete,named t9,was isolated from a soil sample in the College of Bioengineering,Sichuan University of Science and Engineering. It produced grayish-white aerial mycelium and green substrate mycelium on Gause’s synthetic agar.The results showed that the 16S rDNA gene sequence of the train t9 shared the identity 99%with that of Streptomyces_murinus_NBRC_12799(T),the phylogenetic tree was derived with NJ.Conclusion:The strain t9 was identified as Streptomyces_murinus from its morphological andcultural characteristics and the 16S rDNA gene sequence.
green pigments;streptomyces;screening
TS201.1
A
1002-0306(2015)20-0188-04
10.13386/j.issn1002-0306.2015.20.031
2014-12-19
左勇(1972-),男,硕士,教授,主要从事发酵工程方面的研究,E-mail:sgzuoyong@tom.com。
四川省教育厅成果转化项目(11ZZ016)。

