产β-葡萄糖苷酶酿酒酵母菌株紫外诱变选育及酶学性质分析
张 莉,王 婧,杨 婷,马腾臻,程 超,祝 霞,盛文军,韩舜愈(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃兰州730070)
产β-葡萄糖苷酶酿酒酵母菌株紫外诱变选育及酶学性质分析
张莉,王婧,杨婷,马腾臻,程超,祝霞,盛文军,韩舜愈
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃兰州730070)
为了得到高产胞外β-葡萄糖苷酶的酿酒酵母(Saccharomycaes cerevisiae)菌株,采用紫外线诱变技术对菌株MQFSM-3进行处理,研究了紫外诱变条件对菌株致死率的影响,并对突变菌株酶活及酶学性质进行评价。结果表明,出发菌株在辐照剂量为3500 μJ/cm2的紫外灯下照射9 min,致死率为81.09%;通过初筛、复筛及多次传代培养,突变菌株UV-45产酶稳定,酶活提高41.64%,该酶最适温度为50℃,在20~50℃热稳定性良好;最适pH为5.5,在pH4.0~6.5酶活力相对稳定。
酿酒酵母,紫外诱变,筛选,突变体
葡萄浆果中存在游离态和结合态两大类呈香物质,游离态呈香物质可以直接从葡萄酒中挥发出来,是典型葡萄酒风味的主要来源。结合态呈香物质是不具挥发性、没有芳香气味的糖苷键合态风味前体物质,其含量比游离态的要丰富得多[1],如果得以释放,对葡萄酒品种风味的呈现具有积极意义。β-葡萄糖苷酶(β-glucosidase,BGL,EC 3.2.1.21)是结合态香气释放的关键酶,它可催化水解葡萄糖苷键,同时释放出糖苷配基,能够改善和增强葡萄酒的香气[2]。该酶广泛存在于植物和微生物中,然而,外加酶及果实内源的β-葡萄糖苷酶在典型葡萄酒的低pH、高酒精度、葡萄糖存在和低氧环境中活性很低或受到抑制[3]。微生物来源的β-葡萄糖苷酶受抑制的程度与菌株的种类和特性有关[4],有研究报道表明,利用酿酒酵母(Saccharomycaes cerevisiae)产生的β-葡萄糖苷酶是提高葡萄酒香气的有效方法[5]。但在发酵中,酿酒酵母释放的β-葡萄糖苷酶活性较低。因此提高酵母菌株产β-葡萄糖苷酶活力是提高葡萄酒香气的重要研究方向之一。
诱变育种是用人工诱变的方法诱发微生物基因突变,通过随机筛选,筛选出产量高、性能优良的突变体。其中紫外辐照作为物理诱变因子应用于工业微生物菌种的诱变选育具有悠久的历史,紫外辐照设备简单,操作简便,效果明显,是微生物菌种诱变选育的首选诱变因子[6]。
据文献报道,酵母菌株对紫外辐照处理敏感性较强,张陈云等[7]利用紫外诱变技术得到了一株发酵性能较好的酿酒酵母菌株。李杨等[8]利用紫外线与亚硝基胍复合诱变技术处理酿酒酵母原生质体,得到一株高产酒精的突变菌株。Ruchi等[9]利用化学与物理复合诱变技术处理枯草芽孢杆菌,使其产β-葡萄糖苷酶活性提高1.2倍。但是,系统研究紫外线辐照诱变技术在提高酵母产β-葡萄糖苷酶的应用报道较少。
本研究以实验室保存的野生酿酒酵母菌株为出发菌,通过紫外诱变处理,分析其产生β-葡萄糖苷酶的条件参数及酶学特性,旨在选育出高产β-葡萄糖苷酶的突变菌株,为葡萄酒酿造提供优良的生产菌株。
1 材料与方法
1.1材料与仪器
酿酒酵母菌株(Saccharomycescerevisiae)MQFSM-3由甘肃省葡萄与葡萄酒工程学重点实验室分离保存[10];对硝基苯-β-D-葡萄糖苷(p-NPG)
Sigma公司;对硝基苯酚(p-NP) 天津市凯信化学工业有限公司;酵母膏、蛋白胨、葡萄糖、琼脂等均为国产分析纯。
CL-1000紫外交联机美国UVP公司;湘仪高速冷冻离心机长沙湘仪离心机仪器有限公司;紫外-可见分光光度计Thermo Fisher scientific公司;SWCJ-2FD型超净工作台苏州安泰空气技术有限公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器上海申安医疗器械厂。
1.2实验方法
1.2.1培养基配制YPD液体培养基:酵母浸膏1.0%,蛋白胨2.0%,葡萄糖2.0%,自然pH,121℃灭菌20 min;YEPD固体培养基:酵母浸膏1.0%,蛋白胨2.0%,葡萄糖2.0%,琼脂2.0%,自然pH,121℃灭菌20 min,温度降至70℃左右,加入60 μg/mL链霉素;发酵培养基[11]:酵母浸膏1.0%,蛋白胨2.0%,葡萄糖2.0%,NH4NO30.3%,KH2PO40.4%;初筛培养基[10]:马铃薯20 g/L,葡萄糖20 g/L,琼脂20 g/L,自然pH,121℃灭菌20 min,在温度降到60~70℃左右加入1 g/L p-NPG。
1.2.2原菌株活化培养将出发菌株MQFSM-3接种一环于YEPD斜面培养基上,28℃培养24 h后,接入50 mL YPD液体培养基中28℃,160 r/min扩增培养48 h。将活化好的酵母菌按5%的接种量转入20 mL YPD液体培养基中,28℃,160 r/min振荡扩增培养48 h。
1.2.3生长曲线绘制取17个50 mL三角瓶,分别装入20 mL YPD液体培养基灭菌备用。将菌株MQFSM-3扩增培养液按5%接种量分别接入,并于28℃,160 r/min培养,每隔4 h取样。以不接菌的YPD液体培养基为空白对照,在OD600下测吸光度值,绘制菌株生长曲线[12]。
1.2.4菌株紫外线诱变及筛选取对数生长期的培养液,8000 r/min离心10 min收集酵母菌体,并以适量无菌生理盐水洗涤2次。将酵母菌体悬浮于无菌生理盐水中,并以无菌生理盐水进行10倍系列逐级稀释,然后配成105~108cfu/mL的菌悬液。
1.2.4.1不同紫外照射剂量处理将菌悬液置于无菌培养皿中,放置在紫外交联机中,于不同照射剂量(1000、1500、2000、2500、3000、3500、4000、4500、5000 μJ/cm2)下照射7 min,取样5 mL,冰浴30 min并暗处放置4 h,之后梯度稀释取10-4、10-5、10-6稀释度菌悬液涂布于YPD固体培养基上,30℃避光培养48 h,以上所有操作须在红光下进行[13],以没有做诱变处理的涂布平板作为对照,计算菌落数及紫外诱变致死率[9]。
致死率计算公式如下:

1.2.4.2不同紫外照射时间处理将菌悬液置于无菌培养皿中,放置在紫外诱变箱中,于3500 μJ/cm2的照射剂量下分别照射1、3、5、7、9、11、13、15、17、19、21、23 min后,取样5 mL,其他操作同1.2.4.1,计算菌落数及紫外诱变致死率。
1.2.4.3突变菌株筛选初筛:将最佳诱变条件下的单菌落,挑入以p-NPG为底物的96孔板初筛培养基上,28℃培养3 d后,喷洒1 mol/L Na2CO3,观察显色情况,并挑选明显呈黄色的菌落作为高产菌株进行复筛[2]。复筛:将初筛显色明显的突变菌株接种至发酵培养基中28℃培养72 h,将发酵液于8000 r/min离心10 min后,收集上清液,即粗酶液,用于测定酶活力,筛选出酶活较高的菌株。
1.2.5酶活测定
1.2.5.1标准曲线绘制称取对硝基苯酚139.0 mg,蒸馏水定容至1000 mL,分别吸取1.0、2.0、3.0、4.0、5.0、6.0 mL于100 mL容量瓶中,用1 mol/L Na2CO3溶液定容后混匀。以蒸馏水作为空白,于400 nm处测其吸光值。以对硝基苯酚浓度为横坐标,吸光值为纵坐标,绘制标准曲线[11]。
1.2.5.2酶活测定取0.1 mL粗酶液,加入0.2 mL 40 mmol/L p-NPG(pH5.5的柠檬酸-磷酸盐缓冲液配制)混匀,50℃保温10 min后立即加入2 mL 1 mol/L Na2CO3终止反应并显色,室温放置5 min,于400 nm下测定吸光值。以加热灭活的酶液按照同样处理做空白对照[14-15]。
酶活力计算公式如下:
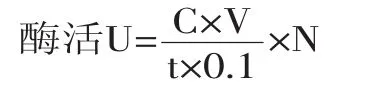
式中:U为酶活力单位,U/mL;C为对硝基苯酚(p-NP)的浓度;V为反应体系的体积;N为原酶液稀释倍数;t为反应时间;0.1为所取上清液或细胞液的体积。
β-葡萄糖苷酶酶活力力单位(U)定义为,在上述反应条件下,1 min内底物被释放出1 μmol的p-NP所需要的酶量[15]。
1.2.6突变菌株产酶稳定性验证对复筛获得的高产β-葡萄糖苷酶突变菌株进行传代培养,连续传代10次,测其β-葡萄糖苷酶酶活,观察产酶稳定性[9]。
1.2.7突变菌株生长曲线将筛选的产酶稳定的突变菌株活化后接种至YPD培养基中,于28℃、160 r/min培养,每隔4 h取样,在OD600下测吸光度值,绘制突变菌株生长曲线。
1.2.8突变菌株β-葡萄糖苷酶粗酶液的酶学性质
1.2.8.1β-葡萄糖苷酶最适温度将粗酶液0.1 mL与0.2 mL pH5.5的p-NPG混合,分别在20、30、40、50、60、70、80℃环境下反应10 min,并测定酶活力[16]。
1.2.8.2β-葡萄糖苷酶的热稳定性将粗酶液分别置于20、30、40、50、60、70、80℃恒温水浴锅中保温60 min,冷却后测定酶活,计算相对酶活力(以4℃保存的原酶液酶活力为100%)[17],评价β-葡萄糖苷酶的热稳定性。
1.2.8.3β-葡萄糖苷酶最适pH将粗酶液0.1 mL分别与0.2 mL pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的p-NPG混和,在50℃下反应10 min[16],测定各组酶活力。
1.2.8.4β-葡萄糖苷酶的pH稳定性在0.8 mL pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的磷酸缓冲液中,分别加入0.2 mL的粗酶液,4℃保温24 h,分别测定剩余酶活力,计算相对酶活力(以加入0.8 mL双蒸水的酶活力为100%)[17],评价β-葡萄糖苷酶的pH稳定性。
1.3数据统计分析
所有平均值数据经过IBM SPSS statistics 18.0软件进行分析,数据以结果±标准差SD表示。
2 结果与分析
2.1对硝基苯酚溶液标准曲线
对硝基苯酚在碱性条件下显黄色,在一定范围内,其浓度与吸光值成正比。如图1所示,对硝基苯酚标准曲线回归方程为:Y=19.957x-0.0087,相关系数R2=0.9970,吸光度与对硝基苯酚含量成线性关系。
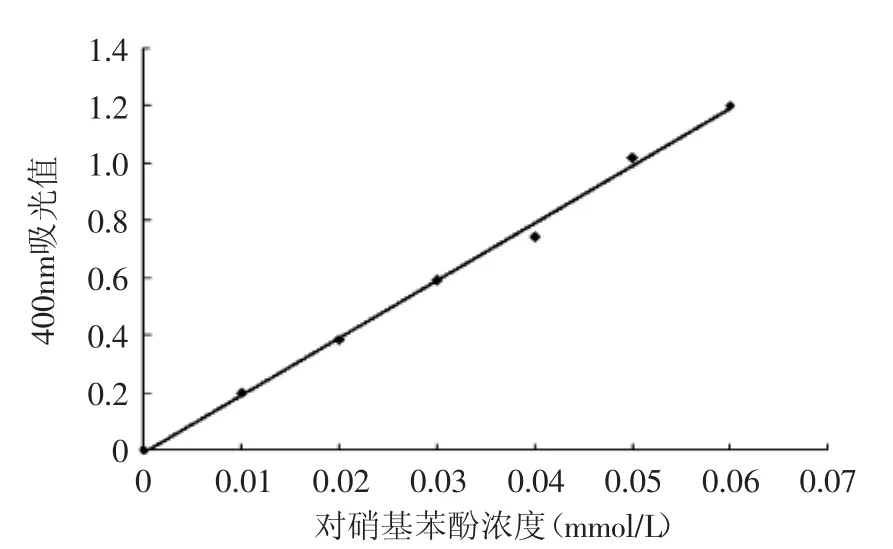
图1 对硝基苯酚溶液标准曲线Fig.1 Standard curve of p-nitrophenol solution
2.2酿酒酵母MQFSM-3生长曲线
酵母MQFSM-3的生长曲线如图2。由图2可知,4~24 h为对数生长期,4 h以后酵母进入对数生长期说明该野生酿酒酵母繁殖迅速。28 h后为稳定期,菌体浓度基本保持不变。由于对数生长期的细胞为生理活性一致的活细胞,突变率高,重现性好[12],因此本实验选择对数生长中期的菌体进行诱变,即选择培养16 h的菌体进行诱变处理。

图2 酵母MQFSM-3生长曲线Fig.2 Growth curves of yeast MQFSC-3
2.3酿酒酵母MQFSM-3紫外诱变
2.3.1不同照射剂量下酵母致死率曲线出发菌株MQFSM-3在不同紫外剂量照射下与致死率的关系如图3所示,MQFSM-3菌株细胞对紫外光非常敏感。随着照射剂量增大,菌株致死率呈上升趋势。据文献报道,紫外诱变的致死率在75%~85%之间时,突变率相对较高[18],获得优良性能菌株的可能性更大[19]。因此选择80%左右的致死率,即诱变剂量为3500 μJ/cm2。

图3 紫外辐照剂量对酵母致死率的影响Fig.3 Effect of radiation dose on lethality of yeast
2.3.2不同照射时间下酵母致死率曲线据文献报道,紫外诱变照射时间不短于10~20 s,不长于10~20 min[20]。紫外辐照时间与致死率的关系如图4所示,MQFSM-3随着照射时间增长,菌株致死率呈上升趋势,在照射9 min时致死率达到了81.09%。
2.4突变菌株筛选
由于p-NPG经β-葡萄糖苷酶水解后的产物p-NP在碱性条件下显黄色[21],因此将其作为反应底物,利用96孔板培养进行菌株初筛,根据颜色深浅来初步判断酶活高低,颜色越深则酶活越高,以此筛选出颜色较深的12株菌株UV-11、UV-12、UV-22、UV-23、UV-24、UV-34、UV-35、UV-36、UV-44、UV-45、UV-46、UV-59。
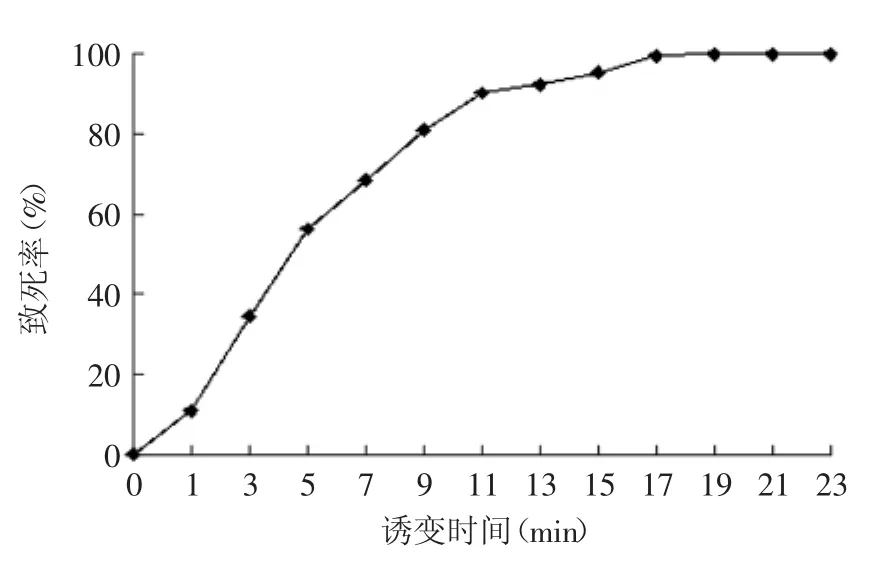
图4 紫外辐照时间对酵母致死率的影响Fig.4 Effect of radiation time on lethality of yeast
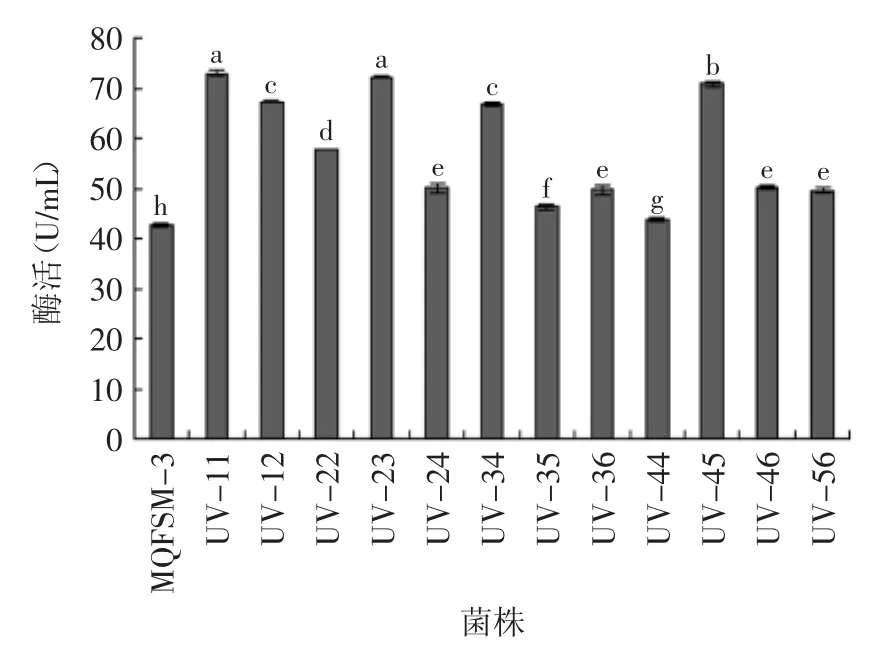
图5 突变体β-葡萄糖苷酶酶活Fig.5 β-glucosidase activity of Mutant
通过对这12株菌摇瓶发酵复筛,所得结果见图5。对12株菌复筛所得的酶活力数据进行方差分析,根据显著性分析,UV-11、UV-12、UV-23、UV-34、UV-45,这5株突变体与出发菌株MQFS M-3酶活力差异显著(p<0.05),分别比出发菌株提高了70.85%、57.54%、69.23%、56.47%、65.82%,说明菌株UV-11、UV-12、UV-23、UV-34、UV-45菌株所产β-葡萄糖苷酶活力比原菌株有明显提高。因此选择这五株突变体进行进一步实验。
2.5突变菌株产酶稳定性研究
将复筛得到的突变菌株UV-11、UV-12、UV-23、UV-34、UV-45经过多次传代后测酶活,结果如图6所示,只有菌株UV-45传代10次后β-葡萄糖苷酶酶活仍保持了85.14%,且传代后比出发菌株MQFSM-3的酶活力提高了41.64%。因此选择UV-45为目标菌株做进一步研究。
2.6MQFSM-3与突变体UV-45生长曲线
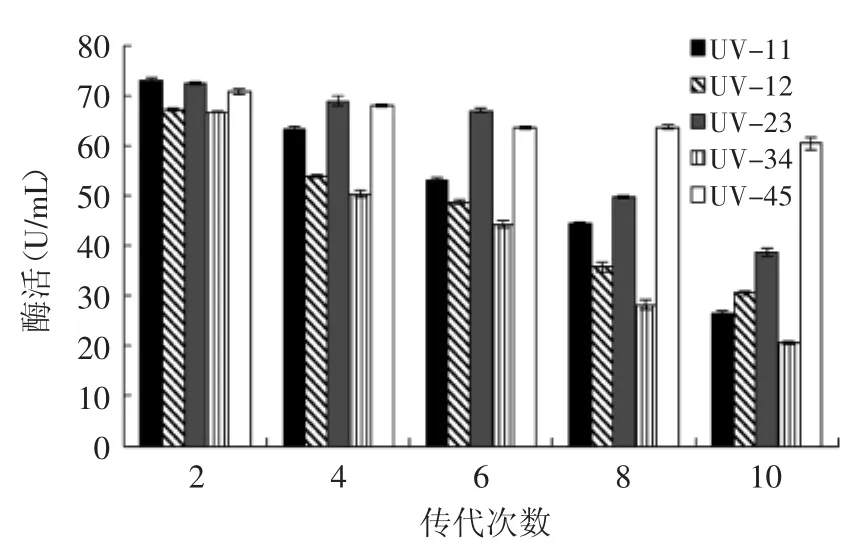
图6 突变体产酶稳定性Fig.6 Stability of Mutant enzyme production

图7MQFSM-3与UV-45生长曲线Fig.7 Growth curves of MQFSM-3 and UV-45
突变菌株与出发菌株MQFSM-3生长曲线比较见图7。由图7可知,突变菌株UV-45生长曲线与出发菌株MQFSM-3基本一致,4~20 h为对数生长期,20 h后进入稳定期,菌体浓度基本保持不变,比出发菌株提前4 h进入稳定期。
2.7突变菌株U-45粗酶液的部分酶学性质分析
2.7.1β-葡萄糖苷酶的最适温度由图8可知,β-葡萄糖苷酶的最适温度约为50℃。温度低于50℃时,酶活力随温度的升高而增大;温度高于50℃时,酶活力随温度的升高而降低。温度为80℃时酶几乎失活。
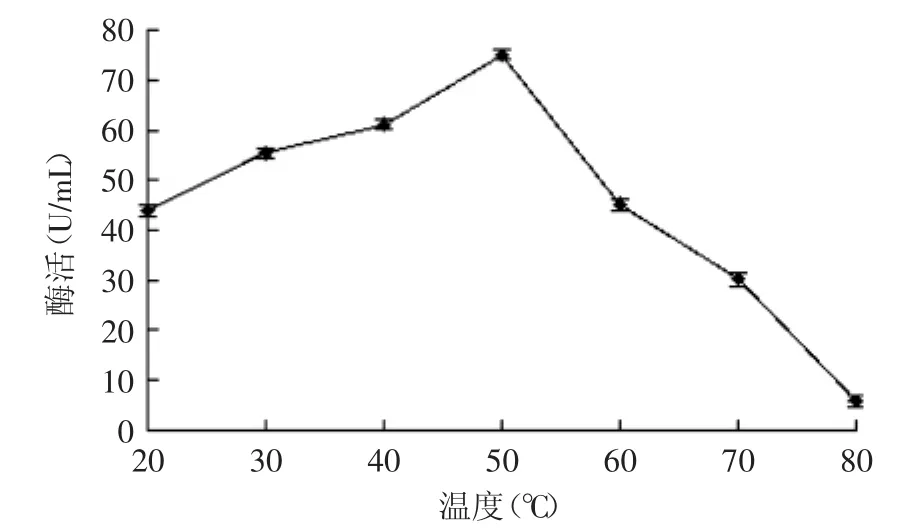
图8 β-葡萄糖苷酶最适温度Fig.8 Optimal reaction temperatury of β-glucosidase
2.7.2β-葡萄糖苷酶热稳定性菌株UV-45 β-葡萄糖苷酶热稳定性实验结果如图9所示,温度在50℃以下时酶的稳定性相对较好,能够保持80%以上的酶活力,当温度超过50℃,酶活力急剧下降。当温度高于60℃时,基本不具备酶活。
2.7.3β-葡萄糖苷酶最适pH由图10可知,β-葡萄糖苷酶的最适pH为5.5,酶活为75.34 U/mL。当pH低于5.5时,酶活力随着pH增高而增加;pH3.0环境下,β-葡萄糖苷酶活力为25.93 U/mL,是pH5.5时酶活的34.42%;当pH高于5.5时,酶活力开始下降;pH8.0环境下酶活力为29.01 U/mL。
2.7.4β-葡萄糖苷酶pH稳定性实验结果如图11所示,β-葡萄糖苷酶在pH4.0~6.5酶活力相对稳定,均在80%以上。当pH低于4时,相对酶活在60%以下;当pH大于6.5时,酶活力急剧下降,并在pH7.5环境下,相对酶活仅为30%。

图9 β-葡萄糖苷酶的热稳定性Fig.9 Thermal stability of β-glucosidase

图10 β-葡萄糖苷酶最适pHFig.10 Optimal pH of β-glucosidase
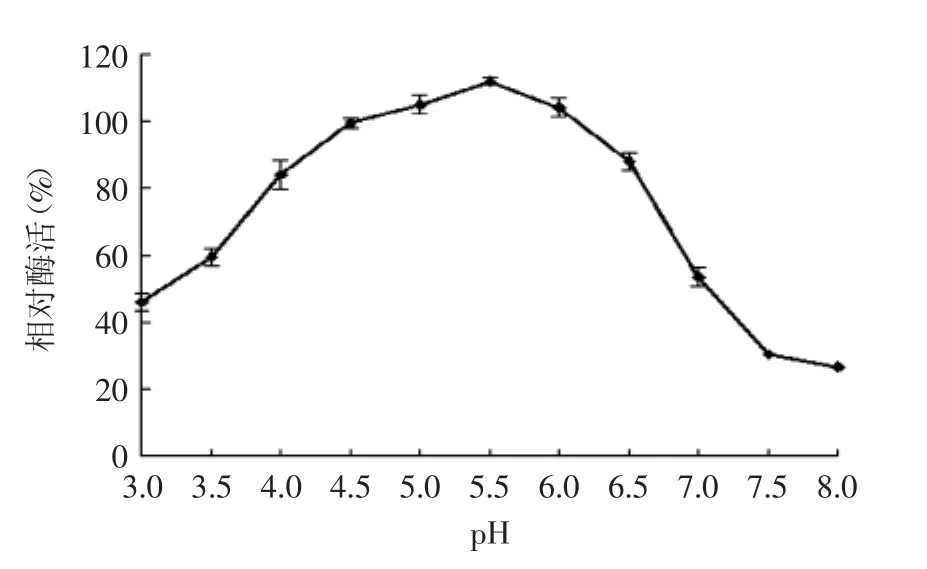
图11 β-葡萄糖苷酶的pH稳定性Fig.11 pH stability of β-glucosidase
3 结论
本文以本实验室保存的一株酿酒酵母MQFSM-3为出发菌株,以紫外照射其对数生长期菌体的方法进行诱变,经显色反应初筛和比色法复筛,得到了突变体UV-11、UV-12、UV-23、UV-34、UV-45,这5株突变体的β-葡萄糖苷酶的酶活较出发菌株有明显提高,并根据产酶稳定性确定UV-45为最优突变体。
动态跟踪了UV-45的生长规律,并研究其粗酶液的酶学性质,研究表明,该酶在20~50℃均具有较高的催化活力,其最适反应温度为50℃;β-葡萄糖苷酶在pH为4.0~6.5之间具有较高的酶活力,并且在pH为5.5时酶活力最高,即最适催化pH为5.5。
[1]王玉霞.阿氏丝孢酵母(Trichosporon asahii)β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D].无锡:江南大学,2012.
[2]郭慧女.β-葡萄糖苷酶生产菌的选育及其对葡萄酒中结合态香气的影响[D].江苏:江南大学,2010.
[3]李平,宛晓春.微生物发酵生产β-葡萄糖苷酶[J].安徽农业大学学报,2000,27(2):196-198.
[4]葛有辉,王德良,曹健.富含β-葡萄糖苷酶的酒香酵母在酿酒领域中的应用[J].酿酒科技,2011(2):96-99.
[5]何芒芒.柑橘中糖苷香气前体物质及β-葡萄糖苷酶活性变化相关性研究[D].武汉:华中农业大学,2013.
[6]赵杰祥,杨荣玲,肖更生.桑葚果酒酵母的诱变选育研究[J].食品科技,2007,32(2):33-37.
[7]张陈云,刘金福,何新益.冬枣果酒酵母的紫外诱变选育研究[J].酿酒科技,2010(2):31-34.
[8]李杨,李雷,任永利.耐酸酒精酵母的诱变选育研究[J].酿酒科技,2013,40(6):65-68.
[9]Ruchi Agrawal,Alok Satlewal,Ashok Kumar Verma. Development of a β-glucosidase hyperproducing mutant by combined chemical and UV mutagenesis[J].Original Article 3 Biotech,2013,3:381-388.
[10]侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[11]李庆华.高产β-葡萄糖苷酶酿酒酵母的筛选及其发酵特性的研究[D].西安:西北农林科技大学,2009.
[12]李新社,陆步诗,邓孟桥,等.紫外诱变皮状丝孢酵母选育高产油脂菌株[J].中南大学学报,2011,42(3):617-622.
[13]Xiaoru Hou,Shuo Yao.Improved inhibitor tolerance in xylose-fermenting yeast Spathaspora passalidarum by mutagenesis and protoplast fusion[J].Applied microbial and cell physiology,2012,93:2591-2601.
[14]Gao Juan,Xuesong Zhao,Haibo Liu.A highly selective ginsenoside Rb1-hydrolyzing β-D-glucosidase from Cladosporium fulvum[J].Process Biochemistry,2010,45(6):897-903.
[15]马腾臻,杨学山,张莉,等.红佳酿酵母β-葡萄糖苷酶活性测定及产酶特性[J].食品与发酵工业,2014,40(10):47-52.
[16]陈静,郝伟伟,王春梅,等.产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析[J].食品科学,2013,34(5):191-196.
[17]祝霞,盛文军,杨学山,等.红佳酿酵母β-葡萄糖苷酶的分离纯化及酶学性质[J].食品科学,2014,35(13):147-150.
[18]涔沛林,蔡谨.工业微生物[M].北京:化学工业出版社,2000:226-227.
[19]夏艳秋,朱强,汪志君,等.耐受性黄酒酵母YS6.2.5的选育及初步应用[J].食品科学,2010,31(23):228-232.
[20]周德庆.微生物实验教程[M].北京:高等教育出版社,2006:216.
[21]李庆华,刘树文.产β-糖苷酶菌株的筛选及酶活的研究[J].中国酿造,2009,27(6):68-71.
UV mutation of production Saccharomyces cerevisiae strain of β-glucosidase and its enzyme characteristics
ZHANG Li,WANG Jing,YANG Ting,MA Teng-zhen,CHENG Chao,ZHU Xia,SHENG Wen-jun,HAN Shun-yu
(College of Food Science and Engineering,Gansu Agricultural University,Gansu Key Lab of Viticulture and Enology,Research and Development Center of Wine Industry Technology in Gansu Province,Lanzhou 730070,China)
In order to screen a high extracellular β-glucosidase producing mutant strain of Saccharomycaes cerevisiae,the method of UV mutation was used on wild yeast of MQFSM-3.Death rate affected by UV mutagenesis conditions were determined,enzyme activity and enzymatic characteristics of mutant strain were also evaluated.The results showed that the dose of 3500 μJ/cm2,irradiation 9 min,mortality reached 81.09%. By preliminary screening,rescreening and subculturing for many times,a stable enzyme production of mutant UV-45 was obtained.Compared with the original strain,its enzyme activity was improved 41.64%.The enzymatic characteristics were analyzed that the optimum temperature of UV-45 was 50℃,and it had a good thermal stability between 20~50℃.The optimum pH was 5.5,and between pH4.0 to 6.5,the enzyme activity was relatively stable.
Saccharomycaes cerevisiae;UV mutagenesis;select;mutant
TS201.1
A
1002-0306(2015)20-0220-05
10.13386/j.issn1002-0306.2015.20.038
2015-03-16
张莉(1987-),女,硕士,研究方向:酿酒微生物,E-mail:15117115362@163.com。
韩舜愈(1963-),男,博士,教授,研究方向:果蔬加工及葡萄酒酿造,E-mail:gsndhsy@163.com。
国家自然科学基金资助项目(31160310);甘肃省农业生物技术专项(GNSW-2013-16);甘肃省青年科学基金(1208RJYA082)。

