γ-氨基丁酸对DEHP染毒大鼠焦虑行为的干预研究
刘 辉,郭佑廷,黄少文,杨 婕,杨童旺,孙远明,*,柳春红,*(.华南农业大学食品学院,广东省食品质量安全重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室,广东广州50642;2.广东产品质量监督检验研究院,广东佛山528300)
γ-氨基丁酸对DEHP染毒大鼠焦虑行为的干预研究
刘辉1,2,郭佑廷1,黄少文1,杨婕1,杨童旺1,孙远明1,*,柳春红1,*
(1.华南农业大学食品学院,广东省食品质量安全重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室,广东广州510642;2.广东产品质量监督检验研究院,广东佛山528300)
目的:研究γ-氨基丁酸(GABA)对邻苯二甲酸二(2-乙基己基)酯(DEHP)染毒大鼠焦虑行为的影响。方法:将30只雄性SD大鼠随机分为5组:对照组(C)、DEHP组(500 mg/kg)、GABA低、中、高剂量干预组(L组:500 mg/kg DEHP+ 1 mg/kg GABA、M组:500 mg/kg DEHP+2 mg/kg GABA、H组:500 mg/kg DEHP+4 mg/kg GABA),连续干预30 d。利用高架十字迷宫(EPM)测定干预前后大鼠行为变化,随后测定大鼠额叶皮质五羟色胺(5-HT)、去甲肾上腺素(NE)的水平。结果:干预前各组大鼠EPM指标无显著性差异(p>0.05);干预后H组和C组总食物利用率显著高于DEHP组(p<0.05);干预后各组大鼠入臂总次数无显著性差异(p>0.05),DEHP组大鼠开臂时间百分比、开臂次数百分比均极显著低于对照组(p<0.01),M组和H组开臂时间百分比及开臂次数百分比均显著高于DEHP组(p<0.05);DEHP组5-HT和NE均显著高于C组(p<0.05),M组5-HT及NE均显著低于DEHP组(p<0.05),H组5-HT及NE均极显著低于DEHP组(p<0.01)。结论:DEHP可能通过升高额叶皮质5-HT、NE水平造成大鼠焦虑,GABA可以通过降低额叶皮质5-HT、NE水平起到改善焦虑的作用。
γ-氨基丁酸,邻苯二甲酸二(2-乙基己基)酯,焦虑,五羟色胺,去甲肾上腺素
邻苯二甲酸二(2-乙基己基)酯(DEHP)是邻苯二甲酸酯类中最常用的一种增塑剂,每年生产量高达400万吨[1],被广泛用于塑料、合成橡胶、涂料、黏合剂、化工合成、食品包装盒、医疗用具等领域[2]。DEHP广泛使用的同时也带来一定的危害,研究表明DEHP具有生殖毒性、发育毒性、免疫毒性以及神经毒性等[3-6]。目前针对DEHP毒性的干预研究较少,尤其是神经毒性的干预研究更少。
γ-氨基丁酸(GABA)作为一种非蛋白质天然氨基酸,广泛分布在动物、植物和微生物体中,作为哺乳动物中枢神经系统(CNS)重要的抑制性神经递质,具有降血压、改善肾功能和镇静等生理作用[7],研究表明GABA能够改善焦虑情绪[8-9]。五羟色胺(5-HT)和去甲肾上腺素(NE)是CNS重要的单胺类神经递质,与情绪密切相关[10-12],同时,由于额叶皮质与情绪关系密切[13],因此,本项目将结合大鼠额叶皮质5-HT及NE水平的变化研究DEHP对大鼠焦虑行为的影响,并探讨GABA能否改善由DEHP引起的神经毒性,为富含GABA的食物及保健品开发提供参考。
1 材料与方法
1.1材料与仪器
DEHP(纯度≥99.5%)、GABA(纯度>99%) 美国Sigma公司;大鼠5-HT ELISA试剂盒、大鼠NE ELISA试剂盒上海江莱生物科技有限公司;考马斯亮蓝试剂盒南京建成生物工程研究所;SPF级雄性SD大鼠30只,5~6周龄,体重(150±10)g,动物及饲料均购自广东省医学实验动物中心,实验动物合格证号:SCXK(粤)2008-0002,华南农业大学实验动物中心许可证号:SYXK(粤)2014-0136。
玻璃匀浆器广州精科化玻仪器公司;5417R冷冻高速离心机德国Eppendorf公司;Multiskan Mk3型酶标仪美国Thermo Fisher公司;Enspire Xenon Light Module-多功能酶标仪美国PE公司;EL204-IC电子天平瑞士METTLER TOLEDO公司;DK-600电热恒温水浴箱上海精宏实验设备有限公司;EthoVision XT 8.0动物行为轨迹跟踪系统荷兰Noldus公司;高架十字迷宫(elevated plus-maze,EPM) 上海移数信息科技有限公司。
1.2实验方法
1.2.1动物染毒及干预大鼠单笼饲养,光/暗周期12 h/12 h(光照时间07:00~19:00),室内温度为(22± 0.5)℃,湿度为50%~60%。大鼠适应性饲养7 d,适应期内所有大鼠自由摄食和饮水。适应期后按体重采用随机区组设计分组法分为5组:对照组,染毒组,GABA低、中、高剂量干预组,每组6只。对照组:玉米油;染毒组:DEHP 500 mg/kg;低剂量干预组:DEHP 500 mg/kg+GABA 1 mg/kg;中剂量干预组:DEHP 500 mg/kg+GABA 2 mg/kg;高剂量干预组:DEHP 500 mg/kg+GABA 4 mg/kg。每天上午9∶00干预组灌胃GABA(溶于生理盐水),对照组与染毒组灌胃等体积生理盐水;1 h后干预组与染毒组灌胃DEHP(溶于玉米油),对照组灌胃等体积玉米油,连续灌胃30 d。每6 d同一时间称量体重与食物消耗量,并计算食物利用率。食物利用率:一段时间内体重增加的克数除以饲料消耗的克数乘以100(100×体重增加量/鼠粮消耗量);总食物利用率:整个实验期间体重增加的克数除以饲料消耗的克数乘以100(100×体重增加量/鼠粮消耗量)。行为学测试前1周所有大鼠每天接受3 min抚摸以减少无关刺激。
1.2.2高架十字迷宫实验行为实验前,彻底清洁高架十字迷宫。干预前后均提前1 h将大鼠转移至行为学实验室,以适应环境。实验开始时,实验者双手从笼内轻轻取出大鼠(背对实验者),将大鼠面向开臂放入中央平台,实验者立即离开,通过动物行为轨迹跟踪系统采集大鼠5 min内在EPM中的活动信息,分别测定大鼠在EPM中:进入开臂次数(open arm entries,OE)、进入开臂时间(open arm time,OT)、进入闭臂次数(closed arm entries,CE)、进入闭臂时间(closed arm time,CT)。分别计算大鼠进入开臂次数百分比(OE%),OE%=OE(/OE+CE)×100;开臂停留时间百分比(OT%),OT%=OT(/OT+CT)×100;入臂总次数(total entries,TE),TE=OE+CE。每次信息采集完毕,将大鼠排泄物清理干净,用75%的酒精彻底清洁高架十字迷宫并擦干,然后再进行下一只大鼠信息的采集。
1.2.35-HT及NE的测定行为学实验结束,将大鼠断头取脑,在冰块上迅速分离出额叶皮质,立即放置于-80℃冰箱保存。测定前用预冷的PBS溶液冲洗额叶皮质表面的血迹,滤纸吸干,在冰水浴中,用PBS溶液将额叶皮质制成10%的额叶皮质匀浆。按照试剂盒的方法分别测定5-HT、NE及蛋白浓度。
1.3统计学处理
采用Origin8.0作图,SPSS19.0软件进行统计学分析,实验数据用±s表示。多组间比较采用单因素方差分析。进一步进行组间两两比较,若方差齐时,采用LSD检验;若方差不齐,采用Tamhane’s检验,差异显著水平为p<0.05,极显著水平为p<0.01。
2 结果与分析
2.1干预前高架十字迷宫实验
EPM是国际上公认的评价焦虑反应的方法,利用动物对新异环境的探究特性和对高悬开放臂的恐惧心理,形成矛盾冲突状态,从而反映动物的焦虑水平[14-15]。干预前各组大鼠高架十字迷宫指标无显著性差异(见表1),说明各组大鼠处于同一行为学水平。
表1 干预前各组大鼠高架十字迷宫行为比较(±s,n=6)Table 1 Comparison of elevated plus-maze behavior of rats before the experimental intervention(±s,n=6)
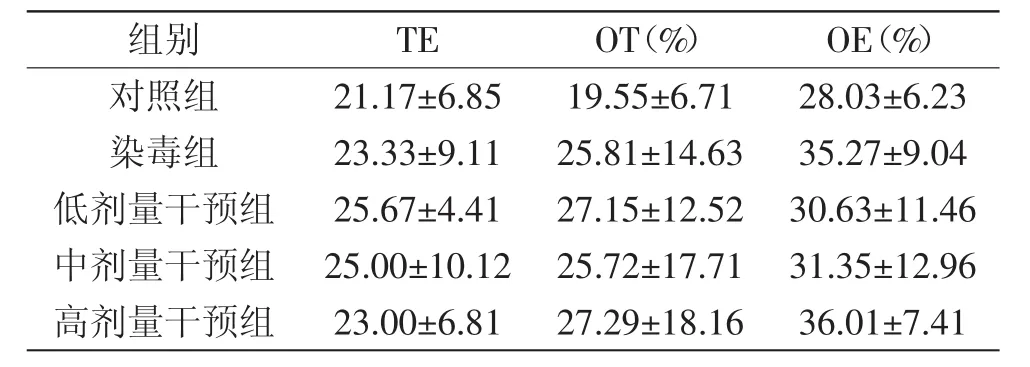
表1 干预前各组大鼠高架十字迷宫行为比较(±s,n=6)Table 1 Comparison of elevated plus-maze behavior of rats before the experimental intervention(±s,n=6)
组别 TE OT(%) OE(%)对照组 21.17±6.85 19.55±6.71 28.03±6.23染毒组 23.33±9.11 25.81±14.63 35.27±9.04低剂量干预组 25.67±4.41 27.15±12.52 30.63±11.46中剂量干预组 25.00±10.12 25.72±17.71 31.35±12.96高剂量干预组 23.00±6.81 27.29±18.16 36.01±7.41
2.2体重
实验期间各组大鼠体重随时间逐渐升高;实验期末染毒组体重最小;从6 d开始干预组大鼠体重随GABA剂量增加有升高趋势;实验期间各组大鼠体重无显著性差异(见图1)。实验结果表明,DEHP没有造成大鼠体重明显降低;胡帅尔等[16]给予SD大鼠连续灌胃4周DEHP(50.0、158.2、500.0 mg/kg),并未发现SD大鼠体重显著变化;梁添等[17]给SD大鼠灌服DEHP(150、450、1350 mg/kg)连续4周同样未发现体重明显变化。
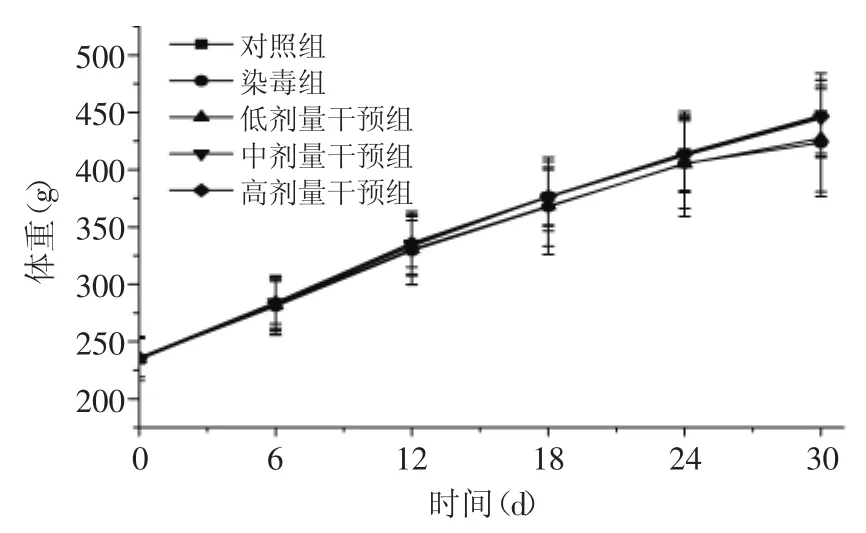
图1 实验期间各组大鼠体质量的变化(±s,n=6)Fig.1 Body weight changes of rats during the experiment(±s,n=6)
2.3食物利用率
从6 d开始,各剂量组食物利用率随时间变化呈现降低趋势;但在各时间点,食物利用率则随剂量增加而呈升高趋势。经统计学检验,染毒组总食物利用率显著低于对照组(p<0.05);高剂量干预组总食物利用率显著高于染毒组(p<0.05);中剂量和高剂量干预组与对照组相比,总食物利用率无显著性差异(p>0.05)(见表2)。
表2 实验期间各组大鼠食物利用率的变化(±s,n=6)Table 2 Changes in food utilization rate of rats during the experimen(tx±s,n=6)

表2 实验期间各组大鼠食物利用率的变化(±s,n=6)Table 2 Changes in food utilization rate of rats during the experimen(tx±s,n=6)
注:*:与对照组相比,p<0.05;**:与对照组相比,p<0.01;#:与染毒组相比,p<0.05;##:与染毒组相比,p<0.01;表3、图2同。
组别 6 d 12 d 18 d 24 d 30 d 总食物利用率对照组 31.98±2.70 31.38±1.93 26.37±0.55 23.77±1.67 20.03±1.06 26.63±0.62染毒组 30.51±3.12 29.45±2.08 24.12±1.72 20.76±3.57 10.47±6.24 23.31±1.74*低剂量干预组 30.58±2.57 30.48±1.37 24.29±1.87 21.00±1.91 14.14±4.58 23.99±1.06**中剂量干预组 30.13±0.35 30.63±2.82 25.11±3.65 21.32±3.06 19.17±2.81 25.21±1.82高剂量干预组 32.42±3.40 31.74±1.00 25.75±0.54 23.18±1.61 21.63±2.60 26.98±0.47#
DEHP虽然没有引起大鼠体重显著变化,但显著地下调大鼠总食物利用率,而中剂量和高剂量GABA能够改善这一趋势。食物利用率可能受多种因素影响,如药物作用、粮食适口性、能量消耗变化等[18]。本研究中各组大鼠所处环境相同,饲养条件一致,染毒组大鼠总食物利用率下降,说明DEHP干扰了大鼠对食物的吸收利用。梁添等[17]给SD大鼠灌服DEHP(150、450、1350 mg/kg)连续4周发现DEHP 1350 mg/kg组从第3周开始食物利用率显著下调,且总食物利用率也明显降低;DEHP 450 mg/kg组在第4周时大鼠食物利用率显著降低,总食物利用率虽然也降低,但变化并不显著,这一点与本实验不同,可能是因为本研究DEHP剂量高于450 mg/kg。欧阳俊彦等[9]利用GABA(0.5、1、2 mg/kg)干预情绪应激大鼠的焦虑症状,发现焦虑模型组大鼠总食物利用率显著降低,这一点与本研究一致;但GABA干预未能改善总食物利用率,这与本实验的中高剂量能够改善食物利用率的效应则不一样,推测可能是由于欧阳俊彦等采用的是物理方法使大鼠产生情绪应激,而本研究是生化应激,致焦虑的原理不同,也有可能是GABA剂量不同造成的。
2.4干预后高架十字迷宫实验
实验期末各组大鼠TE无显著性差异(p>0.05);染毒组大鼠OT(%)、OE(%)均极显著低于对照组(p<0.01)。随着GABA剂量的增加干预组OT(%)呈升高趋势;经统计学检验,中剂量干预组和高剂量干预组OT(%)显著高于染毒组(p<0.05),中剂量干预组和高剂量干预组OE%显著高于染毒组(p<0.05)(见表3)。
分析干预后大鼠行为学指标发现,在EPM行为学实验中,各组大鼠TE无显著性差异,染毒组大鼠OT(%)、OE(%)均极显著低于对照组,说明DEHP染毒使大鼠产生焦虑症状,Carbone S等[19]通过研究出生后1~45 d暴露于30 mg/kg DEHP的青春期雄性大鼠发现大鼠产生焦虑症状,具体表现为EPM实验中OT(%)和OE(%)显著降低;徐晓虹等[20]通过给母鼠从妊娠第7 d至产后21 d灌服DEHP,发现10 mg/kg DEHP会导致6周龄仔鼠在EPM中OT和OE显著降低,表现出焦虑水平增高。本研究中剂量干预组和高剂量干预组OT(%)及OE(%)两指标均显著高于染毒组,证明2 mg/kg GABA和4 mg/kg GABA均可以改善染毒大鼠焦虑水平,并且4 mg/kg GABA改善效果更显著。欧阳俊彦等[21]在研究GABA对情绪应激大鼠血脂的影响时,发现焦虑组大鼠在EPM实验中OT(%)和OE(%)均显著降低,而2 mg/kg GABA组大鼠OT(%)和OE(%)恢复到正常水平,表现出改善大鼠焦虑的作用,这一效果与本研究一致。
表3 干预后各组大鼠高架十字迷宫行为比较(±s,n=6)Table 3 Comparison of open-field test behavior of rats after theexperimental intervention(±s,n=6)

表3 干预后各组大鼠高架十字迷宫行为比较(±s,n=6)Table 3 Comparison of open-field test behavior of rats after theexperimental intervention(±s,n=6)
组别 TE OT(%) OE(%)对照组 20.00±4.90 41.70±13.77 50.19±11.39染毒组 18.50±4.28 8.34±10.94** 15.30±15.55**低剂量干预组 18.33±7.31 24.06±18.53 30.91±20.68中剂量干预组 18.67±2.16 35.54±26.12# 43.30±24.27#高剂量干预组 20.50±5.65 39.66±26.43# 42.65±19.97#
2.5额叶皮质5-HT、NE水平
染毒组5-HT和NE均显著高于对照组(p<0.05);随着GABA干预剂量的增加5-HT及NE呈现下降趋势,中剂量干预组5-HT和NE显著低于染毒组(p<0.05),高剂量干预组5-HT和NE极显著低于染毒组(p<0.01)(见图2)。

图2 各组大鼠额叶皮质5-HT、NE水平的变化(±s,n=6)Fig.2 Changes in the frontal cortex of rats 5-HT、NE levels(±s,n=6)
额叶病变不仅能改变认知功能、行为和决策能力,也能影响情感和情绪。情绪的中枢环路有额叶皮质、前扣带回、海马、岛叶和杏仁核等结构,每一结构对不同的情绪成分发挥独特的作用,而额叶皮质和海马是调控正性和负性情绪的关键部位,焦虑症患者的额叶皮质功能有变化。研究各组大鼠额叶皮质指标发现,染毒组5-HT、NE均显著高于对照组,证明DEHP对额叶皮质造成损伤,王明霞等[22]通过给小鼠连续灌服540 mg/kg DEHP 15 d发现小鼠脑组织5-HT显著增高,NE未发生显著变化,可能由于染毒动物的种类和时长与本研究不同,故NE未发生显著变化。而本研究中2 mg/kg GABA和4 mg/kg GABA干预都能够显著降低5-HT、NE水平,证明GABA能够一定程度的改善这种损伤作用,并且4 mg/kg GABA改善效果更显著。
GABA、5-HT及NE之间的失平衡与焦虑情绪密切相关[11,23],大量的研究表明焦虑通常伴随5-HT及NE的显著上升[24-26],用药物损害GABA可导致兴奋和抑制失衡,引起过度兴奋以及焦虑等异常情绪产生;增强GABA能的活动可有效地治疗焦虑症[28],且GABA能通路在中脑经边缘结构至皮质的所有水平均可抑制5-HT、NE等兴奋性传导通路[27-29]。因此,外源性GABA的摄入可能通过抑制额叶皮质5-HT及NE的水平而改善了由DEHP染毒引起的大鼠焦虑症状。
3 结论
本研究通过EPM实验证实DEHP具有致焦虑的作用;DEHP可能通过升高大鼠额叶皮质5-HT及NE的水平而导致大鼠产生焦虑情绪;通过外源性GABA的摄入降低了染毒大鼠额叶皮质5-HT及NE的水平从而改善了大鼠的焦虑水平。本研究为GABA以及富含GABA食物的深加工提供了一定的借鉴,同时也为DEHP毒性干预研究提供了思路。
[1]Lyche J L,Gutleb A C,Bergman A,et al.Reproductive and developmental toxicity of phthalates[J].Journal of Toxicology and Environmental Health,Part B,2009,12(4):225-249.
[2]Singh S,Li S S L.Bisphenol A and phthalates exhibit similar toxicogenomics and health effects[J].Gene,2012,494(1):85-91.
[3]LI Y F,Chen P A N,HU J X,et al.Effects of cypermethrin on male reproductive system in adult rats[J].Biomedical and Environmental Sciences,2013,26(3):201-208.
[4]Noriega N,Howdeshell K L,Furr J,et al.Pubertal administration of DEHP delays puberty,suppresses testosterone production and inhibits reproductive tract development in male Sprague-Dawley and Long-Evans Rats[J].Toxicological Sciences,2009,111(1):163-178.
[5]Guyton K Z,Chiu W A,Bateson T F,et al.A reexamination of the PPAR-α activation mode of action as a basis for assessing human cancer risks of environmental contaminants[J].Environ Health Perspect,2009,117(11):1664-1672.
[6]Quaak I,Brouns M R,Van de Bor M.The dynamics of autism spectrum disorders:How neurotoxic compounds and neurotransmittersinteract[J].InternationalJournal of Environmental Research and Public Health,2013,10(8):3384-3408.
[7]Lee B J,Kim J S,Kang Y M,et al.Antioxidant activity and γ-aminobutyric acid(GABA)content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J].Food Chemistry,2010,122(1):271-276.
[8]Kanehira T,Nakamura Y,Nakamura K,et al.Relieving occupational fatigue by consumption of a beverage containing γ-amino butyric acid[J].Journal of Nutritional Science and Vitaminology,2011,57(1):9-15.
[9]欧阳俊彦,胡卓炎,褚玥,等.γ-氨基丁酸对情绪应激大鼠额叶皮质一氧化氦合酶和一氧化氮水平的影响[J].第三军医大学学报,2013,35(5):385-389.
[10]和昱辰,张波,瞿玮,等.血清单胺类神经递质及其代谢产物在重度抑郁症及抑郁共病焦虑障碍诊断中的应用[J].第三军医大学学报,2014,36(8):806-810.
[11]Millan M J.The neurobiology and control of anxious states[J].Progress in Neurobiology,2003,70(2):83-244.
[12]李晓环,张文真,贾爽,等.孕妇焦虑与去甲肾上腺素及5-羟色胺的关系[J].中国妇幼保健,2006,21(18):2545-2547.
[13]Lewis M D,Stieben J.Emotion regulation in the brain:Conceptual issues and directions for developmental research[J]. Child Development,2004,75(2):371-376.
[14]Roy V,Chapillon P,Jeljeli M,et al.Free versus forced exposure to an elevated plus-maze:evidence for new behavioral interpretations during test and retest[J].Psychopharmacology,2009,203(1):131-141.
[15]曹素霞,谢光荣,李恒芬,等.焦虑障碍发病模型的建立与分析[J].郑州大学学报:医学版,2010(3):398-401.
[16]胡帅尔,王凤岩,李文立,等.邻苯二甲酸二(2-乙基)己酯对雌性大鼠甲状腺的毒性作用[J].环境与健康杂志,2013,30(7):604-607.
[17]梁添,欧阳俊彦,羿利华,等.邻苯二甲酸二(2-乙基)己酯短期重复暴露对大鼠行为的影响[J].南方医科大学学报,2013,33(3):401-405.
[18]赖玉婷,欧阳俊彦,郭佑廷,等.壬基酚对大鼠5-羟色胺分解代谢通路的影响[J].中国环境科学,2014(9):2408-2412.
[19]Carbone S,Ponzo O J,Gobetto N,et al.Antiandrogenic effect of perinatal exposure to the endocrine disruptor di-(2-ethylhexyl)phthalate increases anxiety-like behavior in male rats during sexual maturation[J].Hormones and Behavior,2013,63(5):692-699.
[20]徐晓虹,竹庆杰,杨艳玲,等.出生前后DEHP暴露对小鼠神经行为的影响[J].浙江师范大学学报:自然科学版,2015,38(1):15-22.
[21]欧阳俊彦,胡卓炎,褚玥,等.γ-氨基丁酸对情绪应激大鼠血脂的影响[J].营养学报,2013,35(3):241-245.
[22]王明霞.邻苯二甲酸二辛酯和氯仿联合染毒对小鼠脑组织的影响[D].长春:吉林大学,2013.
[23]胡秦,刘新民.神经递质与焦虑动物模型[J].中国比较医学杂志,2006,16(10):635-638.
[24]周奇志,赵纪岚,蔡定均,等.电针对慢性情绪应激焦虑大鼠中枢单胺递质与γ-氨基丁酸失平衡的调节作用[J].中华中医药杂志,2008,23(10):926-929.
[25]明康文,洪创雄.调平康片对伴焦虑症状高血压患者血浆5-HT,NE影响的研究[J].辽宁中医药大学学报,2011,13(6):80-81.
[26]Frank M G,Hendricks S E,Bessette D,et al.Levels of monocyte reactive oxygen species are associated with reduced natural killer cell activity in major depressive disorder[J]. Neuropsychobiology,2001,44(1):1-6.
[27]Talalaenko A N,Krivobok G K,Stakhovskiǐ I V.The role of monoamin-and acidergic mechanisms of the hippocampus in anxiety states of different origins and their participation in the antiaversive effects of anxiolytics[J].Fiziologicheskii Zhurnal Imeni IM Sechenova/Rossiiskaia Akademiia Nauk,1993,79(1):99-104.
[28]Duzzioni M,Calixto A V,Duarte F S,et al.Modulation of anxiety in rats evaluated in the elevated T-maze:evidence of the relationship between substance P and diazepam[J].Behavioural Brain Research,2008,187(1):140-145.
[29]Kalueff A V,Nutt D J.Role of GABA in anxiety and depression[J].Depression and Anxiety,2007,24(7):495-517.
Intervention effect of Gamma aminobutyric acid on anxiety behavior induced by di(2-ethylhexyl)phthalate in rats
LIU Hui1,2,GUO You-ting1,HUANG Shao-wen1,YANG Jie1,YANG Tong-wang1,SUN Yuan-ming1,*,LIU Chun-hong1,*
(1.College of Food Science,South China Agriculture University,Guangdong Provincial Key Laboratory of Food Quality and Safety,Laboratory of Quality and Safety Risk Assessment in Agricultural Products Preservation Ministry of Agriculture,Guangzhou 510642,China;2.Guangdong Testing Institute of Product Quality Supervision,Foshan 528300,China)
Objective:To investigate the effect of γ-aminobutyric acid(GABA)on the neurobehavior of rats induced by di(2-ethylhexyl)phthalate(DEHP).Methods:30 male Sprague-Dawley rats were divided into 5 groups randomly:control group,DEHP group(500 mg/kg DEHP),low GABA group(L:500 mg/kg DEHP and 1 mg/kg GABA),medium GABA group(M:500 mg/kg DEHP and 2 mg/kg GABA),and high GABA group(H:500 mg/kg DEHP and 4 mg/kg GABA).The interventions for DEHP exposure continued for 30 consecutive days.Behavioral changes of rats before and after interventions were assessed in the elevated plus maze test(EPM),and the levels of serotonin(5-HT)and norepinephrine(NE)in prefrontal cortex of rats were measured. Results:No significant differences were found in the EPM among the five groups(p>0.05)before interventions. DEHP and GABA treatment had no significant effects on the body weight of rats.The total food utilization rate of H group and C group were higher than DEHP group(p<0.05).The total entrance was not significantly different among different groups(p>0.05)after interventions.DEHP group had decreased percentage of time spent in open arms and entrance frequency to open arms than C group in the EPM test(p<0.01).The percentage of time spent in open arms and entrance frequency to open arms of M and H group were higher than DEHPgroup(p<0.05).The levels of 5-HT and NE of DEHP group were higher than C group(p<0.05).The levels of 5-HT and NE of M group were lower than DEHP group(p<0.05).The levels of 5-HT and NE of H group were lower than DEHP group(p<0.01).Conclusion:DEHP elevated 5-HT and NE levels in prefrontal cortex of rats and induces anxiety of rats.However,these effects induced by DEHP could be alleviated under GABA intervention through reducing 5-HT and NE in prefrontal cortex of rats.
γ-aminobutyric acid;di(2-ethylhexyl)phthalate;anxiety;serotonin;norepinephrine
TS201.4
A
1002-0306(2015)20-0354-05
10.13386/j.issn1002-0306.2015.20.064
2015-03-19
刘辉(1980-),男,博士,工程师,研究方向:食品技术检测及食品安全风险评估,E-mail:lh403@163.com。
孙远明(1956-),男,博士,教授,研究方向:食品质量与安全,E-mail:ymsun@scau.edu.cn。柳春红(1968-),女,博士,教授,研究方向:营养及食品安全,E-mail:liuch@scau.edu.cn。
广东省科技计划项目(2012B090600005);农业部农产品质量安全风险评估专项(GJFP2014011)。

