芡种皮多酚提取物体外抑制α-葡萄糖苷酶和α-淀粉酶活性研究
伍城颖,吴启南,王 红,樊修和
(1.南京中医药大学附属中西医结合医院中药质量研究室,江苏南京210028;2.中国中医科学院江苏分院和江苏省中医药研究院中药代谢组研究室,江苏南京210028;3.江苏省中药资源产业化过程协同创新中心,江苏南京210023;4.南京中医药大学药学院,江苏南京210023)
芡种皮多酚提取物体外抑制α-葡萄糖苷酶和α-淀粉酶活性研究
伍城颖1,2,吴启南3,4,*,王红4,樊修和4
(1.南京中医药大学附属中西医结合医院中药质量研究室,江苏南京210028;2.中国中医科学院江苏分院和江苏省中医药研究院中药代谢组研究室,江苏南京210028;3.江苏省中药资源产业化过程协同创新中心,江苏南京210023;4.南京中医药大学药学院,江苏南京210023)
通过体外实验研究了芡种皮多酚提取物对α-葡萄糖苷酶和α-淀粉酶活性的影响,并考察了其对α-葡萄糖苷酶和α-淀粉酶的抑制动力学,研究结果显示:芡种皮多酚提取物在体外具有较强的抑制α-葡萄糖苷酶和α-淀粉酶的作用(IC50分别相当于生药浓度0.08 mg/mL和0.30 mg/mL),其抑制作用与浓度之间存在量效关系,二者的抑制类型均为可逆性的竞争性抑制剂。因此,芡种皮具有开发成辅助降糖的保健食品或药品的潜力,有很大的利用价值。
芡种皮,多酚提取物,α-葡萄糖苷酶,α-淀粉酶,抑制活性
芡(Euryale ferox Salisb.)为睡莲科(Nymphaeaceae)芡属(Euryale)唯一的种,在中国中部、南部各省均有种植,其主产区为江苏、山东、安徽、湖北、湖南等省[1]。芡种皮,又称芡实壳,据《本草纲目》记载,芡实壳可与芡实同用起涩精作用[2]。芡种皮重量约占芡种子重量的一半,在芡的生产过程中多作为燃料焚烧或直接废弃,对环境造成污染,也造成资源的极大浪费[3]。芡种皮富含酚类物质[4-5],已有研究发现,芡种皮提取物能显著降低链脲佐菌素(STZ)诱发的糖尿病小鼠的血糖水平和血脂水平[6-8],但尚未报道其降糖机制是否与抑制消化酶活性相关。
α-葡萄糖苷酶和α-淀粉酶是影响淀粉等碳水化合物消化和吸收的关键糖苷水解酶,其主要作用是将淀粉、蔗糖等分解成葡萄糖、麦芽糖而被机体吸收。而α-葡萄糖苷酶抑制剂和α-淀粉酶抑制剂则可减缓淀粉等物质的降解,减少糖的吸收,从而降低餐后血糖,常用于二型糖尿病的治疗,常用的α-葡萄糖苷酶抑制剂药物有阿卡波糖、米格列醇等[9]。由于化学合成的α-葡萄糖苷酶抑制剂和α-淀粉酶抑制剂有副作用,目前从植物中寻找天然α-葡萄糖苷酶、α-淀粉酶抑制剂已成为研究的热点。本研究拟对芡种皮多酚提取物体外对α-葡萄糖苷酶和α-淀粉酶抑制活性进行研究,以期为芡种皮的应用开发及芡资源的综合利用提供参考和依据。
1 材料与方法
1.1材料与仪器
芡种皮2011年9月采集自苏州蒌葑群力村,经南京中医药大学药学院吴启南教授鉴定为睡莲科芡属芡(Euryale ferox Salisb.)的种皮,置阴凉通风处晾干后,粉碎过40目筛,备用;酿酒酵母α-葡萄糖苷酶(26.5 U/mg)和猪胰α-淀粉酶(50 U/mg) 美国Sigma公司;对硝基苯基-α-D-吡喃葡萄糖苷(pNPG) 上海宝曼生物科技有限公司;可溶性淀粉北京奥博星生物技术责任有限公司;阿卡波糖批号:130616,规格:50 mg/片,杭州中美华东制药有限公司;其余试剂均为分析纯,南京化学试剂有限公司;实验用水实验室自制超纯水。
Sartorius BT 125D型十万分之一电子分析天平北京赛多利斯仪器系统有限公司;KQ-500B超声波清洗仪昆山市超声仪器有限公司;MH-1型微量振荡器江苏海门市麒麟医用仪器厂;DHG-902电热鼓风干燥箱上海精宏实验设备有限公司;HH-S型水浴锅巩义市英峪予华仪器厂;ELX800酶标仪和Synergy H1全功能酶标仪美国Bio-Tek公司;96孔酶标板美国Corning公司;微量移液器芬兰BIOHIT公司;SAGA-10TY实验室级超纯水器南京易普易达科技发展有限公司。
1.2实验方法
1.2.1样品的制备芡种皮多酚提取物参照文献方法[4-5]制备,用二甲基亚砜(DMSO)溶解,配制成相当于生药3 g/mL的溶液,于4℃储存。
1.2.2二硝基水杨酸(DNS)试剂的配制准确称取3,5-二硝基水杨酸0.63 g于100 mL烧杯中,加少量超纯水溶解后,加入2 mol/L的NaOH溶液26.2 mL,再加到50 mL含有18.2 g酒石酸钾钠的热水溶液中(温度不超过50℃),再加0.5 g苯酚和0.5 g无水亚硫酸钠,搅拌至溶解完全,冷却后用超纯水转移定容至100 mL棕色容量瓶中,充分混匀,室温放置一周后使用。
1.2.3α-葡萄糖苷酶活性抑制实验参考文献[10-12]方法并稍有改动。将样品溶液配制成分别相当于生药2.52×10-2、5.04×10-2、0.10、0.20、0.40、0.81 mg/mL的溶液;将阿卡波糖配制成浓度分别为4.69×10-2、9.38× 10-2、1.88×10-1、3.75×10-1、0.75、1.50、3.00、6.00 mg/mL的溶液。分别吸取pH7.0的磷酸盐缓冲液120 μL和不同浓度的样品溶液20 μL置于96孔板上,加入0.24 U/mL的α-葡萄糖苷酶溶液20 μL,混匀后于37℃反应10 min,再加入2.5 mmol/L的pNPG溶液20 μL,混匀,继续37℃反应10 min,最后加入0.2 mol/L的Na2CO3溶液80 μL终止反应,于405 nm波长处测定吸光度值,计算抑制率,并用Origin软件计算IC50值。以阿卡波糖为阳性对照,反应体系见表1。

表1 α-葡萄糖苷酶活性抑制实验反应体系Table 1 Reaction system of inhibition activity against α-glucosidase
1.2.4α-淀粉酶活性抑制实验参考文献[10,13]方法并稍有改动。将样品溶液配制成分别相当于生药2.93×10-1、5.86×10-1、1.17、2.34、4.69、9.38、18.75 mg/mL的溶液;将阿卡波糖配制成浓度分别为11.72×10-3、23.44×10-3、46.88×10-3、93.75×10-3、18.75×10-2、3.75× 10-1mg/mL的溶液。吸取不同浓度的样品溶液20 μL分别置于1.5 mL离心管内,加入3.75 U/mL的α-淀粉酶溶液20 μL,混匀后于37℃预热10 min,再加入0.5%的可溶性淀粉溶液40 μL,混匀后于37℃反应10 min,加入80 μL的DNS溶液终止反应,反应液置沸水浴中加热5 min后取出,于冰水浴中迅速冷却,测定540 nm波长处的吸光度值,计算抑制率,并用Origin软件计算IC50值。以阿卡波糖为阳性对照,反应体系见表2。


表2 α-淀粉酶活性抑制实验反应体系Table 2 Reaction system of inhibition activity against α-amylase
1.2.5对α-葡萄糖苷酶抑制作用的动力学实验参照文献方法[10]并稍有改动。酶浓度不变(0.24 U/mL),设置6个底物pNPG浓度(0.5、1.0、1.5、2.0、2.5、5.0 mmol/L),样品设置0.1 mg/mL和0.2 mg/mL两个浓度,分别吸取pH7.0的磷酸盐缓冲液120 μL和不同浓度样品20 μL置于96孔板上,加入0.24 U/mL的α-葡萄糖苷酶溶液20 μL,混匀后于37℃反应10 min,再分别加入0.5、1.0、1.5、2.0、2.5、5.0 mmol/L的pNPG溶液20 μL,混匀,37℃下反应,每隔5 min在405 nm波长条件下检测吸光度值,以底物浓度的倒数(1/S)为横坐标,以反应速度的倒数(1/V)为纵坐标,采用Excel软件绘制Lineweaver-Burk双倒数曲线,确定样品对α-葡萄糖苷酶的抑制类型。
为判断芡种皮多酚对α-葡萄糖苷酶的抑制作用是否可逆,样品设0.1、0.2、0.4 mg/mL三个浓度,分别加入0.24 U/mL的α-葡萄糖苷酶溶液0、20、40、60、80、100 μL,补加pH7.0的磷酸盐缓冲液至等体积,再加入等量的底物pNPG反应,405 nm波长条件下检测吸光度值,以酶液的体积为横坐标,以反应速率为纵坐标,采用Excel软件绘制芡种皮多酚对α-葡萄糖苷酶的抑制动力学曲线。
1.2.6对α-淀粉酶抑制作用的动力学实验参照文献方法[10]并稍有改动。酶浓度不变(3.75 U/mL),设置3个底物淀粉浓度(0.5%、1.0%、2.0%),样品设46.88 mg/mL和93.75 mg/mL两个浓度,吸取不同浓度样品20 μL分别置于1.5 mL离心管内,各加入3.75 U/mL的α-淀粉酶溶液20 μL,混匀后于37℃预热10 min,再分别加入0.5%、1.0%、2.0%的可溶性淀粉溶液40 μL,混匀后于37℃反应,每隔5 min各浓度取出1支试管,加入80 μL的DNS溶液终止反应,反应液置沸水浴中加热5 min后取出,于冰水浴中迅速冷却,测定540 nm波长处的吸光度值,以底物浓度的倒数(1/S)为横坐标,以反应速度的倒数(1/V)为纵坐标,采用Excel软件绘制Lineweaver-Burk双倒数曲线,确定样品对α-淀粉酶的抑制类型。
为了判断芡种皮多酚对α-淀粉酶的抑制作用是否可逆,样品设46.88、93.75、187.50 mg/mL三个浓度,分别加入浓度为0、3.75、7.5、15 U/mL的α-淀粉酶溶液,再加入等量的淀粉溶液,反应后于540 nm波长条件下检测吸光度值,以酶液的浓度为横坐标,以反应速率为纵坐标,采用Excel软件绘制芡种皮多酚对α-淀粉酶的抑制动力学曲线。
2 结果与分析
2.1芡种皮多酚对α-葡萄糖苷酶的抑制活性
不同浓度的芡种皮多酚对α-葡萄糖苷酶活性的影响如图1所示,提取物对α-葡萄糖苷酶具有抑制作用。2.52×10-2mg/mL芡种皮多酚的抑制率为10.90%,随着芡种皮多酚浓度的升高,其对α-葡萄糖苷酶的抑制活性也随之增加,当浓度为0.81 mg/mL时,抑制活性可达100%,其IC50为相当于生药0.08 mg/mL。从图2可以看出,阳性对照阿卡波糖在浓度为4.69×10-2mg/mL时,对α-葡萄糖苷酶的抑制率为7.01%,在6.00 mg/mL时抑制率达到84.93%,其IC50为0.52 mg/mL。因此,芡种皮多酚是较好的α-葡萄糖苷酶抑制剂,芡种皮多酚对α-葡萄糖苷酶的抑制活性强于阿卡波糖。
图1 芡种皮多酚对α-葡萄糖苷酶的抑制活性Fig.1 Inhibitory effects of Euryale ferox polyphenols extracts from seed coat on α-glucosidase
图2 阿卡波糖对α-葡萄糖苷酶的抑制活性Fig.2 Inhibitory effects of acarbose on α-glucosidase
图3 芡种皮多酚对α-淀粉酶的抑制活性Fig.3 Inhibitory effects of Euryale ferox polyphenols extracts from seed coat on α-amylase

图4 阿卡波糖对α-淀粉酶的抑制活性Fig.4 Inhibitory effects of acarbose on α-amylase
2.2芡种皮多酚对α-淀粉酶的抑制活性
不同浓度的芡种皮多酚对α-淀粉酶活性的影响如图3所示,提取物对α-淀粉酶具有抑制作用。2.93× 10-1mg/mL芡种皮多酚的抑制率为48.90%,随着芡种皮多酚浓度的升高,其对α-淀粉酶的抑制活性也随之增加,当浓度为18.75 mg/mL时,抑制率可达99.11%,提示芡种皮多酚具有较好的α-淀粉酶抑制活性。由图4可知,阳性对照阿卡波糖在浓度为11.72×10-3mg/mL时,对α-淀粉酶的抑制率为34.47%,在3.75×10-1mg/mL时抑制率达到96.17%。阿卡波糖抑制α-淀粉酶活性的IC50为0.02 mg/mL,芡种皮多酚提取物抑制α-淀粉酶活性的IC50为相当于生药浓度0.30 mg/mL,芡种皮多酚对α-淀粉酶的抑制活性弱于阿卡波糖。
2.3芡种皮多酚对α-葡萄糖苷酶抑制作用的类型
为确定芡种皮多酚提取物对α-葡萄糖苷酶的抑制类型,在其他反应条件一定、改变底物浓度、添加不同浓度芡种皮多酚的条件下,测定酶促反应速率,以1/[S]为横坐标,以1/V为纵坐标,得到α-葡萄糖苷酶在不同浓度芡种皮多酚存在时的Lineweaver-Burk双倒数曲线,见图5。结果显示,加入不同浓度芡种皮多酚时,所得直线在纵轴上交于一点,即纵轴截距相等,随着样品浓度的增加,反应速率Vmax值基本保持不变;横轴截距随芡种皮多酚浓度的增加而增大,即米氏常数Km值增大,符合酶竞争抑制剂的作用特点,因此推测芡种皮多酚对α-葡萄糖苷酶的抑制作用类型为竞争性抑制。

图5 不同浓度样品与α-葡萄糖苷酶反应的Lineweaver-Burk双倒数曲线Fig.5 Lineweaver-Burk plots of the reactions of α-glucosidase with samples
由图6可以看出,在测定酶活性体系中加入不同浓度的芡种皮多酚提取物后,所得的直线均通过原点,且直线的斜率随着芡种皮多酚浓度的增加而减少,说明芡种皮多酚对α-葡萄糖苷酶的抑制作用是可逆的[14]。
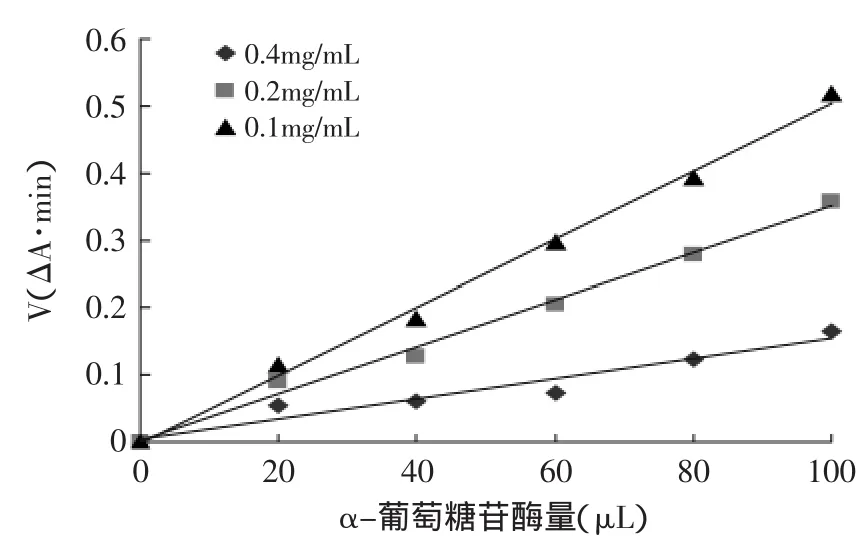
图6 样品对α-葡萄糖苷酶的抑制动力学曲线Fig.6 Kinetics curves of inhibition of α-glucosidase
2.4芡种皮多酚对α-淀粉酶抑制作用的类型
为确定芡种皮多酚提取物对α-淀粉酶的抑制类型,在其他反应条件一定、改变底物浓度、添加不同浓度芡种皮多酚的条件下,测定酶促反应速率,以1/[S]为横坐标,以1/V为纵坐标,得到α-淀粉酶在不同浓度芡种皮多酚存在时的Lineweaver-Burk双倒数曲线,见图7。结果显示,加入不同浓度芡种皮多酚时,所得直线在纵轴上的截距相等,随着样品浓度的增加,反应速率Vmax值基本保持不变;横轴截距随芡种皮多酚浓度的增加而增大,即米氏常数Km值增大,符合酶竞争抑制剂的作用特点,因此推断芡种皮多酚对α-淀粉酶的抑制作用为竞争性抑制。

图7 不同浓度样品与α-淀粉酶反应的Lineweaver-Burk双倒数曲线Fig.7 Lineweaver-Burk plots of the reactions of α-amylase with samples
由图8可知,在测定酶活性体系中加入不同浓度的芡种皮多酚提取物后,所得的直线均通过原点,且直线的斜率随着芡种皮多酚浓度的增加而减少,说明芡种皮多酚对α-淀粉酶的抑制作用是可逆的[14]。
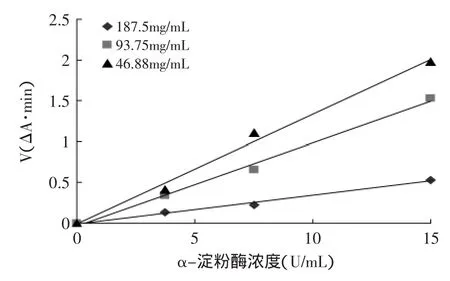
图8 样品对α-淀粉酶的抑制动力学曲线Fig.8 Kinetics curves of inhibition of α-amylase
3 结论
本研究从资源利用的角度出发,对芡种皮多酚提取物进行了体外抑制消化酶活性的研究,实验结果证明,芡种皮多酚提取物具有较好的体外α-葡萄糖苷酶和α-淀粉酶抑制活性,并且其活性与浓度有较好的量效关系,其抑制作用类型均为可逆性的竞争性抑制。芡种皮具有开发成辅助降糖的保健食品或药品的潜力,但其体内机制还需进一步深入研究。本研究结果为芡种皮开发功能食品或药品提供了一定的理论基础,对于提高芡的附加值和芡资源的有效利用具有重要意义。
[1]宋晶,吴启南.芡实的本草考证[J].现代中药研究与实践,2010,24(2):22-24.
[2]李时珍.本草纲目[M].北京:人民卫生出版社,1982:1902-1904.
[3]LiuY,WeiSL,LiaoMC.Optimizationofultrasonicextraction of phenolic compounds from Euryale ferox seed shells using response surface methodology[J].Ind Crop Prod,2013,49:837-843.
[4]陈蓉,吴启南.响应面法优化芡实种皮多酚的提取工艺研究[J].食品工业科技,2013,13:205-210,214.
[5]Wu C Y,Chen R,Wang X S,et al.Antioxidant and antifatigue activities of phenolic extract from the seed coat of Euryale ferox Salisb.and identification of three phenolic compounds by LC-ESI-MS/MS[J].Molecules,2013,18(9):11003-11021.
[6]Yuan H B,Meng S H,Gong Z B,et al.Hypoglycemic activity and the activation of phosphorylation of a triterpenoid-rich extract from Euryale shell on streptozotocin-induced diabetic mice[J].Bangladesh J Pharmacol,2013,8(3):230-235.
[7]Yuan H B,Gong Z B,Meng S H,et al.Hypoglycemic and hypolipidemic effects of a triterpenoid-rich extract from Euryale shell on streptozotocin-induced diabetic mice[J].Pharmazie,2013,68:227-231.
[8]孙文凯.芡实壳提取物抗氧化作用与降血糖功效初探[D].合肥:合肥工业大学,2012.
[9]刘杰超,焦中高,王思新.苹果多酚提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J].果树学报,2011,28(4):553-557.
[10]Su CH,Hsu CH,Ng LT.Inhibitory potential of fatty acids on key enzymes related to type 2 diabetes[J].Biofactors,2013,39(4):415-421.
[11]何荣,冯国华,张富东,等.芒果苷对α-葡萄糖苷酶活性的影响[J].中药药理与临床,2013,29(3):54-57.
[12]郭凤霞,曾阳,李锦萍,等.沙棘多糖对α-葡萄糖苷酶活性及正常小鼠血糖的影响[J].药学学报,2013,48(4):604-608.
[13]闫冬,何雯,程磊,等.维药石榴花多酚提取物对α-葡萄糖苷酶和α-淀粉酶抑制作用的研究[J].新疆医科大学学报,2013,36(5):581-583.
[14]Yan J K,Zhang G W,Pan J H,et al.α-Glucosidase inhibition by luteolin:Kinetics,interaction and molecular docking[J].Int J Biol Macromol,2014,64:213-223.
In vitro inhibitory effects of polyphenol extracts from Euryale ferox seed coat on α-glucosidase and α-amylase activities
WU Cheng-ying1,2,WU Qi-nan3,4,*,WANG Hong4,FAN Xiu-he4
(1.Department of Pharmaceutical Analysis,Hospital of Integrated Traditional Chinese and Western Medicine Affiliated to Nanjing University of Chinese Medicine,Nanjing 210028,China;2.Department of Metabolomics,Jiangsu Province Academy of Traditional Chinese Medicine and Jiangsu Branch of China Academy of Chinese Medical Sciences,Nanjing 210028,China;3.Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization,Nanjing 210023,China;4.School of Pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China)
The inhibitory effects of total polyphenols extracts from Euryale ferox seed coat against α-glucosidase and α-amylase were studied through the in vitro testing of inhibition rate and inhibition kinetics.The results showed that the total polyphenols exhibited strong inhibitory effects against α-glucosidase and α-amylase in vitro with dose-effect relationship and the IC50were 0.08 mg/mL and 0.30 mg/mL,respectively.The inhibition type was reversible and competitive inhibitor.In conclusion,Euryale ferox seed coat would be a potential source for a hypoglycemic functional food or medicine.
Euryale ferox Salisb.;polyphenol extracts;α-glucosidase;α-amylase;inhibitory effects
TS255.1
A
1002-0306(2015)16-0091-05
10.13386/j.issn1002-0306.2015.16.010
2014-10-14
伍城颖(1979-),女,博士,研究方向:中药资源开发与品质评价,E-mail:fangfeng1979@163.com。
吴启南(1963-),男,教授,研究方向:中药资源生产与品质评价,E-mail:qnwyjs@163.com。
“十二五”国家科技支撑计划项目(2011BAI04B06);江苏高校优势学科建设工程资助项目;江苏省高等学校“中药资源化学研究”优秀科技创新团队(2011)项目;江苏省2013年度普通高校研究生科研创新计划项目(CXLX13_600)。

