草鱼肝胰中CPIs初步分离鉴定及其活性测定
蒋然然,梁 宇,陈治光,杨 锦,李 新,但 静,李 冉,钟海霞,李美良,李树红
(四川农业大学食品学院,四川雅安625014)
草鱼肝胰中CPIs初步分离鉴定及其活性测定
蒋然然,梁宇,陈治光,杨锦,李新,但静,李冉,钟海霞,李美良,李树红*
(四川农业大学食品学院,四川雅安625014)
首先比较了偶氮酪蛋白(Azocasein)法和荧光合成肽底物法,在监测草鱼肝胰半胱氨酸蛋白酶抑制剂CPIs(cysteine proteinase inhibitors)活性时的适用性。进而通过凝胶过滤高效液相色谱法、反相酶谱和免疫印迹法,对草鱼肝胰中CPIs的分子量分布及可能的家族类型进行定性鉴定。结果表明在粗提液中加入丝氨酸蛋白酶不可逆抑制剂(40 mmol/L PMSF或0.4 mmol/L Pefabloc SC),或经90℃加热5 min,仅荧光合成肽底物法可准确地监测到CPIs活性的变化。液相色谱结果显示,草鱼肝胰中存在分子量(98、26、12、5~1 ku)不同的CPIs活性部分。但反相酶谱法仅能够判断其中大于20 ku的CPIs。而免疫印迹法证明存在约12 ku的Cystatin(家族II)类型CPIs,发现小于12 ku的显色条带,可能是该蛋白降解形成的低分子量的活性片段。
草鱼肝胰,半胱氨酸蛋白酶抑制因子,活性测定,分子量分布,分离鉴定
草鱼(Ctenopharyngodon idellus)是我国主要的淡水养殖经济鱼种之一,年产量478万吨,位居全国淡水养殖的第二位[1]。其在加工过程中,会产生大量下脚料如内脏、鱼皮等,约占鱼体总重的40%~55%[2]。有研究表明,在鱼类卵[3]、皮[4]、血浆[5]等加工废弃物中,均存在半胱氨酸蛋白酶抑制因子CPIs活性。
半胱氨酸蛋白酶抑制因子(cysteine proteinase inhibitors,CPIs)CPIs是一类专门抑制活性中心含有半胱氨酸残基的蛋白酶的抑制因子[6],Cystatins超家族[7]是动物源CPIs的最主要类群,其根据分子量和结构划分为三个家族即Stefin(家族Ⅰ,约11 ku),Cystatin(家族Ⅱ,约13 ku),以及Kininogen(家族Ⅲ,约50~120 ku)[6,8]。但动物源CPIs群中,也包括其他类别或家族的成员。已有研究表明Cystatins超家族成员参与机体的多种生理和病理过程,如骨质疏松症[9]、感染与免疫[10-11]、抗菌[12],精子成熟与胚胎发育[13],与肿瘤的侵袭和转移抑制[14-15]等。此外,在食品领域的相关研究表明,CPIs能抑制引起鱼糜凝胶劣变的相关内源性热稳定半胱氨酸组织蛋白酶,改善鱼糜凝胶的质构[16-17]。目前,较多研究集中于陆生动植物CPIs的纯化和活性特征及功能鉴定。关于鱼类CPIs的研究报道较少,仅从几种鱼类组织中纯化了CPIs,包括Cystatins超家族成员及其类似物[3-5,18],以及其他类型的CPIs[19]。对于进化地位和生存环境不同的鱼类,其CPIs在分类、结构、活性特征、生理功能等方面的研究尚存在较多空白。
鲢鱼卵、皮等废弃组织中高低分子CPIs的部分生化特性[18,20-22]和抑菌活性[23],并且通过免疫组化法,鉴定了Cystatin(家族II)在鲤科鱼建鲤肝胰组织中的分布和定位[24]。但是对草鱼肝胰中CPIs及其特性的研究,目前仍未见报道。为此,本研究拟从草鱼肝胰中分离CPIs,并对其活性、分子量分布等基本特性及可能的家族类型进行鉴定,以便为后续开展深入的分离纯化及分析工作奠定基础。
1 材料与方法
1.1材料与仪器
草鱼肝胰组织2014年5月采集于雅安鑫禧水产市场,草鱼体重1000 g;样品于冰上运回实验室后立即液氮速冻,-80℃冻存,用前4℃解冻;荧光合成肽(Z-Phe-Arg-MCA)、偶氮酪蛋白(Azocasein)、木瓜蛋白酶(Papain)、荧光标品AMC、苯甲基磺酰氟(PMSF)、明胶、ASP-ARG-VAL-TYR-ILE-HIS-PROPHE(0.573 ku)、TYR-GLY-GLY-PHE-MET(1.046 ku)、乳链菌肽(3.35 ku)、细胞色素C(13 ku)、胰蛋白酶(23.3 ku)、胃蛋白酶原(43 ku)、牛血清白蛋白(66 ku)、r-球蛋白(150 ku)、蓝色葡聚糖-2000(200 ku)、牛血清白蛋白(BSA)、十二烷基硫酸钠(SDS)、丙烯酰胺(Acr)、甲叉双丙烯酰胺(Bis)、过硫酸铵(Aps) 美国Sigma公司;Pefabloc SC德国Roche公司;蛋白浓度试剂盒南京建成生物工程研究所;宽分子量蛋白标品(6.5~200 ku) 日本Takara公司;中分子量蛋白标品(14.4~94 ku) 北京天根;辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、DAB辣根过氧化物酶显色试剂盒、PVDF膜(0.45 μm) 碧云天生物技术研究所。
Scientz-IID超声波细胞粉碎机苏州江东精密仪器有限公司;B4i-BR4i Jouan大容量高速冷冻离心机、Varioskan全波长荧光/比色扫描读数仪、Powerdry PL3000真空冷冻干燥设备美国Thermo Scientific公司;TSK G2000 SWXL凝胶过滤高效液相柱日本TOSOH;LC-2010C HT高效液相色谱仪日本SHIMADZU;Mini Protein电泳槽、PowerPac 3000电泳电源、Mini Trans-Blot电转印槽、Gel Doc 2000凝胶成像系统美国Bio-Rad公司;Ultra-8050超滤杯美国Millipore公司。
1.2实验方法
1.2.1草鱼肝胰中CPIs的粗提取草鱼肝胰中CPIs的提取方法在Matilde[25]的方法的基础上做适当改进,方法如下:草鱼肝胰(约30 g)4℃解冻后于冰上用剪刀充分剪碎,加入4倍体积的提取缓冲液(含5 mmol/L的PMSF,100 mmol/L Tris,3 mmol/L EDTA-Na2的磷酸盐缓冲液,pH7.5)超声破碎(30%功率)至样品澄清,离心(10000×g,20 min),取上清液用四层纱布过滤,滤液经1 mol/L NaOH调节pH至8.7,50℃水浴加热处理1 h后再用1 mol/L HCl回调至pH7.0。随后离心(10000×g,20 min)取上清得到肝胰CPIs粗提液。样品液氮速冻后,于-80℃保存,使用前于4℃解冻。以上步骤均在4℃操作,分别以偶氮酪蛋白和ZPhe-Arg-MCA为底物,测定各步骤所得粗提取液的活性。
1.2.2蛋白质量浓度测定采用Bradford[26]方法,按照蛋白浓度试剂盒说明各步骤提取液的蛋白浓度。
1.2.3偶氮酪蛋白法测CPIs抑制活性根据Li等[5]方法,利用偶氮酪蛋白法监测粗提各步骤活性。调节CPIs的加入量(1~100 μL),使测得的对木瓜蛋白酶的抑制率在30%~70%之间[27]。CPIs抑制活性单位定义为:反应条件(37℃、pH7.0)下,440 nm处吸光值降低0.01即为一个单位。
1.2.4荧光合成肽底物法测定CPIs抑制活性参考Anastasi等[28]和Barrett等[29]的方法,利用灵敏度高的Z-Phe-Arg-MCA法监测凝胶高效液相色谱洗脱物对木瓜蛋白酶的抑制活性。激发波长360 nm,发射波长440 nm。调节Cystatins的加入量(1~120 μL),使测定的抑制率在30%~70%之间[27]。一个酶活单位定义为:在反应条件(40℃、pH6.8)下,能够在1 min内水解底物并释放出1 nmol AMC产物的酶活性量(1 nmol AMC/min)。一个抑制活性单位定义为:抑制1个单位的酶活性。
1.2.5凝胶高效液相色谱法纯化鉴定CPIs凝胶过滤高效液相柱(7.8 mm×30 cm,5 μm,125 Å)用bufferA(含0.1 mol/L Na2SO4和0.05%NaN3的0.1 mol/L的PBS缓冲液,pH=6.7)平衡。将浓缩(截留分子量3 ku的超滤膜)的草鱼肝胰CPIs提取液透析(截留分子量3 ku的透析袋)、微滤(0.22 μm的微滤膜)后上柱,上样量为100 μL,用Buffer A以0.5 mL/min的流速进行洗脱。每0.5 min收集一管,采用荧光合成肽底物法监测收集液的CPIs抑制活性。以蓝葡聚糖-2000测定凝胶过滤高效液相的空体积V0,分别以ASP-ARG-VALTYR-ILE-HIS-PRO-PHE(0.573 ku)、TYR-GLY-GLYPHE-MET(1.046 ku)、乳链菌肽(3.35 ku)细胞色素C(13 ku)、胰蛋白酶(23.3 ku)、胃蛋白酶原(43 ku)、牛血清白蛋白(66 ku)、γ-球蛋白(150 ku)作为标准蛋白,相同条件下进行色谱分析,求得各自的洗脱体积Ve。以Ve与V0的比值作为纵坐标(y),标准蛋白分子质量对数为横坐标(x)作图,求得凝胶过滤高效液相色谱分离的标准曲线。然后根据该标准曲线分析提取的草鱼肝胰中CPIs分子量分布情况。
1.2.6CPIs的SDS-PAGE及明胶底物-SDS-反相酶谱鉴定草鱼肝胰粗提取液中CPIs的SDS-PAGE电泳参考Laemmli[30]的方法。采用4%浓缩胶和14%分离胶。每泳道上样20 μL。考马斯亮蓝R-250染色后,脱色液(95%乙醇、冰醋酸、蒸馏水体积比4.5∶0.5∶5)脱色至背景颜色消失,条带清晰为止。其明胶底物-SDS-反相酶谱分析法在Li等[5]的方法的基础上做适当改进,不同之处在于,根据李树红等[21]前期的报道,需另以比样品浓度稍高的BSA做CPIs反相酶谱电泳的对照。复性后的凝胶用含0.4 mg/mL木瓜蛋白酶的50 mmol/L磷酸盐缓冲液(pH7.0)在4℃反应1 h,随后用含1%明胶的50 mmol/L的磷酸盐缓冲液(pH7.0)在37℃反应12 h,染色脱色同SDS-PAGE。
1.2.7CPIs免疫蛋白印记法鉴定根据李松等[24]的方法制备建鲤Cystatin(家族II)的抗血清,效价为1∶512000。收集凝胶过滤高效液相纯化所得的小分子CPIs活性部分,真空冷冻干燥后上SDS-PAGE,分离胶浓度17%,然后湿转膜至PVDF膜。PVDF膜于封闭液(含5%BSA的TBST)中室温封闭2 h;加入1∶500稀释的Cystatin小鼠抗血清,4℃孵育过夜,用TBST漂洗4次,每次10 min;加入1∶1000稀释的辣根酶标记的羊抗小鼠抗体,37℃孵育1 h;TBST液漂洗4次,每次10 min;取出膜进行DAB显色。
2 结果与讨论
2.1偶氮酪蛋白法及荧光合成肽法监测CPIs抑制活性
在粗分离过程中,分别采用偶氮酪蛋白法和荧光合成肽法测定草鱼肝胰粗提取各步骤中CPIs抑制活性。结果发现采用两方法的常规操作方式,均无法准确监测到各步骤CPIs抑制活性,因其CPIs抑制反应的对照管值,即偶氮酪蛋白法的0.07、0.032(表1)和荧光合成肽法的68.06、51.44(表2)都分别远高于两种方法中木瓜蛋白酶酶反应的对照管值0.009(表1)和6.01(表2)。其原因可能是在成分相对复杂的草鱼肝胰粗提液中存在同样能够水解偶氮酪蛋白和ZPhe-Arg-MCA的干扰酶类,如热稳定的丝氨酸蛋白酶(胰蛋白酶)活性[31-34]等,在50℃加热和较高浓度(5mmol/L)的PMSF(其正常工作浓度0.1~1mmol/L)下,仍没有得到充分的失活。
针对上述草鱼肝胰组织提取液中存在明显的干扰CPIs活性测定因素,本实验分别采用两种改进的方法进行测定,即其一向草鱼肝胰粗提液中,加入足够浓度的丝氨酸蛋白酶不可逆抑制剂PMSF或Pefabloc SC(已知该两种抑制剂在高浓度下,对木瓜蛋白酶酶活性无影响),25℃反应30 min;其二,将草鱼肝胰粗提液在90℃下加热5 min。然后再分别按照偶氮酪蛋白法和荧光合成肽法常规操作顺序进行反应。结果发现,当粗提液中加入终浓度0.4 mmol/L的Pefabloc SC或40 mmol/L PMSF时,或90℃加热5 min后,各步骤的CPIs抑制反应对照管值0.017、0.018和9.14、7.34,都已经接近或等于木瓜蛋白酶酶反应的对照管值0.009(表1)和6.01(表2)。但是由于40 mmol/L浓度下PMSF已经无法彻底溶解,因此说明该方法可行性差(该法的测活数据未在表1和表2中列出)。
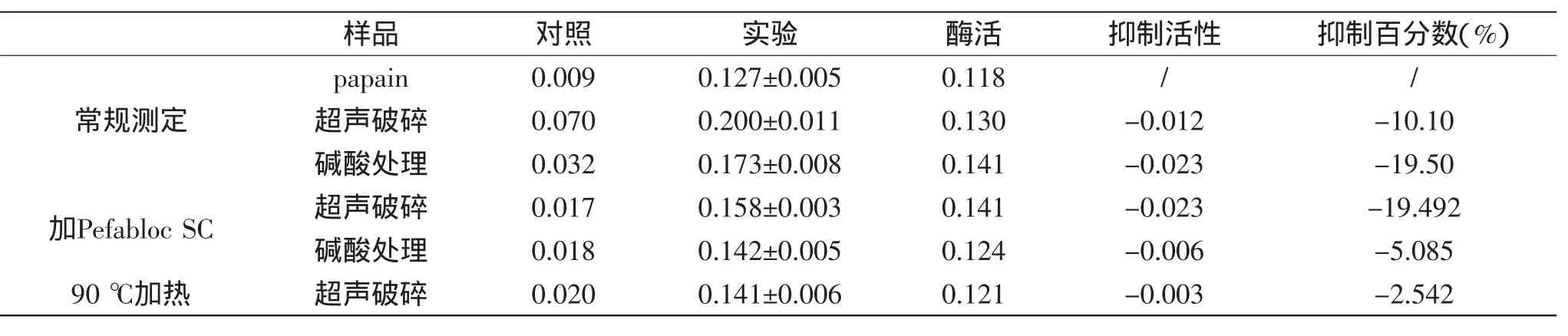
表1 偶氮酪蛋白法测定草鱼肝胰粗提各步骤CPIs活性(n=3)Table 1 Inhibitory activities of CPIs of the crude extracts from Grass carp hepto-pancreas by azocasein(n=3)

表2 荧光合成肽法测定草鱼肝胰粗提各步骤CPIs活性(n=3)Table 2 Inhibitory activities of CPIs of the crude extracts from Grass carp hepto-pancreas with Z-Phe-Arg-MCA(n=3)
此外,还发现对于偶氮酪蛋白法,无论采用哪种测定方式,其CPIs抑制反应测得的酶活值,即0.130、0.141、0.141、0.124、0.121(表1)均反而高于木瓜蛋白酶酶活值0.118,无法正常监测CPIs抑制活性,可能是草鱼肝胰粗提液中仍存在其他能够水解偶氮酪蛋白底物的耐热性非丝氨酸蛋白酶。相对于Z-Phe-Arg-MCA,偶氮酪蛋白是更为广泛的酶类(即所有可水解酪蛋白的内切蛋白酶)的底物,除木瓜蛋白酶、胰蛋白酶和胰凝乳蛋白酶外,碱性金属蛋白酶[35],酸性蛋白酶等[36]均可作用于偶氮酪蛋白,而PMSF和Pefabloc SC不能抑制提取液中可能存在的该类蛋白酶的水解作用。而荧光合成肽底物法优于偶氮酪蛋白法,能准确监测各提取步骤的CPIs活性,发现经过碱酸处理后,其CPIs的抑制比活得到了较明显的提高。
2.2凝胶高效液相色谱法纯化鉴定草鱼肝胰中CPIs
草鱼肝胰CPIs粗提液经凝胶过滤高效液相分离后,各组分收集液即使不加Pefabloc SC或PMSF,或不加热处理,采用高灵敏度的荧光合成肽底物法即可监测CPIs抑制活性,这可能是抑制因子CPIs和干扰酶分子量不同,凝胶过滤高效液相使得二者彻底分离开,除去了CPIs活性测定时的干扰因素。
此外,经计算得到标品蛋白在凝胶过滤高效液相上的标准曲线为y=-0.426x+3.399,R2=0.98。根据液相上各目的峰尖(图1)处的Ve与V0的比值,经标准曲线公式测定草鱼肝胰中CPIs主要分布于:12.5 min,超出凝胶过滤高效液相柱计算上限150 ku,可能是CPIs的二聚体形式或复合物形式(活性峰1);15.5 min,98 ku(活性峰2);18.5 min,26 ku(活性峰3)、21~22 min约12 ku(活性峰4)、23~25.5 min约5~1 ku(活性峰5)。可见,在草鱼肝胰中存在着高分子量和低分子量形式的多种CPIs,且高分子量形式的CPIs(>150 ku和98 ku)的抑制活性量明显高于其他各低分子量CPIs(约26、12、5~1 ku)。其原因可能是由于高分子量的kininogen,在某些鱼类中的表达模式与哺乳动物相似,如其在鳗鱼肝脏中表达量最高[37],因此表现出大量CPIs抑制活性。此外,约5~1 ku的活性峰5也表现出CPIs抑制活性。其原因,一方面可能是因为鱼类当中存在多种形式的CPIs,据报道,在鱼类中除发现10~20 ku间的类Stefin(家族I)[4]、Cystatin(家族II)[18,38]外,也证实存分子量更低(6、9、11 ku)Thyropins家族的CPIs[39-40]。另一方面,有文献报道鲤鱼卵巢12 ku的Cystatin(家族II),结构不稳定,容易断裂成5和7 ku的片段[41]。此外,草鱼肝胰组织中含有丰富的热稳定丝氨酸蛋白酶(胰蛋白酶)活性[33-34,36],因此本实验中出现的低分子量CPIs活性峰,还可能是完整成熟形式CPIs发生部分程度的降解,形成了仍保留着活性中心的活性片段。
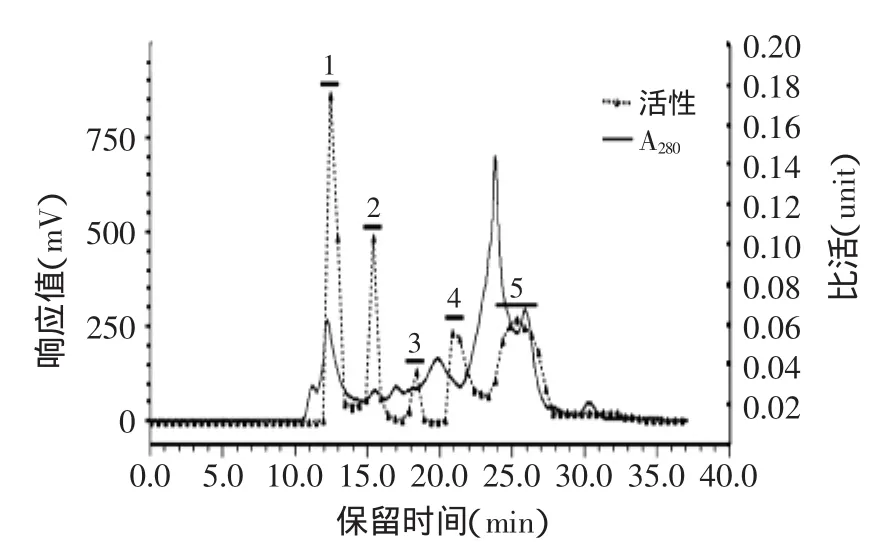
图1 草鱼肝胰CPIs的凝胶过滤高效液相色谱分离Fig.1 Separation of grass carp hepto-pancreas CPIs by HPLC of TSK-GEL G2000SW
2.3草鱼肝胰提取液中CPIs的反相酶谱鉴定
将得到的草鱼肝胰CPIs提取液经明胶底物-SDS-反相酶谱法进行抑制条带的鉴定,以浓度稍高于样品的BSA做对照,如图2所示,发现对照蛋白BSA条带(泳道2)及样品中非抑制蛋白的条带(泳道3),经反相酶谱处理后,被水解殆尽(泳道4和泳道5),而3条明显的CPIs抑制条带(泳道5)则仍然清晰可见。且其在反相酶谱上的分子量分布,也恰好分别对应凝胶过滤高效液相色谱分离所得的12 min的活性峰1,15.5 min的活性峰2(98 ku)条带和19 min的活性峰3(26 ku)。已知kininogen(家族III)的分子量范围在50~120 ku,因此初步判断草鱼肝胰中存在着98 ku和26 ku形式的活性CPIs。而反相酶谱上>200 ku的活性带(对应的>150 ku的活性峰1),可能是鱼肝胰中CPIs与某些蛋白结合形成了复合物,或是CPIs的二聚体形式。有研究表明鲤鱼卵膜Cystatin可以共轭键与卵膜中的两种蛋白成分结合形成60~200 ku的高分子复合物,并没有发现14 ku的Cystatin单体[42]。此外,也有研究表明CPIs,在室温条件下可通过域交换易形成二聚体[43],如利用SDS-PAGE检测重组表达的虹鳟鱼Cystatin C时,也发现其易形成二聚体[44]。
尽管凝胶过滤高效液相色谱分离出活性峰4(约12 ku)、活性峰5(5~1 ku),但是在反相酶谱上这些峰对应的抑制条带,并没有得到鉴定;另一方面,在SDS-PAGE上,观察到有明显的小分子蛋白或多肽形成的弥散状拖尾(见图2泳道3)。因此,推测草鱼肝胰粗提液中可能含有反向酶谱法无法鉴定的小分子形式的CPIs,它们可能是CPIs蛋白降解的片段但其保留了活性中心的结构域,所以仍能发挥抑制作用,或是其他家族或类别的小分子CPIs。
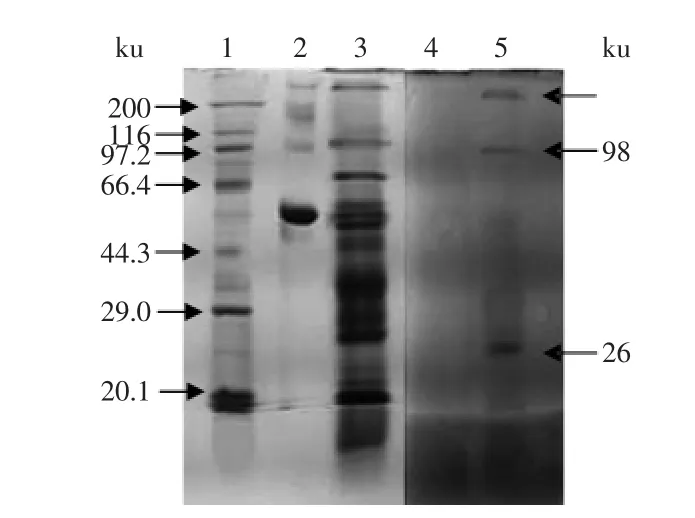
图2 草鱼肝胰中CPIs的反相酶谱分析Fig.2 Gelatin substrate-SDS-reverse zymography of CPIs from Grass carp hepto-pancreas
2.4Western blotting鉴定低分子部分的CPIs
鉴于反相酶谱中不能鉴定<20 ku的低分子CPIs,同时也不清楚其家族归属情况,因此,为了鉴定其中可能的CPIs成分,首先采用鲤科鱼类建鲤的Cystatin多克隆抗体,对高效液相上收集的<20 ku组分(见图3)进行了Western blotting鉴定。结果检测到1条分子量稍大的清晰的特异性条带(如图3B箭头所示,其位置对应图3(A)中约12 ku处的蛋白条带),以及分子量更小(<12 ku)的条带(图3B中菱形箭头所示),显色强度较弱。因此,表明草鱼肝胰粗提液中小于20 ku的低分子部分,的确存在Cystatin(家族II)类型的CPI活性组分或其降解物。

图3 草鱼肝胰CPIs中小于20 ku部分的SDS-PAGE及其Western blotting鉴定Fig.3 SDS-PAGE and Western blotting of CPIs(<20 ku)from Grass carp hepto-pancreas
3 结论
在草鱼肝胰粗提液中加入丝氨酸蛋白酶不可逆抑制剂(40 mmol/L PMSF或0.4 mmol/L Pefabloc SC),或经90℃加热5 min,采用荧光合成肽底物法可准确地监测到CPIs活性的变化。该结果对于后续研究中,准确监测层析纯化过程中CPIs比活性变化和纯化倍数,提供了科学可行的方法。
采用凝胶过滤高效液相色谱法结合反相酶谱及免疫印迹法,初步鉴定出草鱼肝胰组织中存在着不同分子量(98、26、12、5~1 ku)形式的CPIs,并确定存在约12 ku的Cystatin(家族II),而小于12 ku显色条带,可能是该蛋白降解形成的低分子量的活性片段。目前尚需进一步的系统分离纯化,以便对草鱼肝胰中各分子形式的CPIs的家族分类和生物学活性特征进一步探究。
[1]农业部渔业局.2013年中国渔业统计年鉴[M].北京:中国农业出版社,2013:1-145.
[2]杨京梅,夏文水.大宗淡水鱼类原料特性比较分析[J].食品科学,2012,33(7):51-54.
[3]Tzeng S S,Wu H C,Sung W C,et al.Purification and characterization of cysteine proteinase inhibitors from crucian carp Carassius auratus eggs[J].Fishers Science,2009,75(6):1453-1460.
[4]YLÖNEN A,HELIN J,BØGWALD J,et al.Purification and characterization of novel kininogens from spotted wolffish and Atlantic cod[J].European Journal of Biochemistry,2002,269(11):2639-2646.
[5]LI D K,LIN H,KIM S M.Purification and characterization of a cysteine protease inhibitor from chum salmon(Oncorhynchus keta)plasma[J].Journal of Agricultural and Food Chemistry, 2008,56(1):106-111.
[6]Barrett A J,Raelings N D,Davies M E,et al.Cysteine proteinase inhibitors of the cystatin superfamily[J].Proteinase Inhibitors,Elsevier,Amsterdam,1986:515-569.
[7]刘建安.鲫鱼卵细胞硫氢蛋白酶抑制剂之纯化、特性分析及基因选殖[D].台湾:嘉南药理科技大学,2007.
[8]Rajan B,Fernandes J M,Caipang C M,et al.Proteome reference map of the skin mucus of Atlantic cod(Gadus morhua)revealing immune competent molecules[J].Fish&Shellfish Immunology,2011,31(2):224-231.
[9]STRÅLBERG F,HENNING P,GJERTSSON I,et al.Cysteine proteinase inhibitors regulate human and mouse osteoclastogenesis by interfering with RANK signaling[J].FASEB J,2013,27(7):2687-2701.
[10]Vray B,Hartmann S,Hoebeke J.Immunomodulatory properties of cystatins[J].Cellular&Molecular Life Sciences,2002,59:1503-1512.
[11]Aboud L,Ball T B,Tjernlund A,et al.The role of serpin and cystatin antiproteases in mucosal innate immunity and their defenseagainstHIV[J].Americanjournalofreproductive immunology,2014,71(1):12-23.
[12]Kolaczkowska A,Kolaczkowski M,Sokolwska A,et al.The antifungal properties of chicken egg cystatin against Candida yeast isolates showing different levels of azole resistance[J]. Mycoses,2010,53(4):314-320.
[13]Ferrer M,Cornwall G,Oko R.A population of CRES resides in the outer dense fibers of spermatozoa[J].Biology Reproduction,2013,88(3):65.
[14]Han X,An L P,Xu G Y,et al.Impact of amino acid substitutions in domain 5 of high molecular weight Kininogen on suppression of breast cancer cells invasion[J].International Conference on Human Health and Biomedical Engineering,2011,19(22):395-398.
[15]JIN L,ZHANG Y,LI H,et al.Differential secretome analysis reveals CST6 as a suppressor of breast cancer bone metastasis[J]. Cell Research,2012,22(9):1356-1373.
[16]LI D K,LIN H,KIM S M.Application of Recombinant Chum Salmon Cystatin to Alaska Pollock(Theragra chalcogramma)Surimi to Prevent Gel Weakening[J].Journal of Food Science,2007,72(5):C294-299.
[17]Rawdkuen S,Benjakul S,Visessanguan W,et al.Effect of cysteine proteinase inhibitor containing fraction from chicken plasma on autolysis and gelation of Pacific whiting surimi[J]. Food Hydrocolloids,2007,21(7):1209-1216.
[18]宋川,李艳芳,任阳阳,等.鲢鱼卵高分子质量CPI-I的纯化与鉴定[J].食品科学,2012,33(13):100-103.
[19]Okamoto E,Kasahara H,Chiba A,et al.Purification and characterization of two novel cysteine protease inhibitors,Eel-CPI-2 and Eel-CPI-3,in the skin mucus of the Japanese eel Anguilla japonica[J].Fisheries Science,2009,75(2):463-471.
[20]刘玲,蒋然然,彭海鑫,等.鲢鱼卵中低分子CPIs的纯化鉴定及改善鱼糜凝胶强度的效果研究[J].食品科学,2014,35(13):37-42.
[21]李树红,任阳阳,李艳芳,等.鲢鱼CPIs的三种电泳鉴定方法的比较研究[J].食品工业科技,2013,34(21):56-64.
[22]李树红,陈海,蒋然然,等.鲢鱼和草鱼下脚料中CPIs抑制活性比较及其分子量分布的鉴定[J].食品工业科技,2014,21:63-68.
[23]陈海,姜海洋,吴睿,等.鲢鱼重组Cystatin的原核表达、鉴定及对铜绿假单胞菌的抑制作用[J].食品科学,2014,35(21):133-138.
[24]李松,杨立彬,张舒岩,等.建鲤重组Cystatin蛋白的原核表达、鉴定及多克隆抗体制备[J].吉林大学学报:医学版,2014,40(1):204-209.
[25]Parreno M,Pol A,Cadefau J,et al.Changes of skeletal muscle proteases activities during a chronic low-frequency stimulation period[J].Pflugers Arch:European journal of physiology,2001,442(5):745-751.
[26]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[27]WU J,Haard N F.Purification and chracterization of a cystatin from the leaves of methyl jasmonate treated tomato plants[J].Comparative Biochemistry and Physiology Toxicology &Pharacology:CBP,2000,127(2):209-220.
[28]Anastasi A,Brown M A,Kembhavi A A,et al.Cystatin,a protein inhibitor of cysteine proteinases.Improved purification from egg white,characterization,and detection in chicken serum[J].Biochemical Jourmal,1983,211(1):129-138.
[29]Barrett A J,Kirschke H.Cathepsin B,Cathepsin H and Cathepsin L[J].Methods in Enzymology,1981,80(41):535-561.
[30]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[31]陈珊珊,林雄水,翁凌,等.草鱼胰蛋白酶的分离纯化及性质研究[J].集美大学学报:自然科学版,2005,10(4):300-304.
[32]耿莉娜,胡重江,李英文.草鱼肝胰脏中两种胰蛋白酶的纯化及部分性质的研究[J].重庆师范大学学报:自然科学版,2008,25(1):14-19.
[33]黄耀桐,刘永坚.草鱼肠道肝胰脏蛋白酶活性初步研究[J].水生生物学报,1988,12(4):328-333.
[34]胡重江.草鱼胰蛋白酶的纯化及部分性质研究[D].西南农业大学,2005.
[35]王辉,吕加平,迟玉杰.Azocasein法测定嗜冷菌耐热胞外蛋白酶活性研究[J].中国乳品工业,2007,35(7):13-16.
[36]成芳,闫欣,李伟.大鲵胃蛋白酶分离纯化及其性质的研究[J].食品工业科技,2013,34(1):125-128.
[37]Wong M K,Takei Y.Lack of plasma kallikrein-kinin system cascade in teleosts[J].PLOS One,2013,8(11):1-13.
[38]Kim K Y,Ustadi,Kim S M.Characteristics of the protease inhibitor purified from chum salmon(Oncorhynchus Keta)eggs[J].Food Science and Biotechnology,2006,15(1):28-32.
[39]KOIDE Y,NOSO T.The complete amino acid sequence of pituitary cystatin from chum salmon[J].Bioscience,Biotechnology,and Biochemistry,1994,58(1):164-169.
[40]Bradford M M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[41]Tsai Y J,Chang G D,Huang C J,et al.Purification and molecularcloningofcarpovariancystatin[J].Comparative Biochemistry and Physiology B:Biochemistry and Molecular Biology,1996,113(3):573-580.
[42]CHANG Y S,WENG J W,LI C C,et al.Identification of,CystatinasaComponentofCarpChorion[J].Molecular Reproduction And Development,1998,51(4):430-435.
[43]Ohtsubo S,Taiyoji M,Kawase T,et al.Oryzacystatin-II,a cystatin from rice(Oryza sativa L.japonica),is a dimeric protein:possible involvement of the interconversion between dimer and monomer in the regulation of the reactivity of oryzacystatin-II[J]. Journal of Agricultural Food Chemistry,2007,55(5):1762-1766.
[44]LI F,AN H,Seymour T A,et al.Rainbow trout(Oncorhynchus mykiss)cystatin C:expression in Escherichia coli and properties of the recombinant protease inhibitor[J].Comparative Biochemistry and Physiology Part B(Biochemistry and Molecular Biology),2000,125(4):493-502.
Separation and identification of CPIs from grass carp hepto-pancreas and its activity assay
JIANG Ran-ran,LIANG Yu,CHEN Zhi-guang,YANG Jin,LI Xin,DAN Jing,LI Ran,ZHONG Hai-xia,LI Mei-liang,LI Shu-hong*
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
The applicability of the methods of azocasein and fluorescence synthetic peptide in monitoring the inhibitory activity of CPIs(cysteine proteinase inhibitors)from grass carp hepto-pancreas was firstly evaluated. Then the molecular weight distribution and the possible superfamily classification of CPIs were identified by gel filtration HPLC combining with reversed-phase enzyme spectrometry and western blotting methods.The results showed that after adding serine protease inhibitors(40 mmol/L PMSF or 0.4 mmol/L Pefabloc SC)into the crude extract or heating treatment at 90℃for 5 min,the inhibitory activity of CPIs could accurately monitored only by the fluorescence synthetic peptide method.Furthermore,the results of HPLC disclosed that there were several forms of active CPIs with different molecular weight(98,26,12,5~1 ku)in grass carp hepto-pancreas. However,only the CPIs more than 20 ku could be determined by the reverse zymography method.In addition,the results from western blotting revealed the existence of CPIs belonging to Cystatin(family II)with the molecular weight about 12 ku and the developing band less than 12 ku was speculated to be the active fragment degraded from the Cystatin protein.
grass carp hepto-pancreas;cysteine protease inhibitors;activity assay;molecular weight distribution;isolation and identification
TS254.1
A
1002-0306(2015)16-0118-06
10.13386/j.issn1002-0306.2015.16.016
2014-10-27
蒋然然(1990-),女,硕士研究生,研究方向:水产品加工理论与技术,E-mail:ranranj1004@163.com。
李树红(1975-),女,博士,副教授,研究方向:水产品加工理论与技术,E-mail:lish@sicau.edu.cn。
国家自然科学基金青年科学基金项目(31101249);四川省科技支撑计划项目(2014NZ0003)。

