金针菇tps1基因序列分析及不同温度下tps1、tps2基因定量表达研究
刘建辉,张俊玲,李 亮,尚晓冬,*,谭 琦,*
(1.上海海洋大学食品学院,上海201306;2.上海市农业科学院食用菌研究所,上海市农业遗传育种重点开放实验室,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海201403)
金针菇tps1基因序列分析及不同温度下tps1、tps2基因定量表达研究
刘建辉1,2,张俊玲2,李亮1,2,尚晓冬2,*,谭琦1,2,*
(1.上海海洋大学食品学院,上海201306;2.上海市农业科学院食用菌研究所,上海市农业遗传育种重点开放实验室,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海201403)
研究探讨金针菇海藻糖合成相关酶基因及其功能,为进一步揭示其生长发育过程中的变化规律奠定基础。本研究对金针菇6-磷酸海藻糖合成酶基因tps1的序列进行分析,并以金针菇孢子单核体菌株Dan3为实验材料,采用实时荧光定量PCR技术比较了tps1、tps2基因在不同温度变化下金针菇中的相对表达量差异。结果表明,金针菇tps1基因cDNA序列包含1455 bp的ORF,编码1个由484个氨基酸残基组成的蛋白质;对其起始密码子上游2000 bp调控区域进行分析,发现具有典型的热激反应元件(HSE,C4T)和压力反应元件(STRE,AG4)等调控元件;实时荧光定量PCR结果显示,相对于对照组21℃处理,37℃高温及4℃低温处理2 h后,tps1、tps2基因相对表达量均有显著(p<0.05)升高。说明tps1、tps2基因在转录水平上受到温度调控。
金针菇,温度,tpst1,tps2,实时荧光定量PCR,生物信息学
海藻糖由两个吡喃环葡萄糖分子通过1,1-糖苷键连结而成,是一种稳定的非还原性二糖。在生物体内,它是一种典型的应激代谢产物,能够作为一种高效保护物质,帮助细胞成分抵抗外界不利条件。当生物体生长环境良好时,体内不积累海藻糖;而当生物体处于胁迫环境(如低温或干旱)时,体内就会迅速积累海藻糖[1-2],保护多种生物大分子,从而保护生命本身[3-4],而且这些海藻糖会随着不良环境的解除而被降解。真菌中海藻糖代谢主要有两个途径:TPP/TPS[5]和TreP[6]途径。6-磷酸海藻糖合成酶(trehalose-6-phosphate synthase,Tps1)与6-磷酸海藻糖磷酸酯酶(Trehalose-6-phosphate phosphatase,Tps2)是真菌中海藻糖合成途径—TPP/TPS途径中所涉及到的合成酶。编码Tps1和Tps2两种酶的基因分别为6-磷酸海藻糖酶基因(tps1)和6-磷酸海藻糖磷酸酯酶基因(tps2)。其中Tps1是海藻糖合成反应的关键酶,不仅作为代谢酶,也作为压力调控者[7],其调控基因tps1的启动子序列中含有代谢调控元件。张芳[8]通过对南极低温酵母Guehomyces pullulans 17-1菌株中的tps1基因分析发现,在它的启动子中存在2个热激反应元件(HSE)和1个压力反应元件(STRE)的核心序列,通过实验证实,当G.pullulans 17-1菌株处于高温、低温逆境环境时,tps1基因也会被诱导表达,帮助细胞抵御不良环境的影响。
金针菇(Flammulina velutipes(Fr.)Sing)学名毛柄金钱菌,属伞菌目,口蘑科,金钱菌属[9]。金针菇营养丰富,是我国工厂化生产规模最大的食用菌。金针菇的生长发育需要受到复杂的外界胁迫及调控,而海藻糖具有稳定蛋白质天然构象和细胞膜结构完整性的生物学功能,在逆境胁迫下,真菌体内积累大量海藻糖[10-11]。金针菇菌丝生长温度为19~21℃,而原基的诱导需要搔菌处理及相应的低温刺激。探究其生长发育期间海藻糖合成相关酶的代谢调控情况,有助于理解金针菇生长发育过程中营养转化与能量利用、代谢情况及现原基、子实体生长的作用机制,从而了解其抗逆机制及对极端环境的适应机制。1988年,在金针菇中首次发现TreP途径中的海藻糖磷酸化酶(trehalose phosphorylase,TP)[12]。但是目前尚未有金针菇中TPP/TPS途径海藻糖合成相关基因的报道。
本实验室根据金针菇的全基因组序列信息,首次得到海藻糖合成代谢调控途径中涉及的tps1基因与tps2基因序列,针对关键基因tps1的特征序列及其上游序列的调控元件进行了分析,并在此分析基础上探究了在不同温度下金针菇孢子单核体Dan3菌株tps1、tps2的定量差异,以期获得温度变化下金针菇海藻糖合成酶基因的变化,为金针菇中海藻糖的代谢及相关酶基因调控的研究提供理论依据,为揭示其生长发育过程中的抗逆机制及对极端环境的适应机制奠定基础,从而进一步指导金针菇的栽培工艺。
1 材料与方法
1.1材料与仪器
金针菇孢子单核体菌株Dan3由上海市农业科学院食用菌研究所菌种保藏中心提供;Taq DNA Polymerase in Storage Buffer B、pGM®-T Ligation Kit、感受态细胞DH5α天根生化科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTMIITaKaRa公司;AxyPrepTMDNA Gel Extraction Kit、质粒小量制备试剂盒AXYGEN爱思进生物技术有限公司;Redzol试剂盒北京赛百盛基因技术有限公司;PDB马铃薯葡萄糖肉汤碧迪医疗器械(上海)有限公司;LB肉汤培养基青岛生工生物科技有限公司;其他试剂均为市售,分析纯;PDA培养基马铃薯提取物200 g,葡萄糖20 g,琼脂20 g,加蒸馏水定容至1 L,121℃灭菌15 min;马铃薯葡萄糖肉汤培养基、LB肉汤培养基按照说明书配制。
5810R型高速冷冻离心机Eppendorf公司;DHP-9272型电热恒温培养箱上海一恒科学仪器有限公司;制冰机美国格兰特公司;超净工作台苏州安泰空气技术有限公司;UV-1800岛津紫外可见分光光度计日本SHIMADZU公司;EC3 Imaging System凝胶成像系统SYNGENE公司;PCR扩增仪TaKaRa公司;StepOne Plus荧光定量PCR仪Applied Biosystems公司。
1.2实验方法
1.2.1金针菇菌丝的培养与温度处理将金针菇孢子单核体Dan3的菌丝转接到PDA固体培养基上,置于21℃恒温培养8 d。将长满菌丝的培养基加入匀浆器中打碎,按照10%的接种量转接入100 mL PDB培养液中,置于21℃条件下,120 r/min,培养6 d。将培养好的金针菇菌丝分别在37℃与4℃下处理2 h,以21℃正常温度下培养2 h的菌丝作为对照。每组处理设置5个平行,处理后过滤收集菌丝,液氮冻存后备用。
1.2.2菌丝体总RNA的提取和cDNA的合成参照Redzol试剂盒说明书提取金针菇菌丝体总RNA,并用DEPC预处理的水溶解,进行凝胶电泳检测。测定RNA的浓度,依据PrimeScriptTMRT reagent Kit with gDNA Eraser说明书,去除基因组DNA,并反转录成cDNA。
1.2.3金针菇tps1基因同源物搜索与生物信息学分析根据本实验室的金针菇全基因组序列信息,构建本地Blast数据库,使用担子菌中已知的Tps1基因序列在全基因组数据库中运行blastn搜索,获取相应的Scaffold片段核苷酸序列;进行同源性比较,在NCBI中通过BlastX,获取与金针菇同源性高且物种相近的核苷酸比对结果,根据真核生物去除内含子的原则(GT-AG原则),去除核苷酸序列中可能的内含子序列,内含子序列长度通常在30~100 bp之间;在NCBI中再次BlastX,获取金针菇中该蛋白可能的核苷酸保守序列。采用NCBI的ORF Finder程序预测tps1基因的开放阅读框(Open reading frame,ORF);Genetyx对碱基序列进行氨基酸翻译分析;使用ExPASy ProtParam在线分析工具预测Tps1蛋白的理化性质、分子量、等电点;利用SWISS-Model预测和模拟草菇Tps1蛋白质的三级结构;多序列比对由Clustalx完成。
1.2.4实时荧光定量PCR分析
1.2.4.1目的基因编码区的获取根据所获得的tps1基因的核苷酸编码区,用Primer 5.0软件设计荧光定量引物(表1),由上海生工生物公司合成。以GPD(3-磷酸-甘油酯脱氢酶)gpd基因作为内参基因,采用常规PCR扩增tps1和gpd基因片段,并构建用于real-time PCR实验的标准品质粒,质粒由上海生工生物工程股份有限公司测序,具体方法参照汪虹与陈明杰[13]的方法。
1.2.4.2Real-time PCR反应将含有内参基因和目的基因的标准品质粒依次进行10倍稀释,得到5个梯度的标准品浓度,在StepOne Plus荧光定量PCR仪上进行扩增,构建标准曲线,并将所得数据按ΔΔCT法计算tps1基因的相对表达量[14-15]。Real-time PCR反应体系为20 μL:2×SYBR®Premix Ex TaqTMⅡ10 μL,10 μmol/L forward primer 0.4 μL,10 μmol/L reverse primer 0.4 μL,50×Rox 0.4 μL,cDNA模板2 μL,ddH2O 6.8 μL。反应条件为:95℃预变性20 s,1个循环;95℃5 s,60℃15 s,72℃15 s,该过程进行40个循环。每组样品设置4个平行样品孔,并设置无菌双蒸水代替模板作为阴性对照。
1.2.5数据统计与分析实验数据采用IBM SPSS Statistics 19.0进行单因素方差分析,不同小写字母表示差异达到显著水平(p<0.05)。实验结果采用OriginPro 8软件作图分析。

表1 实时荧光定量PCR扩增引物Table 1 Primers used for real-time PCR
2 结果与分析
2.1生物信息学分析
2.1.1金针菇tps1基因结构的分析本文首次获得了金针菇中Tps1酶基因序列的全长,命名为FVTPS1,并提交到了Genbank(登录号:KP192934)。生物信息学分析结果表明:根据内含子保守性连接序列(GTAG原则),推断出所获得tps1基因的DNA序列编码区长度为1956,含有2个内含子(49、52 bp),cDNA序列全长为1855 bp,包含1455 bp的ORF,编码1个由484个氨基酸残基组成的蛋白质(图1)。
对金针菇Tps1起始密码子上游2000 bp调控区域进行分析(表2),该区域分布除有TATA-box、CAAT-box外,还存在防卫和胁迫响应元件(TC-rich repeats)、干旱胁迫响应元件(MBS)、热激反应元件(HSE)和压力反应元件(STRE)等调控元件,预示金针菇Tps1编码基因的转录可能会受到干旱、热激等外界胁迫作用的影响。

表2 金针菇tps1基因启动子区域调控元件分布Table 2 Distribution of putative regulatory elements in the promoter regions of Flammulina velutipes tps1 gene

图1 tps1基因cDNA序列及编码的氨基酸序列Fig.1 Nucleotide sequence and deduced amino acid sequence of tps1 gene
2.1.2金针菇Tps1氨基酸序列分析利用Protparam软件进行在线分析,结果预测所编码蛋白Tps1的分子量为54.30 ku,等电点为5.71,有酸性氨基酸56个,碱性氨基酸44个,理论半衰期大于20 h,不稳定指数为42.80,属于不稳定性蛋白质。经Blast同源性分析发现,该蛋白质序列与多种真菌的TPS1具有很高的同源性(图2),与双色蜡蘑(Laccaria bicolor S238NH82,XP_001880689.1)、糙皮侧耳(Pleurotus ostreatus PC15,KDQ24640.1)、灰盖鬼伞(Coprinopsis cinerea okayama7#130,XP_001836488.2)、双孢蘑菇(Agaricus bisporus var.bisporus H97,XP_006459234.1)、褐腐菌(GloeophyllumtrabeumATCC11539,XP_007868722.1)、的同源氨基酸序列相似性分别达到了89%、88%、89%、87%、85%,表明金针菇的Tps1较为保守。

图2 金针菇Tps1与其它真菌同源氨基酸序列比对Fig.2 Sequence alignment between Tps1 from Flammulina velutipes and other homologous sequences from different fungi
利用SWISS-Model预测和模拟了金针菇tps1蛋白的三级结构(图3)。参考模板为α,α-trehalosephosphate synthase蛋白(PDB:1uqu.1.A),且两者的氨基酸序列相似性达到了33.10%。
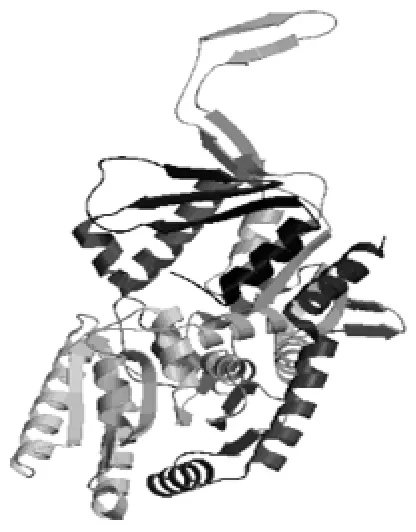
图3 SWISS-Model模拟金针菇Tps1蛋白质三级结构Fig.3 Structure prediction of Tps1 from Flemmulina velutipes by SWISS-Model
2.2不同温度下金针菇单3菌株中tps1、tps2基因表达变化分析
2.2.1RNA提取由图4可见,28S、18S处条带清晰明亮,总RNA完整无降解。经核酸蛋白分析仪检测OD值均在1.7~1.9之间,总RNA纯度较高,浓度均符合实验要求,可用于反转录实验。
2.2.2PCR反应产物PCR反应产物经电泳检测后,用凝胶成像系统检测PCR反应产物的质量。从图5可以看出:tps1、tps2基因的PCR扩增产物经凝胶电泳后条带单一,无引物二聚体和非特异性扩增,大小与预期片段相符。切胶回收目的片段,转化入质粒,测序分析,与本实验室金针菇全基因组数据库中得到的tps1、tps2基因序列比对,同源性100%,确定产物为目的片段,引物符合实验要求。
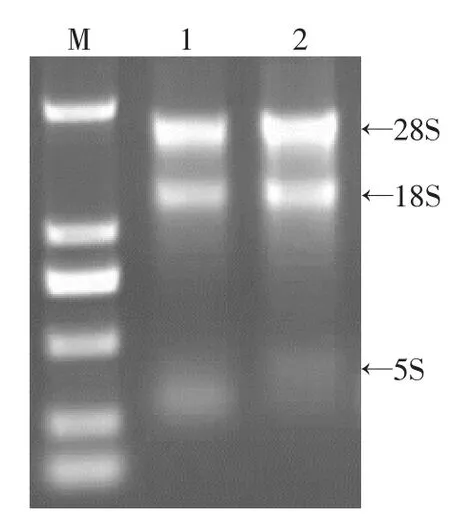
图4 总RNA电泳结果Fig.4 Agarose gel electrophoresis of the total RNA

图5 目的基因PCR电泳图Fig.5 Agarose gel electrophoresis of target gene
2.2.3Real-time PCR图6是tps1、tps2基因扩增后的溶解曲线,分别在84.97、82.3℃时出现单一峰,表明tps1、tps2基因扩增具有特异性,tps1、tps2基因相对定量的结果可信。
不同温度处理下金针菇Dan3菌株的tps1和tps2基因经real-time PCR后得到CT值,并采用ΔΔCT法计算tps1、tps2基因的相对表达量(表3、表4)。金针菇Dan3菌丝受37℃相对高温及4℃相对低温处理2 h之后,相对于对照组(21℃处理),tps1基因与tps2基因的相对表达量均显著(p<0.05)上升。这与Fang Zhang等[16]的研究结果较为接近,当G.pullulans 17-1菌株处于25℃高温培养下,菌体内海藻糖含量、TPS酶活及tps1基因的相对表达量明显升高。而刘秀明[17]在研究肺形侧耳菌丝体内海藻糖合成代谢相关基因时,同样发现,tps1、tps2的mRNA表达水平都受高温胁迫的影响,其中高温胁迫处理6 h,tps1基因的mRNA开始急剧增加;而tps2基因也高效表达,表达量增加。对tps1基因来说,37℃处理组基因表达量升高至21℃对照组的22.22倍,而4℃处理组的表达量升高至21℃对照组的11.71倍。对tps2基因来说,37℃处理组基因表达量升高至21℃对照组的5.99倍,而4℃处理组的表达量升高至21℃对照组的6.99倍。
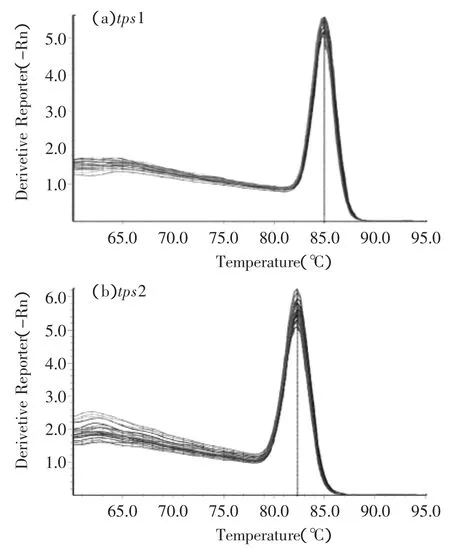
图6 tps1、tps2基因扩增熔解曲线Fig.6 Melt curve of tps1,tps2 gene

表3 不同温度处理下金针菇Dan3菌丝中tps1基因相对表达量Table 3 Relative expression of tps1 gene under different temperature stress in mycelia of Dan3
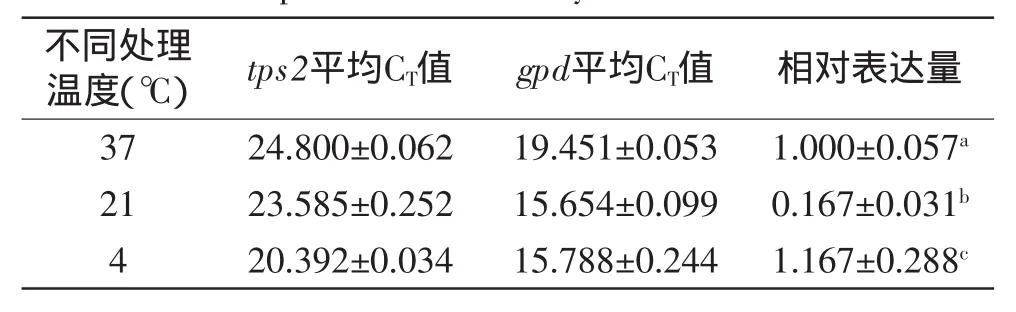
表4 不同温度处理下金针菇Dan3菌丝中tps2基因相对表达量Table 4 Relative expression of tps2 gene under different temperature stress in mycelia of Dan3
3 结论与讨论
本研究首次获得了金针菇中的tps1基因序列,并对其进行了生物信息学分析。通过对金针菇tps1基因起始密码子上游2000 bp调控区域进行分析,发现含有TATA-box、CAAT-box、防卫和胁迫响应元件、干旱胁迫响应元件、热激反应元件和压力反应元件等调控元件,所以推测金针菇Tps1基因的转录可能会受到干旱、热激等外界胁迫作用的影响。据此推测,本文以温度刺激为切入点,以本实验室育得的金针菇Dan3菌株为实验材料,研究了温度胁迫对金针菇中海藻糖的合成代谢途径所涉及的关键基因tps1、tps2基因表达的影响。
tps1和tps2基因都具有合成海藻糖的催化活性。金针菇菌丝的正常培养温度为19~21℃,而在高温37℃、低温4℃胁迫作用下,调控海藻糖合成的tps1和tps2基因的表达量都显著上升(p<0.05),说明tps1和tps2基因在转录水平上受到温度的显著影响(p<0.05),而温度变化可能是通过影响tps1和tps2基因表达量,进而影响酶活;而海藻糖含量可能也会增加,启动胁迫应答机制,帮助细胞成分抵抗外界不利条件,保护生物大分子。通过对金针菇tps1基因的序列分析及温度变化下tps1、tps2基因表达量变化的研究,将有助于深入了解金针菇的温度胁迫应答机制,探究其变化机理,从而得到金针菇的生长发育调控机制,那么改善栽培工艺、缩短生长周期、提高生产质量也将成为可能。本文仅研究了金针菇海藻糖代谢中的合成途径相关酶基因的定量表达,而海藻糖的代谢调控十分复杂,还需要对其他海藻糖代谢调控相关酶及基因以及其在不同温度胁迫下的变化进行研究,才能进一步了解金针菇中海藻糖的代谢调控机制,为揭示金针菇生长发育过程中的抗逆机制及对极端环境的适应机制提供理论依据。
[1]André Van Laere.Trehalose,reserve and/or stress metabolite?[J].Fems Microbiology Letters,1989,63(3):201-210.
[2]Wiemken A.Trehalose in yeast,stress protectant rather than reserve carbohydrote[J].Antonie Van Leeuwenhoek,1992,58(3):209-217.
[3]Hounsa CG,Brandt EV,Thevelein J,et al.Role of trehalose in survival of Saccharomyces cerevisiae under osmotic stress[J]. Microbiology,1998,144:671-680.
[4]Purvis JE Yomano LP,Ingram LO.Enhanced trehalose production improves growth of Escherichia coli under osmotic stress[J].Applied and Environmental Microbiology,2005,71(7):3761-3769.
[5]De Smet KA,Weston A,Brown IN,et al.Three pathways for trehalose biosynthesis in mycobacteria[J].Microbiology,2000,146:199-208.
[6]Saito K,Yamazaki H,Ohnishi Y,et al.Production of trehalose synthase from a basidiomycete,Grifola frondosa in Escherichia coli[J].Applied Microbiology and Biotechnology,1998,50(2):193-1981.
[7]Chi ZM,Zhe Chi Z,Liu GL,et al.Saccharomycopsis fibuligera and its applications in biotechnology[J].Biotechnol Adv,2009,27:423-431
[8]张芳.南极低温酵母Guehomyces pullulans 17-1菌株中海藻糖的合成与调控[D].青岛:中国海洋大学,2013.
[9]暴增海.食用菌栽培原理与技术[M].北京:中国标准出版社,2000:105-107.
[10]Kong W W,Huang C Y,Chen Q,et al.Nitric oxide is involved in the regulation of trehalose accumulation under heat stress in Pleurotus eryngiivar.tuoliensis[J].Biotechnology Letters,2012,34(10):1915-1919.[11]Ferreira A S,Tótola M R,Borges A C.Physiological implications of trehalose in the ectomycorrhizal fungus Pisolithus sp.under thermal stress[J].Journal of Thermal Biology,2007,32(1):34-41.
[12]Yutaka Kitamoto,Hajime Akashi1,Hisashi Tanaka1,et al. α-Glucose-1-phosphateformationbyanoveltrehalose phosphorylase from Flammulina velutipes[J].FEMS Microbiology Letters,1988,55:147-150.
[13]汪虹,陈明杰.草菇冷诱导Cor3基因实时荧光定量PCR标准品质粒和标准曲线的构建[J].食用菌学报,2007,14(3):16-19.
[14]Bubner B,Baldwin IT.Use of real-time PCR for determining copy number and zygosity in transgenic plants[J].Plant Cell Rep,2004,23(5):263-271.
[15]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[16]Zhang F,Wang ZP,Chi Z,et al.The changes in Tps1 activity,trehalosecontentandexpressionofTPS1geneinthe psychrotolerantyeastGuehomycespullulans17-1grownatdifferent temperatures[J].Extremophiles:life under extreme conditions,2013,17(2):241-249.
[17]刘秀明.糙皮侧耳和肺形侧耳热胁迫响应的海藻糖代谢调控研究[D].北京:中国农业科学院,2013.
Sequence analysis of tps1 and relative expression of tps1 and tps2 under different temperature in Flammulina velutipes
LIU Jian-hui1,2,ZHANG Jun-ling2,LI Liang1,2,SHANG Xiao-dong2,*,TAN Qi1,2,*
(1.College of Food Science&Technology,Shanghai Ocean University,Shanghai 201306,China;2.Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences,Shanghai Key Laboratory of Agricultural Genetics and Breeding,Key Laboratory of Edible Fungi Resources and Utilization(South),Ministry of Agriculture,P.R.China,National Engineering Research Center of Edible Fungi,Shanghai 201403,China)
The study aimed at discussing trehalose synthesis-related enzyme genes of Flammulina velutipes and their functions,which could lay the foundation for revealing the changing rule during growth and development process.The sequence of tps1 gene was analyzed and relative quantitative expression changes of tps1 and tps2 in mycelia of Flammulina velutipes strain Dan 3 under temperature variations were measured by using real-time PCR.Results showed that open reading frame of tps1 gene contained 1455 bp encoding a polypeptide of 484 amino acid residues.After analysis of the section of 2000 bp upstream of initiator codon,it was found that the promoter contained typical regulatory elements,STRE(C4T)and HSE(AG4).The real-time PCR analysis showed that the relative expression of tps1 gene and tps2 gene both significantly(p<0.05)increased after 2 hours management of relatively high temperature 37℃and relatively low temperature 4℃.The results confirmed that the expression of the tps1 and tps2 gene was regulated by temperature at transcriptional level.
Flammulina velutipes;temperature variations;tps1 gene;tps2 gene;real-time PCR;bioinformatics
TS201.3
A
1002-0306(2015)16-0173-06
10.13386/j.issn1002-0306.2015.16.027
2014-10-13
刘建辉(1991-),女,硕士研究生,研究方向:食药用菌遗传与育种,E-mail:709956413@qq.com。
谭琦(1963-),女,博士,研究员,研究方向:食用菌遗传育种,E-mail:syj0@saas.sh.cn。尚晓冬(1973-),男,博士,研究员,研究方向:食用真菌栽培育种,食用菌菌种、产品质量检测方法探索研究,E-mail:xdshang@163.com。
国家科技支撑项目(2013BAD16B02);上海市科技人才计划项目(13XD1424700)。

