酵母工程菌S.pombe yAS56的构建及魔芋红茶菌发酵工艺的研究
闯绍闯,龚文秀,李 清,曹媛媛,唐欣昀
(安徽农业大学生命科学学院,安徽合肥230036)
酵母工程菌S.pombe yAS56的构建及魔芋红茶菌发酵工艺的研究
闯绍闯,龚文秀,李清,曹媛媛*,唐欣昀*
(安徽农业大学生命科学学院,安徽合肥230036)
为研究利用魔芋精粉制备魔芋红茶菌的可行性,从约氏梭菌(Clostridium josui)中克隆β-葡聚糖酶基因cel9C,构建粟酒裂殖酵母(Schizosaccharomyces pombe)重组表达质粒pESP-2-2-cel9C,转化构建酵母工程菌,利用工程菌进行魔芋红茶菌发酵。采用析因实验设计和中心组合实验设计方法,以总酸为响应值,优化发酵条件,从7个因素中筛选出2个显著因素:装液量和时间。最佳条件为:绿茶0.4%、蔗糖7.5%、魔芋精粉0.25%、接种量10%、酿酒酵母/酵母工程菌接种细胞浓度比=0.5、装液量98.7 mL、时间124 h。在此条件下红茶菌总酸为(27.88±0.26)g/kg,与预测值相近,较优化前提高41.45%,表明利用魔芋精粉和酵母工程菌制备魔芋红茶菌具有可行性。
cel9C基因,粟酒裂殖酵母,魔芋,红茶菌,优化
魔芋葡甘露聚糖(Konjac glucomannan,KGM)是一种由D-葡萄糖和D-甘露糖以1∶1.6的摩尔比组成的多糖,分子量范围为20~200万,具有独特的亲水性、流变学特性、凝胶性等[1-2],作为食品添加剂,广泛应用于食品工业中[3-5];但是KGM分子量大,粘度高,不易消化,直接食用的营养效果较差[6-8]。与KGM相比,葡甘露低聚糖(Konjac mannoligosaccharides,KMOS)的分子量小,粘度低,易被益生菌吸收利用。KMOS是由KGM降解形成的2~10个单糖单位的功能性低聚糖[9],具有促进双歧杆菌生长、降脂、清除自由基等多种生理功能[10-11],多采用酸解法或酶解法[12-13]制备。近年来有关KMOS作为食品添加剂的研究逐渐增多[14-17]。
约氏梭菌含有一个由11种活性酶组成的纤维小体,从约氏梭菌中克隆获得纤维小体组分之一的cel9C基因,该基因编码内切β-1,4-葡聚糖酶;该酶分子量约73 ku,反应最适温度45℃,最适pH6.0,具有降解KGM的活性[18]。
红茶菌是一种具有多种保健作用的发酵饮料[19],其中含有的D-葡萄糖二酸-1,4-内酯(DSL)[20]是β-葡萄糖苷酸酶(β-glucuronidase)的竞争性抑制剂,具有抗癌作用,已有许多关于红茶菌发酵工艺的研究。近年来,有关不同风味红茶菌制备的研究[21-23]成为新的方向,目前还没有魔芋红茶菌制备的相关报道。本研究利用酵母工程菌表达的β-葡聚糖酶降解KGM制备KMOS,将KGM的降解与发酵过程相结合,简化工艺,提高魔芋红茶菌的营养价值,为制备高浓度低聚糖红茶菌提供理论依据和实验材料。
1 材料与方法
1.1材料与仪器
大肠杆菌TOP10(Escherichia coli)、粟酒裂殖酵母yAS56(S.pombe)、酿酒酵母(Saccharomyces cerevisiae CGMCC1670)、汉逊氏葡糖酸醋杆菌(Gluconacetobacter hansenii CGMCC1671)、质粒pET28a-cel9C、pESP-2-2本实验室保藏;PrimeSTAR Max DNA聚合酶、限制酶、DNA Marker、T4连接酶Takara公司;质粒提取试剂盒等北京三博远志生物技术有限公司;魔芋精粉上海北连生物科技有限公司;其他试剂均为分析纯。
2720型PCR仪美国Applied Biosystems公司;JS-680D型凝胶成像分析仪上海培清科技有限公司;SP-723型可见分光光度计上海光谱仪器有限公司;PT-10P型pH计德国Sartorius公司;HZ-2010K型恒温摇瓶柜太仓市科教器材厂。
1.2培养基
LB培养基(蛋白胨1%、酵母粉0.5%、NaCl 1%、pH7.0)用于培养大肠杆菌,GY培养基(葡萄糖5%、酵母粉1%、自然pH)用于培养醋杆菌和酿酒酵母,EMM[24]+U培养基(Uracil 50 mg/L)用于筛选酵母转化子,EMM+U+CMC(CMC-Na 1.88 g/L)培养基用于筛选表达β-葡聚糖酶的酵母转化子,糖茶水培养基[25](绿茶0.4%、蔗糖5%、自然pH)用于培养红茶菌。
1.3实验方法
1.3.1重组质粒的构建利用Oligo 7.37软件,根据cel9C基因序列设计引物cel9CFP:GGGGGATCCACA ACCGCTTTTAACTATGG;cel9CRP:TTTCCCGGGTCA AATTATCGGTGGTTCTTCAC(分别引入BamHⅠ和SmaⅠ酶切位点)。以pET28a-cel9C为模板,通过PCR扩增cel9C基因。PCR体系为:模板1 μL,上下游引物各2 μL,Primestar MAX Mixture 25 μL,ddH2O补足至50 μL。PCR条件为:98℃变性10 s,55℃退火5 s,72℃延伸30 s,30个循环。PCR纯化产物和质粒pESP-2-2经BamHⅠ和SmaⅠ双酶切回收后连接、转化,经筛选、扩大培养后,提取重组质粒进行双酶切鉴定。重组质粒构建过程如图1所示。

图1 重组质粒pESP-2-2-cel9C的构建Fig.1 Construction of the recombinant plasmid pESP-2-2-cel9C
1.3.2酵母工程菌的构建和筛选
1.3.2.1工程菌的转化和筛选粟酒裂殖酵母感受态细胞的制备与转化参考文献[24,26]进行操作,将5 μL鱼精DNA(20 mg/mL)、3 μL重组质粒和145 μL 50%PEG-3350加入50 μL感受态细胞中,混合后43℃热激15 min;稀释后涂布EMM+U平板培养基,30℃培养4~6 d;挑取转化子接种EMM+U+CMC平板培养基,30℃培养3 d后进行刚果红染色,刚果红染色方法参考文献操作[18],挑选形成透明圈的转化子进行后续实验。
1.3.2.2工程菌胞内酶活的测定接种转化子到50 mL EMM+U培养基中,30℃,120 r/min培养48 h;按2%的接种量接种到新鲜的50 mL EMM+U培养基中,30℃,120 r/min培养72 h;每24 h取样一次测定酶活,以KGM为底物测定CEL9C的酶活力。每个比色管中加入0.9 mL PBS(pH6.0)配制的0.5%魔芋精粉溶液和0.1 mL细胞破碎上清液,45℃反应10 min,沸水浴5 min终止反应,采用DNS法测定还原糖的生成量。酶活力的定义为:在45℃,pH6.0的条件下,每分钟催化KGM生成1 μg葡萄糖所需的酶量为一个酶活力单位(U)。
1.3.3种子液的制备取工程菌一环接种EMM+U培养基,28℃,160 r/min培养48 h;醋杆菌、酿酒酵母种子液的制备参考文献[25]。
1.3.4总酸的测定采用pH电位法测定总酸[27],以乙酸计;考虑发酵时的蒸发损失,对总酸进行折算。
1.3.5单因素实验红茶菌初始发酵条件:时间72 h、绿茶0.4%、蔗糖5%、接种量5%、酿酒酵母/酵母工程菌接种细胞浓度比1∶1、装液量120 mL、温度28℃、转速150 r/min、醋杆菌与酵母等体积接种。
时间分别设为48、72、96、120、144、168 h;绿茶用量分别设为0.2%、0.4%、0.6%、1.0%,培养96 h;蔗糖用量分别设为3%、4%、5%、6%,培养96 h;魔芋精粉用量分别设为0、0.2%、0.4%、0.6%,培养96 h;接种量分别设为3%、5%、7%、10%,培养96 h;酿酒酵母/酵母工程菌接种细胞浓度比分别设为0.5、0.75、1、1.33,培养96 h;总装液量分别设为80、100、120、150 mL,培养96 h。
1.3.6部分因子析因实验根据单因素实验结果,以总酸为响应值,利用Design-Expert(version 8.0.6)软件设计部分因子析因实验,筛选影响总酸的显著因素,析因实验设计因素水平如表1所示。
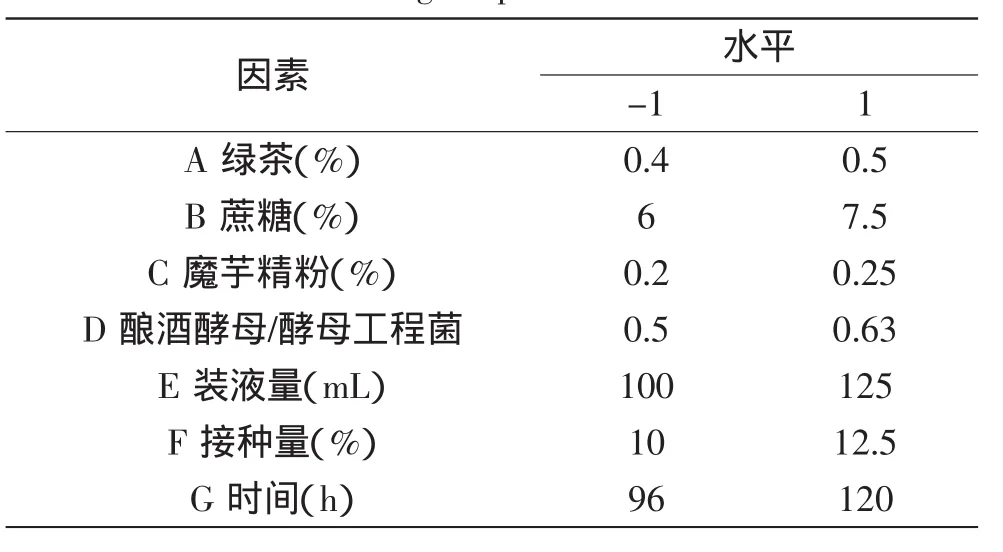
表1 部分因子析因实验因素水平表Table 1 Factors and levels of fractional factorial design experiment
1.3.7中心组合实验以析因实验筛选出的显著因素装液量、时间为自变量,总酸为响应值,利用Design-Expert软件设计中心组合实验,其余因素按效应的正负选择高水平或低水平:蔗糖7.5%、魔芋精粉0.25%为高水平,绿茶0.4%、酿酒酵母/酵母工程菌=0.5、接种量10%为低水平,中心组合实验设计因素水平如表2所示。
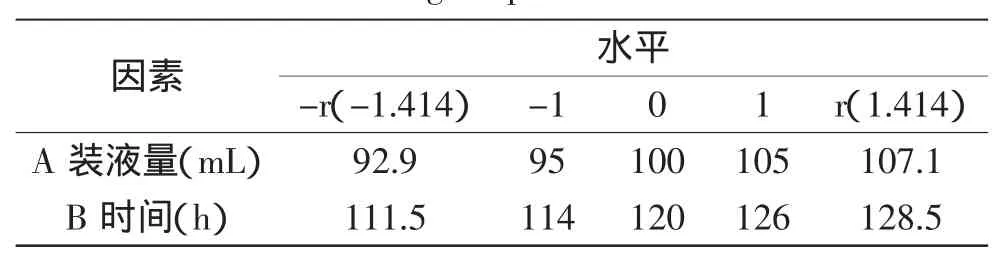
表2 中心组合实验因素水平表Table 2 Factors and levels of central composite design experiment
1.4数据处理
优化实验每个处理重复三次,利用Design-Expert(version 8.0.6)软件处理数据,并分析因素的显著性。
2 结果与分析
2.1重组质粒的构建
以pET28a-cel9C为模板,通过PCR扩增得到长约2.0 kb的条带,大小与预期相符,如图2中2号泳道所示;质粒pESP-2-2双酶切条带如图2中3号泳道所示;大肠杆菌转化子中提取的重组质粒经BamHⅠ和SmaⅠ双酶切后,获得长约9.8 kb的载体pESP-2-2线性片段和2.0 kb的目的基因片段,条带大小与预期相符,结果如图2中4号泳道所示,证明重组质粒pESP-2-2-cel9C成功转入E.coli TOP10宿主菌株中。

图2 cel9C基因扩增产物及重组质粒的双酶切鉴定Fig.2 PCR amplification product of gene cel9C and double enzyme digestion identification of recombinant plasmid
2.2粟酒裂殖酵母工程菌的构建和筛选
2.2.1工程菌的转化和筛选重组质粒转化粟酒裂殖酵母感受态细胞,形成12个转化子,刚果红染色结果表明cel9C基因在12个转化子中均获得有功能活性的表达,染色结果如图3所示。采用玻璃珠法[28]提取酵母工程菌重组质粒并进行双酶切鉴定,结果如图2中5号泳道所示。

图3 酵母转化子cel9C表达的刚果红平板检测Fig.3 Detection of cel9C on Congo red agar plate medium
2.2.2工程菌胞内酶活的测定测定转化子胞内β-葡聚糖酶活,12个转化子的产酶能力如表3所示。结果表明10号转化子具有较好的产酶能力,选择10号转化子进行魔芋红茶菌的发酵研究。
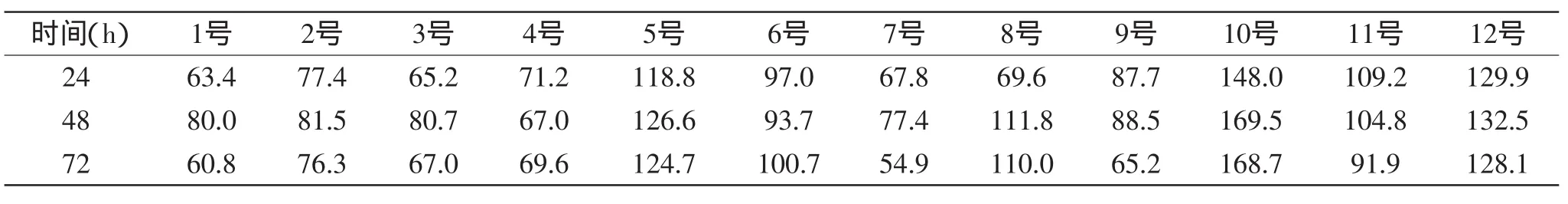
表3 转化子的胞内β-葡聚糖酶活力(U/mL)Table 3 Intracellular β-glucanase enzyme activity of transformations(U/mL)
2.3单因素实验
根据单因素实验结果,同时考虑实际应用,各因素的最佳水平分别为:时间96 h、绿茶0.4%、蔗糖6%、魔芋精粉0.2%、酿酒酵母/酵母工程菌=0.5、接种量10%、装液量100 mL。
2.4部分因子析因实验
部分因子析因实验设计和结果见表4,各因素显著性分析结果见表5。分析结果显示,因素E、G的p值<0.05,为影响总酸的显著因素,选择因素E、G进行中心组合实验。
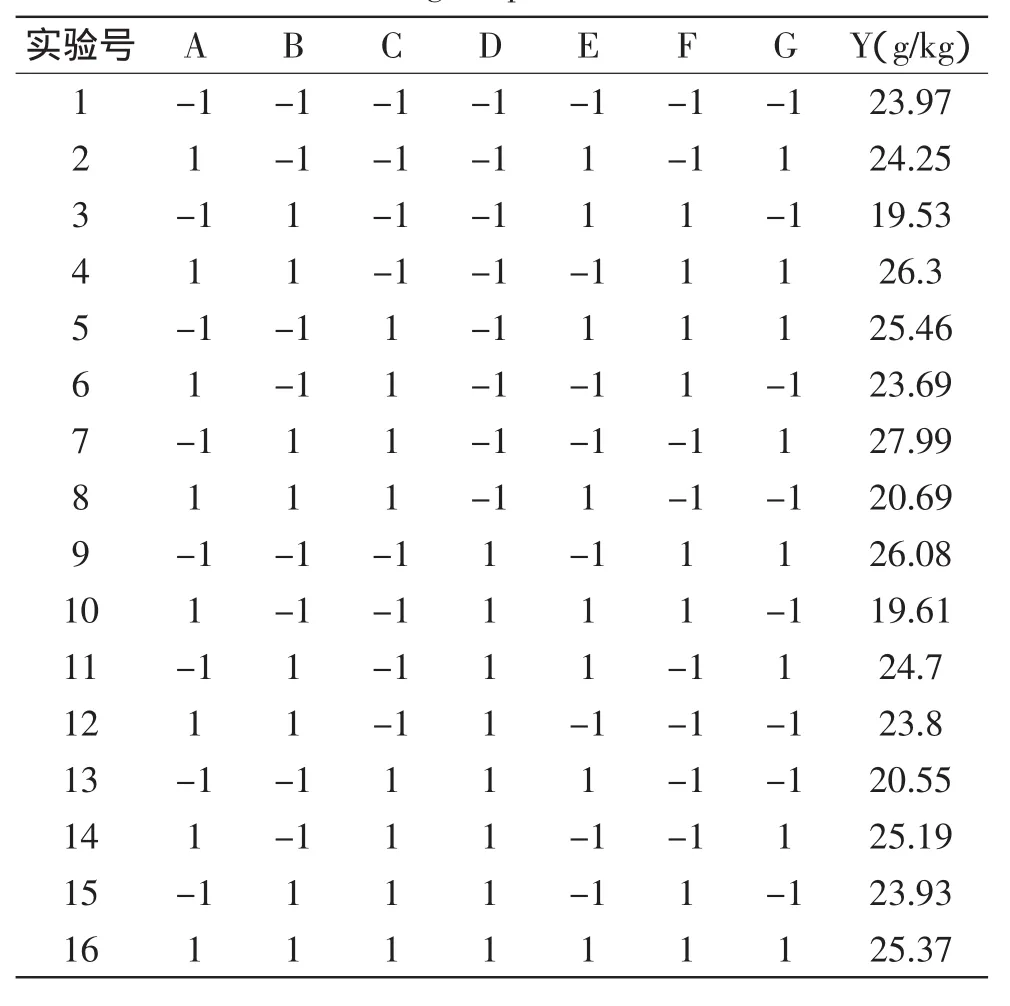
表4 部分因子析因实验设计及实验结果Table 4 Design and results of fractional factorial design experiment

表5 部分因子析因实验设计回归方程方差分析表Table 5 ANOVA analysis results of fractional factorial design experiment
2.5中心组合实验
中心组合实验设计和结果见表6,共计13组实验,其中5组为中心点,实验结果的方差分析如表7所示,得到编码制回归方程:
Y=27.98-0.58×A+0.91×B+0.37×A×B-0.64×A2-0.61×B2
模型p值<0.0001,说明回归显著,R2=0.9622,说明模型的拟合程度较高,可以对结果作出较准确的预测,失拟项不显著,说明模型可靠。利用Design-Expert软件绘制响应面图并得到最佳条件:绿茶0.4%、蔗糖7.5%、魔芋精粉0.25%、接种量10%、酿酒酵母/酵母工程菌=0.5、装液量98.7 mL、时间124 h,总酸预测值为28.35 g/kg,响应面图如图4所示。对优化结果进行验证,共进行5次实验。在此条件下测得总酸为(27.88±0.26)g/kg,较优化前提高41.45%,与预测值的相对误差为1.66%,说明该模型比较可靠。

表6 中心组合实验设计及实验结果Table 6 Design and results of central composite design experiment
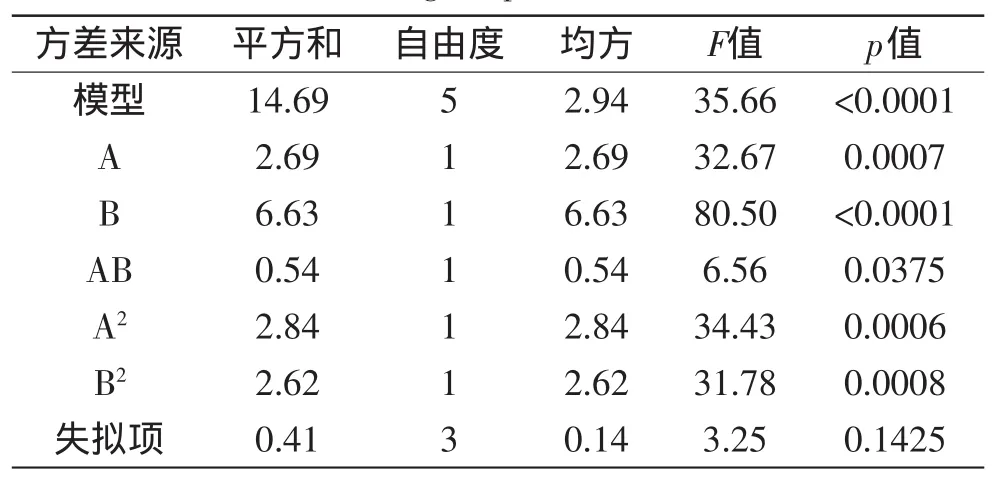
表7 中心组合实验设计回归方程方差分析表Table 7 ANOVA analysis results of central composite design experiment
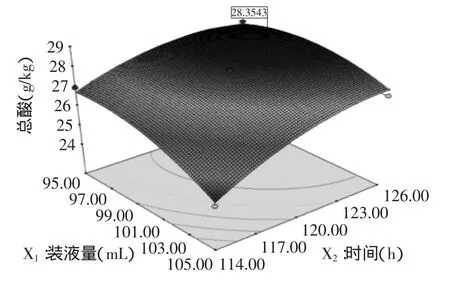
图4 装液量与时间的响应面图Fig.4 Response surface curve of the interaction between load volume and time
3 结论与讨论
目前,魔芋葡甘露聚糖多作为稳定剂、增稠剂,应用于食品工业中,而将其作为功能性营养物质的研究才刚刚起步。有限降解KGM可以增加寡糖的含量和种类,降低人体和肠道益生菌吸收利用的难度,提高魔芋的营养价值。张甫生等[16]利用α-淀粉酶降解KGM,再接种酵母发酵生产魔芋酒;而本研究将KGM的降解与利用过程相结合,简化生产流程,有利于降低生产成本。倪玉佳等[17]构建β-甘露聚糖酶基因毕赤酵母工程菌,利用重组酶降解魔芋胶制备葡甘露低聚糖;与之相比,本研究采用的粟酒裂殖酵母安全可靠,可直接应用于食品生产。郭书贤[21]、王柳玲[22]、宋清鹏等[23]以果汁、果肉为原料制备红茶菌,获得特殊风味和口感的红茶菌,在优化发酵工艺后,提高红茶菌的总酸。本研究在红茶菌制备工艺中添加魔芋精粉,不仅可以提高红茶菌中的总酸,还有利于增加低聚糖含量,提高红茶菌的营养价值和保健功能。
利用β-葡聚糖酶基因酵母工程菌,研究魔芋红茶菌的发酵工艺,优化发酵条件后,获得可调配不同红茶菌饮料的高浓度有机酸红茶菌原液,提高红茶菌工业化开发的可能性。在发酵过程中,酿酒酵母为工程菌提供生长所必需的尿嘧啶,无需额外添加尿嘧啶;魔芋精粉可以增加红茶菌中多糖含量,赋予红茶菌新的口感和风味,同时提高总酸,加快代谢产物积累,缩短发酵时间;利用KGM降解与利用过程相结合的方式,提高魔芋红茶菌的营养价值,简化生产流程,降低生产成本,因此具有广阔的应用前景。
[1]罗清楠,赵国华,庞杰,等.魔芋葡甘聚糖研究进展[J].食品与发酵工业,2011,37(6):137-140.
[2]钟燕,索化夷.魔芋葡甘聚糖的功能及在食品领域的应用[J].中国酿造,2014,33(8):6-9.
[3]李雨露,毕海燕,惠丽娟,等.白梨魔芋搅拌型酸奶的工艺研究[J].食品工业科技,2012,33(20):266-268.
[4]侯方丽,徐金瑞,张名位,等.卡拉胶复配凝胶特性及其在绿茶可吸果冻中的应用[J].食品工业科技,2013,34(18):306-310.
[5]Paquet É,Bédard A,Lemieux S,et al.Effects of apple juicebased beverages enriched with dietary fibres and xanthan gum on the glycemic response and appetite sensations in healthy men[J].Bioactive Carbohydrates and Dietary Fibre,2014,4(1):39-47.
[6]Luz S S,De Campos P L,Ribeiro S M,et al.Current concepts of digestion and absorption of carbohydrates[J].Arquivos de Gastroenterologia,1996,34(3):175-185.
[7]Al-Ghazzewi F H,Khanna S,Tester R F,et al.The potential use of hydrolysed konjac glucomannan as a prebiotic[J].Journal of the Science of Food and Agriculture,2007,87(9):1758-1766.
[8]Chiu Y T,Stewart M.Comparison of konjac glucomannan digestibility and fermentability with other dietary fibers in vitro[J].Journal of Medicinal Food,2012,15(2):120-125.
[9]向进乐,陈文品,刘勤晋.魔芋低聚糖的研究进展[J].中国食品添加剂,2004(1):20-23.
[10]吴拥军,孟望霓.魔芋葡萄甘露低聚糖提取及其发酵产物对耐氧双歧杆菌的促生长作用[J].食品工业科技,2002,23(9):41-43.
[11]陈黎,杨艳燕.魔芋低聚糖降脂作用的初步研究[J].中国生化药物杂志,2002,23(4):181-182.
[12]罗清楠,谭玉荣,刘宏,等.响应曲面法优化酸法魔芋葡甘露聚糖水解工艺[J].食品科学,2012,33(6):119-122.
[13]姚雪,罗学刚,韩本超.魔芋葡甘聚糖酶解过程及各种不同分子量葡甘露低聚糖制备条件的研究[J].食品工业科技,2011(9):97-101.
[14]吴月蛟,邓利玲,张志刚,等.含魔芋胶/魔芋葡甘露低聚糖悬浮饮料的制备[J].食品工业科技,2012,33(15):263-266.
[15]贺雪姣,王洪新,马朝阳,等.β-甘露聚糖酶低限度水解制备适度黏度魔芋胶[J].食品与发酵工业,2011,37(6):102-105.
[16]张甫生,庞杰,李文东.魔芋饮料的加工技术[J].江苏食品与发酵,2002,3(2):37-38.
[17]倪玉佳,周旻昱,欧阳嘉,等.黑曲霉嗜热β-甘露聚糖酶在毕赤酵母中的克隆表达及其魔芋降解产物分析[J].生物技术通报,2014(6):181-185.
[18]宁玉洁.纤维素降解菌中葡聚糖酶基因的克隆表达及活性[D].合肥:安徽农业大学,2013.
[19]Vīna I,Semjonovs P,Linde R,et al.Current Evidence on Physiological Activity and Expected Health Effects of Kombucha Fermented Beverage[J].Journal of Medicinal Food,2014,17(2):179-188.
[20]Wang K,Gan X,Tang X,et al.Determination of d-saccharic acid-1,4-lactone from brewed kombucha broth by highperformancecapillary electrophoresis[J].Journal of Chromatography B,2010,878(3):371-374.
[21]郭书贤,王冬梅,王庆洁,等.芦荟红茶菌复合发酵饮料的研制[J].食品科学,2007,27(12):940-945.
[22]王柳玲,胡卓炎,余小林,等.荔枝果汁红茶茵发酵工艺条件的探讨[J].食品与发酵工业,2013,39(7):208-215.
[23]宋清鹏,胡卓炎,赵雷,等.龙眼果肉发酵红茶菌饮料[J].食品与发酵工业,2014,40(1):216-221.
[24]MorenoS,KlarA,Nurse P.Molecular genetic analysis of fission yeast Schizosaccharomyces pombe[J].Methods in Enzymology,1991,194:795-823.
[25]王硕.醋酸菌的分离与鉴定以及红茶菌培养的研究[D].合肥:安徽农业大学,2008.
[26]Alfa C,Fantes P,Hyams J,et al.Experiments with fission yeast:a laboratory course manual[M].Cold Spring Harbor,New York:Cold Spring Harbor Laboratory Press,1993.
[27]全国食品工业标准化技术委员会.GB/T 12456-2008食品中总酸的测定[S].北京:中国标准出版社,2008.
[28]苑丽娜,王定和,王永杰,等.一种简便的适用于酵母双杂交系统的酵母质粒提取方法[J].生物技术通讯,2012,22(6):864-866.
Construction of engineered yeast S.pombe yAS56 and study of the fermentation techniques of konjac kombucha
CHUANG Shao-chuang,GONG Wen-xiu,LI Qing,CAO Yuan-yuan*,TANG Xin-yun*
(College of Life Science,Anhui Agricultural University,Hefei 230036,China)
In order to study the feasibility of using konjac powder for preparation of konjac kombucha,the gene cel9C coding β-glucanase of Clostridium josui was cloned into the expression vector pESP-2-2 and the recombinant plasmid was transformed into Schizosaccharomyces pombe,to obtain the engineered yeast strain yAS56,and the engineered yeast was used in konjac kombucha fermentation.Using total acid as the response value,the fractional factorial design and central composite design were applied to optimize the fermentation conditions.Two significant factors,loading volume and time,were selected among seven factors.The optimal conditions of fermentation were as following:green tea 0.4%,sucrose 7.5%,konjac powder 0.25%,inoculum size 10%,ratio of cells concentration of Saccharomyces cerevisiae/engineered yeast 0.5,loading volume 98.7 mL,time 124 h.The results of confirmation test with optimal parameters showed that the production of total acid was(27.88±0.26)g/kg,close to the predictive value,being increased by 41.45%compared with the un-optimized conditions.This indicated that using konjac powder and engineered yeast strain for preparation of konjac kombucha was feasible.
gene cel9C;Schizosaccharomyces pombe;konjac;kombucha;optimization
TS275.4
A
1002-0306(2015)16-0198-05
10.13386/j.issn1002-0306.2015.16.032
2014-11-18
闯绍闯(1989-),男,硕士研究生,研究方向:微生物生理学,E-mail:chuang-shaochuang@163.com。
曹媛媛(1980-),女,副教授,研究方向:微生物生理学,E-mail:caoyy721@sina.com。唐欣昀(1951-),男,教授,研究方向:微生物生理学,E-mail:txyah@126.com。
国家自然科学基金青年科学基金项目(41401269);安徽省教育厅自然基金项目(KJ2009A107)。

