响应面法优化葡萄酒泥酵母甘露聚糖提取工艺条件
李 颍,杨 婷,祝 霞,韩舜愈,杨学山
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学生命科学技术学院,甘肃兰州730070)
响应面法优化葡萄酒泥酵母甘露聚糖提取工艺条件
李颍1,杨婷1,祝霞1,韩舜愈1,杨学山2,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学生命科学技术学院,甘肃兰州730070)
目的:优化热水浸提法提取葡萄酒泥酵母甘露聚糖工艺条件。方法:在单因素实验基础上,采用Box-Behnken实验设计,对影响热水浸提甘露聚糖的主要因素进行研究。结果:热水浸提法提取葡萄酒泥酵母甘露聚糖的最佳工艺条件为料液比1∶23(g/mL),浸提温度124℃,浸提时间5 h,浸提次数3次。在此条件下甘露聚糖得率为14.27%,提取效果最佳。结论:此方法绿色环保,成本低,适宜工业化生产。
葡萄酒泥酵母,甘露聚糖,热水浸提,得率
随着葡萄酒产业的快速发展,葡萄酒副产物的资源化开发利用已引起高度关注[1]。据统计每生产100 kL葡萄酒,大约形成2.5~4.0 t葡萄酒泥酵母[2-3]。葡萄酒泥酵母含有丰富的甘露聚糖,占酵母细胞壁干重的35%~45%[4]。甘露聚糖是动物机体发挥细胞免疫和体液免疫的有效诱导物[5],具有结合外源性病原体、抗肿瘤、抗辐射等功效[6],并能作为抗氧化剂来阻断自由基的氧化损伤[7-8]。此外,酵母甘露聚糖应用于葡萄酒中可以起到稳定酒石、蛋白质,提高气味和口感,提升葡萄酒品质,是一种极具开发潜力的多糖[9-11]。
利用葡萄酒泥酵母开发甘露聚糖,不仅可以大大降低原料生产成本,而且可保护生态环境,具有良好的经济和社会效益。传统制备酵母多糖的方法主要以全细胞为原料,不仅酸碱用量大、污染环境,而且会引起多糖降解,影响其生理活性[12]。本实验以诱导自溶后的酵母细胞壁为原料,采用清洁、安全、操作简单、易工业化生产的高温热水浸提法制备酵母甘露聚糖,以甘露聚糖得率为评价指标,通过响应面法优化甘露聚糖提取工艺,旨在为开发利用葡萄酒泥酵母甘露聚糖提供技术支持。
1 材料与方法
1.1材料与仪器
葡萄酒酵母泥甘肃祁连葡萄酒业有限公司;甘露糖标准品上海源叶生物科技有限公司,纯度≥99%;醋酸、醋酸钠、磷酸二氢钠、磷酸氢二钠、氯化钠、三氯乙酸、无水乙醇、丙酮、乙醚、浓硫酸、硼酸均为分析纯。
HH-6型数显恒温水浴锅国华电器有限公司;TDZ5-WS型湘仪离心机长沙湘仪离心机仪器有限公司;SL-1001型电子天平上海民桥精密科学仪器有限公司;PHS-3C型pH计上海雷磁有限公司;TU-1810型紫外-可见分光光度计北京普析通用仪器有限责任公司;电热鼓风干燥箱上海一恒科学仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌器上海申安医疗器械厂。
1.2实验方法
1.2.1工艺流程葡萄酒泥→预处理→诱导自溶→热水浸提→脱蛋白→乙醇醇析(室温下2倍体积乙醇醇沉12 h)→丙酮、乙醚洗涤(2次)→干燥(60℃干燥10 h)→成品。
操作要点:
葡萄酒泥的预处理:收集葡萄酒酒泥,与蒸馏水以1∶1混合,用80目筛筛分,4000 r/min离心15 min。重复上述步骤,直至所得沉淀为白色,上清液无色透明为止,收集湿酵母备用[13]。
自溶:取5.0 g酵母悬浮于30 mL添加质量分数为2%NaCl、pH4.5的醋酸-醋酸钠缓冲液中,47.5℃诱导自溶33 h。
提取:自溶后4000 r/min离心15 min获得酵母细胞壁,称取2.5 g细胞壁,添加蒸馏水配成不同的料液比,并在不同的温度及时间下浸提不同次数。
脱蛋白:向提取后获得的含有甘露聚糖的上清液中加入质量浓度9%的三氯乙酸溶液调节pH为3,4℃静置12 h,以除去其中的蛋白质[14]。
1.2.2单因素实验设计分别对浸提温度、浸提时间、料液比、浸提次数进行单因素实验,重复3次。以甘露聚糖成品得率为评价指标,为响应面优化实验选择因素水平。
1.2.2.1浸提温度对甘露聚糖得率的影响取5份各2.5 g酵母自溶后细胞壁,添加蒸馏水配成料液比为1∶25(g/mL)的悬浮液,分别于85、95、105、115、125℃(高于100℃时用高压灭菌锅实现)下浸提4 h,4000 r/min离心15 min后沉淀再次在相同条件下提取;合并两次上清液,用三氯乙酸溶液调节pH为3,4℃静置12 h后,4000 r/min离心15 min脱蛋白,向上清液中加入2倍体积无水乙醇醇沉12 h,4000 r/min离心15 min取沉淀,分别用20 mL丙酮、乙醚洗涤2次,每次15 min;60℃干燥得甘露聚糖成品。取20 mg样品进行甘露聚糖质量浓度的测定。
1.2.2.2浸提时间对甘露聚糖得率的影响取5份各2.5 g酵母自溶后细胞壁,添加蒸馏水配成料液比为1∶25(g/mL)的悬浮液,于115℃下分别浸提2、3、4、5、6 h;后续步骤同1.2.2.1,取20 mg样品进行甘露聚糖质量浓度的测定。
1.2.2.3料液比对甘露聚糖得率的影响取5份各2.5 g酵母自溶后细胞壁,添加蒸馏水配成料液比分别为1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)的悬浮液,于115℃下高温浸提4 h;后续步骤同1.2.2.1,取20 mg样品进行甘露聚糖质量浓度的测定。
1.2.2.4浸提次数对甘露聚糖得率的影响取5份各2.5 g酵母自溶后细胞壁,添加蒸馏水配成料液比为1∶20(g/mL)的悬浮液,于115℃下浸提4 h,分别提取1、2、3、4、5次;后续步骤同1.2.2.1,取20 mg样品进行甘露聚糖质量浓度的测定。
1.2.3响应面优化实验在单因素实验的基础上,根据Box-Behnken的中心组合实验设计原理,以甘露聚糖得率为响应值,设计4因素3水平的响应面分析实验,优化提取条件。

表1 响应面优化实验因素水平表Table 1 Levels and factors for the response surface optimization test
1.2.4甘露聚糖含量测定方法采用紫外分光光度法[15]。
1.2.4.1标准曲线的制作参照文献[16]的方法,准确配制甘露糖质量浓度分别为25、50、75、100、125、150、175、200 μg/mL的系列溶液绘制标准曲线。
1.2.4.2样品处理称取20 mg左右的酵母甘露聚糖,不断碾磨使其溶解于2.5 mL 72%H2SO4中,室温放置3 h,加蒸馏水使硫酸的最终浓度为4 mol/L,然后100℃酸水解4 h,取出冷却至室温,用NaOH调pH至中性,再用0.2 mol/L pH7.0磷酸缓冲液定容至100 mL并摇匀[16]。
1.2.4.3样品甘露聚糖质量浓度的测定吸取0.2 mL样液,按1.2.4.1步骤操作在280 nm处测吸光值,求得△OD,以标准曲线计算甘露糖质量浓度,最终得出甘露聚糖质量。
1.2.5甘露聚糖得率的计算

1.2.6统计分析采用SPSS 18.0软件进行实验数据分析。
2 结果与分析
2.1标准曲线的制备
以甘露糖为标准样品,紫外分光光度法制作标准曲线如图1所示。标准曲线方程为y=0.0013x+ 0.0021(y为△OD;x为甘露糖质量浓度,μg/mL),相关系数R2=0.9974。
2.2单因素结果与分析
2.2.1浸提温度对甘露聚糖得率的影响由图2可知,在115℃时,甘露聚糖得率达到最大值9.38%,所以选择115℃为提取甘露聚糖的较佳温度。当温度小于115℃时,甘露聚糖得率随温度的升高几乎呈直线上升,说明温度对甘露聚糖的提取影响明显。在温度较低时,很难诱发酵母细胞壁上化学键的充分断裂,影响甘露聚糖的提取;当温度高于115℃时,得率有轻微下降,可能是由于温度过高,破坏了糖的结构,导致甘露聚糖得率下降。
2.2.2浸提时间对甘露聚糖得率的影响由图3可知,浸提时间为4 h时,甘露聚糖得率最大,达到9.81%,因此选择4 h为提取甘露聚糖的较佳时间。当浸提时间大于或小于4 h时,都会使甘露聚糖得率下降,造成该结果可能是由于时间较短时,反应不充分,提取不彻底;时间过长,导致甘露聚糖降解,得率降低。
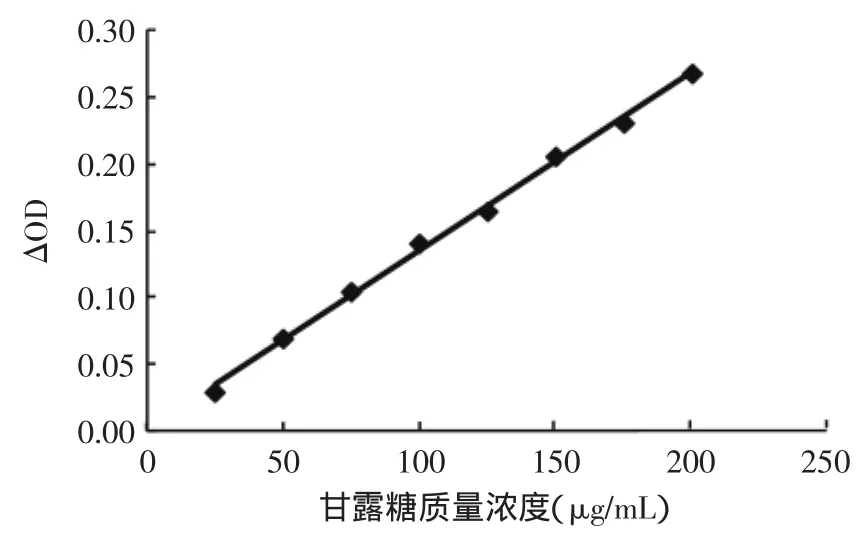
图1 甘露糖标准曲线Fig.1 Standard curve of mannose
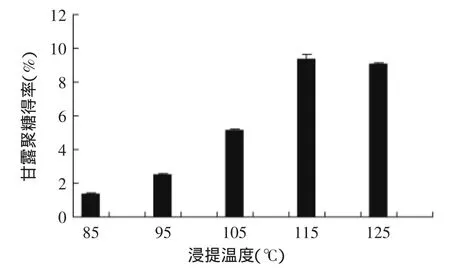
图2 浸提温度对甘露聚糖得率的影响Fig.2 Effect of different temperature on the yield of mannan

图3 浸提时间对甘露聚糖得率的影响Fig.3 Effect of different time on the yield of mannan
2.2.3料液比对甘露聚糖得率的影响由图4可知,当料液比为1∶20(g/mL)时,甘露聚糖得率最大,达到10.08%,所以1∶20(g/mL)为热水浸提甘露聚糖的较佳料液比。料液比小于1∶20(g/mL)时,甘露聚糖得率呈上升趋势,根据固液萃取基本理论,溶剂的增多,有利于溶质的析出。但过大的料液比不仅增加了水的消耗,而且容易导致后续处理过程中溶质的丢失。

图4 料液比对甘露聚糖得率的影响Fig.4 Effect of different solid-liquid ratio on the yield of mannan
2.2.4浸提次数对甘露聚糖得率的影响由图5可知,浸提次数为2次时,甘露聚糖得率最大,达到10.34%,提取效果最好,所以选择2次为提取的较佳浸提次数。当浸提次数小于2次时,提取不彻底,甘露聚糖尚未完全溶于浸提液中;当浸提次数大于2次时,尽管总糖量有所增加,但所测总糖中甘露聚糖的含量却是降低的,究其原因,可能是高温长时间的处理过程导致甘露聚糖的结构发生了破坏,最终使获得的甘露聚糖得率下降。
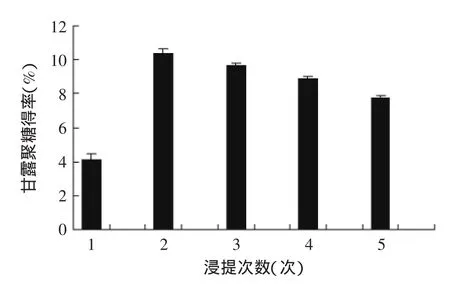
图5 浸提次数对甘露聚糖得率的影响Fig.5 Effect of different extraction times on the yield of mannan
2.3响应面实验设计及结果
2.3.1回归模型的确定利用Design-Expert 7.0软件对表2进行二次多项回归拟合实验和方差分析,反映料液比、浸提温度、浸提时间和浸提次数对甘露聚糖得率的影响,拟合所得多元二次回归方程如下:
Y=-253.0546+3.5787X1+4.7001X2+16.3074X3-18.4378X4-6.5000X1X2+0.0665X1X3-0.0165X1X4+ 0.0198X2X3+0.1803X2X4+1.3050X3X4-0.0922X12-0.0211X22-2.7403X32-1.2553X42
该方程复相关系数R2为0.9785,响应变量R2为0.9571,因此,可以充分描述独立变量对甘露聚糖得率的影响。该模型prob(P)>F值为0.0001,模型极显著,模型拟合程度良好。
2.3.2回归方程的方差分析由表3可以看出,甘露聚糖得率方程的一次项(除X1外)和二次项极其显著(p<0.01),说明各具体因素对响应值的影响不是简单的线性关系。交互项X2X4、X3X4极其显著(p<0.01),说明X2和X4,X3和X4之间的交互作用极显著,整个响应面基于各因素间的交互作用构成。另外,模型的变异系数C.V.为9.84%,证明回归方程拟合程度较好,说明实验具有很高的可信性和准确性。失拟项不显著,说明实验的误差很小。
各因素的影响程度分析,各因素的F值可以反映各因素对实验指标的重要性,F值越大,表明对实验指标的影响越大。从方差分析表可知各因素对甘露聚糖得率的影响程度大小顺序为:浸提温度>浸提次数>浸提时间>料液比。
2.3.3各因素之间的交互作用根据回归方程做出响应面分析图,考察所拟合的响应曲面的形状,反映料液比、浸提温度、浸提时间、浸提次数对响应值的影响。观察曲面的倾斜度确定两因素对响应值的影响程度,倾斜度越高,说明两者交互作用越显著。
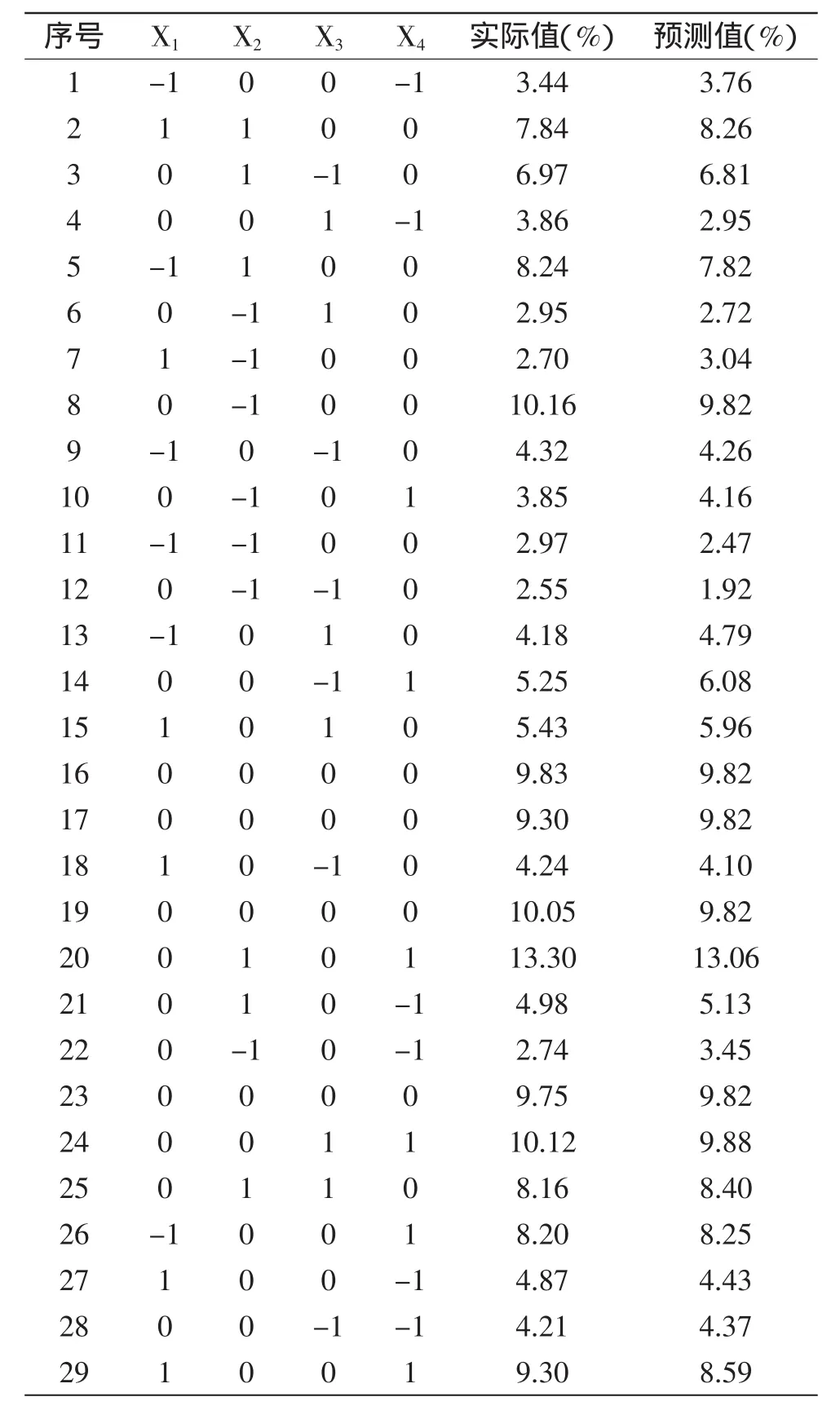
表2 Box-Behnken响应面实验结果Table 2 Results of Box-Behnken response surface experiments
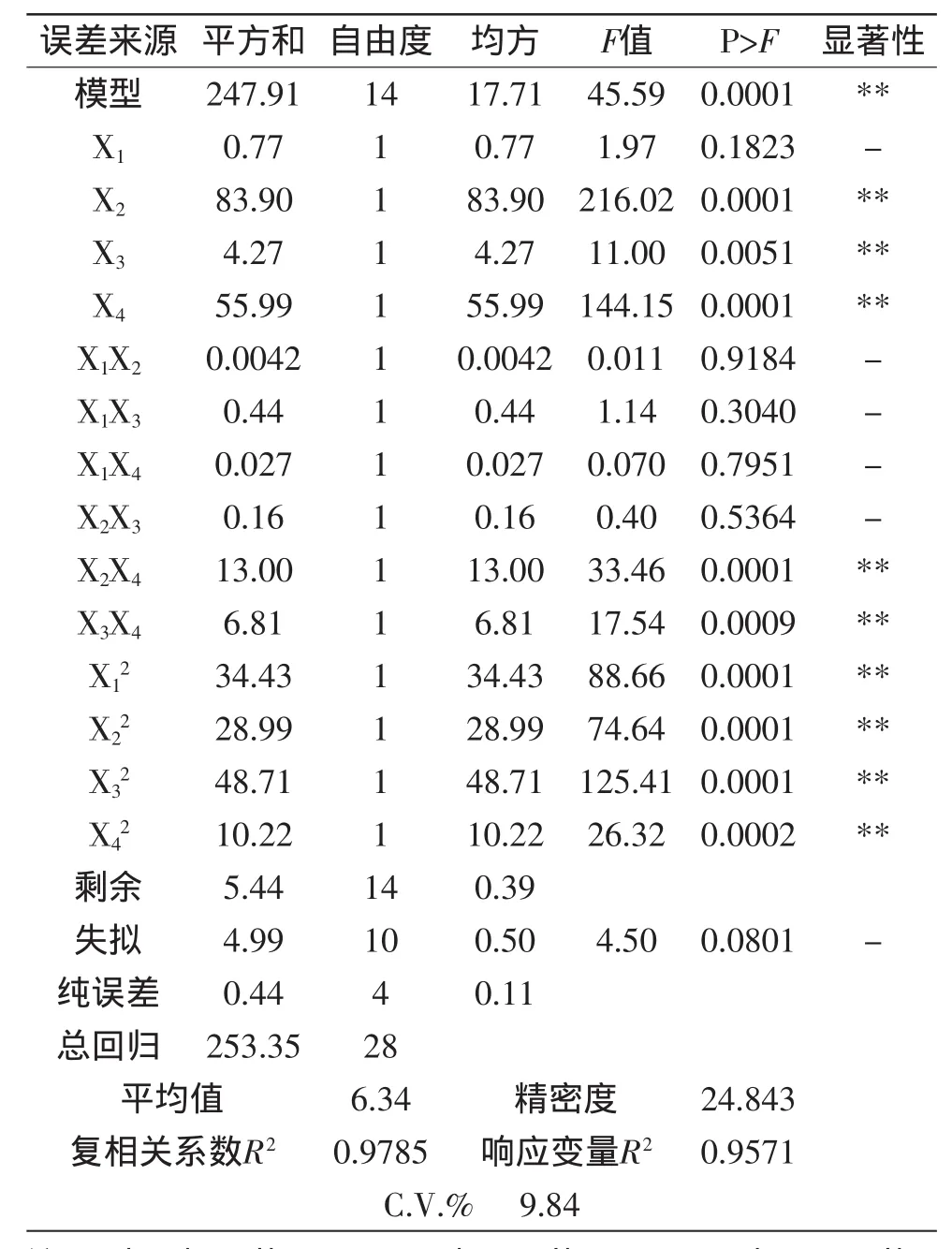
表3 回归方程各项的方差分析Table 3 Variance analysis for each item of the regression equation
由图6及回归方程方差分析可知,因素X2与X4,X3与X4交互作用显著,而X1与X2、X1与X3、X1与X4及X2与X3之间的交互作用不显著。
2.3.4验证实验及结果分析由响应曲面图以及回归方程分析可知,热水浸提法提取葡萄酒泥酵母甘露聚糖的最佳工艺条件为料液比1∶22.6(g/mL),浸提温度123.84℃,浸提时间4.98 h,浸提次数2.63次。为检验响应曲面法所得结果的可靠性,采用上述优化提取条件提取酵母甘露聚糖,考虑到实际操作的便利,将提取工艺参数修正为料液比1∶23(g/mL),浸提温度124℃,浸提时间5 h,浸提次数3次。按上述条件进行实验结果的验证,重复3次实际测得的甘露聚糖的得率分别为13.93%、14.63%、14.25%,平均得率为14.27%,与理论预测值(14.00%)相比,其相对误差约为1.86%。说明通过响应面优化得到的回归方程具有一定的实践指导意义。
3 结论
本实验采用热水浸提法对葡萄酒泥酵母甘露聚糖进行提取,通过单因素实验及Box-Behnken中心组合设计原理以及响应面分析法对提取工艺进行优化,拟合了料液比、浸提温度、浸提时间、浸提次数4因素对甘露聚糖得率的回归模型,经检验证明该模型合理可靠,能较好的预测葡萄酒泥酵母中甘露聚糖的得率。由该模型确定的最优工艺条件为料液比1∶23(g/mL),浸提温度124℃,浸提时间5 h,浸提次数3次,在此条件下获得的甘露聚糖得率最大,达14.27%。通过模型系数显著性检验,得到各因素对甘露聚糖得率的影响大小顺序为浸提温度>浸提次数>浸提时间>料液比。
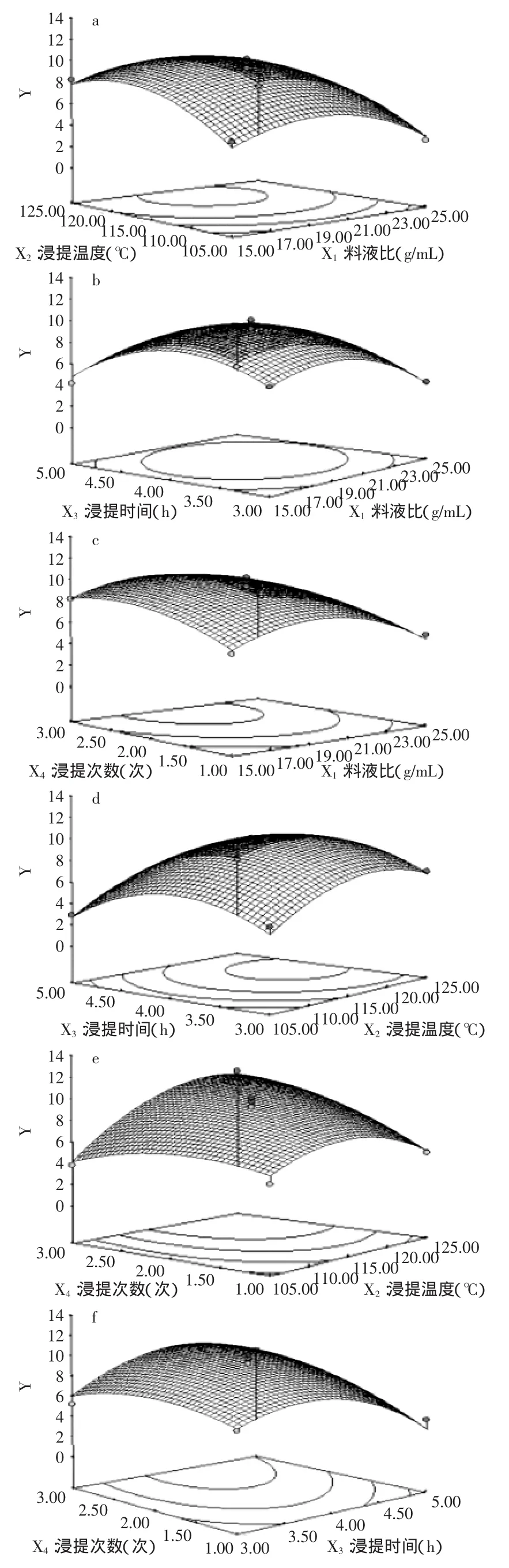
图6 料液比、浸提温度、浸提时间和浸提次数对甘露聚糖得率影响的响应面Fig.6 Effect of response surface of solid-liquid ratio,extraction temperature,time and times on the yield of mannan
[1]张斌,张福庆,郑鹤龄.红葡萄酒“酒脚”的综合开发利用[J].中国葡萄与葡萄酒,2006(4):48.
[2]郑鹤龄,张斌,潘洁,等.葡萄酒泥农业应用效果研究[J].天津农业科学,2006,12(3):47-48.
[3]李莹,苏婷婷,王战勇.葡萄加工副产品的综合利用研究[J].食品科学,2012,28(4):106-108.
[4]周义发,张翼伸,梁忠岩.酵母甘露聚糖的结构确定与核磁共振谱的解析[J].生物化学杂志,1991,7(1):74-78.
[5]LIU H Z,WANG Q,LIU Y Y,et al.Statistical optimization of culture media and conditions for production of mannan by Saccharomycescerevisiae[J].BiotechnologyandBioprocess Engineering,2009,14(5):577-583.
[6]高松.改性魔芋葡甘露聚糖硫酸酯的制备及其性能研究[D].武汉:武汉理工大学,2012.
[7]MACHOVA E,BYSTRICKY S.Antioxidant capacities of mannans and glucans are related to their susceptibility of free radical degradation[J].International journal of biological macromolecules,2013,61:308-311.
[8]KRIZKOVA L,ZITNANOVA I,MISLOVICOVA D,et al. Antioxidantandantimutagenicactivityofmannan neoglycoconjugates:mannan-human serum albumin and mannanpenicillin G acylase[J].Mutation Research,2006,60(1):72-79.
[9]李华.多糖对葡萄酒香气及酒石稳定的作用[J].酿酒,2000,5(14):64-66.
[10]李华,杨新元,胡博然,等.酵母甘露糖蛋白对葡萄酒酒石稳定性影响的研究[J].食品科学,2003,24(10):104-107.
[11]杨新元,李华,刘树文,等.酵母甘露糖蛋白对白葡萄酒酒石和蛋白质稳定性的影响[J].西北农林科技大学学报,2006,6:26.
[12]刘红芝,王强,周素梅.酵母甘露聚糖分离提取及功能活性研究进展[J].食品科学,2008,29(5):465-468.
[13]杜娜,杨学山,韩舜愈,等.葡萄酒泥酵母SOD分离提取工艺条件优化[J].食品工业科技,2013,34(15):242-245.
[14]Huang G L,Yang Q,Wang Z B.Extraction and deproteinization of mannan oligosaccharides[J].Z Naturforsch C,2010,65(5):387-390.
[15]张运涛,谷文英.紫外分光光度法测定啤酒酵母中甘露糖[J].食品与发酵工业,1999,25(5):32-36.
[16]STEFAN F,SANDRO J,EVA A,et al.Optimised quantification method for yeast-derived 1,3-β-D-glucan and α-D-mannan[J].Eur Food Res Technol,2005,220(1):101-105.
Optimization of extraction conditions of mannan from waste wine yeast by response surface methodology
LI Ying1,YANG Ting1,ZHU Xia1,HAN Shun-yu1,YANG Xue-shan2,*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.College of Life Science&Technology,Gansu Agricultural University,Lanzhou 730070,China)
Objective:To optimizing process condition of mannan from waste wine yeast by hot water extraction. Method:The main factors affecting mannan yield were studied by using Box-Behnken experimental design based in single factor experiments.Result:The results showed that the optimal conditions were:solid-liquid ratio 1∶23(g/mL),extracting temperature 124℃,extracting time 5 h,extracting times 3.Under these conditions,the yield of mannan reached 14.27%and the effect of extracting was the best.Concultion:This method was green,beneficial for environmental protection,inexpensive and applied to industrialized production.
wine yeast;mannan;hot water extraction;yield
TS209
B
1002-0306(2015)16-0294-05
10.13386/j.issn1002-0306.2015.16.051
2014-12-05
李颍(1988-),女,硕士研究生,研究方向:农产品加工及利用,E-mail:liying@163.com。
杨学山(1977-),男,副教授,研究方向:生物化学与生物产品研发,E-mail:yangxs@gsau.edu.cn。
甘肃省农业生物技术研究与应用开发项目(GNSW-2013-21)。

