竹茹多糖提取工艺优化及其理化性质分析
齐睿婷,黄菊青,高汪磊,张 英
(浙江大学生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江杭州310058)
竹茹多糖提取工艺优化及其理化性质分析
齐睿婷,黄菊青,高汪磊,张英*
(浙江大学生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江杭州310058)
以蒸汽爆破预处理后的竹茹为研究对象,采用水提醇沉法提取竹茹多糖,在单因素实验基础上进行正交实验优化粗多糖的制备,粗多糖经过复溶、过滤、二次醇沉等处理纯化得到精制竹茹多糖,并对其理化性质进行分析测试。竹茹多糖提取的优化工艺参数为:料液比1∶15(g/mL),提取温度100℃,提取时间2.5 h,粗多糖得率为2.65%;粗多糖进一步精制获得纯度为80.75%的精制竹茹多糖(BSP),得率为2.25%。理化性质分析结果表明,BSP的化学组成主要有多糖(80.75%)、木质素(5.45%)和酚酸(3.21%),BSP的单糖组成主要有木糖和葡萄糖,重均分子量约为7.6 ku,BSP水溶液为假塑性流体。
竹茹,多糖,分离制备,理化性质
竹子是禾本科(Gramineac)竹亚科(Bambusoideae)多年生常绿植物。我国现有竹种39属500余种,是世界上竹类资源最丰富的国家之一[1]。竹茹(Bamboo Shavings),为竹材加工的大宗副产物——“刮青”工艺削下的竹子外表皮部位,实为竹皮,据《中药辞海》记载,其为刚竹属等一些竹种茎秆上刮下的外皮层或其次一层。作为临床常用中药之一,竹茹多用于胃热呕吐、胸膈烦闷等症,但中医药对其成分和药理的研究十分贫乏。近年来,国内外对竹子次生代谢产物的研究和开发关注度不断增强。除竹叶黄酮[2-3]外,多糖也是竹子中重要的生理活性成分,可作为广谱免疫促进剂,还具有抗氧化、抗肿瘤、降血糖等多种生物学功效[4-5]。然而,目前研究主要集中在竹叶多糖[6-8]和竹笋多糖[9-10]上,对竹茹多糖的研究则几近空白[11]。
我国是竹类资源大国,竹材加工过程中产生的大量竹茹常被遗弃,经济效益低,如何对其进行有效开发和综合利用,已成为竹材加工企业关注的热点。作为竹秆(木质纤维素材料)的一部分,竹茹中的多糖成分主要为半纤维素。在植物细胞壁中,半纤维素与纤维素之间通过氢键或范德华力结合,与木质素和蛋白质之间通过化学键(酯键或醚键)连接,因此,半纤维素多糖较难被抽提出来。蒸汽爆破(简称汽爆),可使原料理化结构发生变化,将汽爆应用于竹茹原料预处理后,竹茹多糖的得率显著高于未处理组(p<0.001)[12]。因此本文以汽爆处理后的竹茹作为研究对象,获得精制竹茹多糖(Bamboo-shaving Polysaccharides,BSP),并对BSP的组成成分进行分析测试,以期为竹多糖的研究和开发找到更为合理的部位和高效的分离制备方法,也为竹材加工副产物的高值化利用提供新思路和新途径。
1 材料与方法
1.1材料与仪器
实验原料毛竹(Phyllostachys Pubescens Mazel)的竹茹(Caulis Bamfusae in Taeniam)由浙江遂昌利民药业提供;乙腈(99.9%) 德国默克化工技术(上海)有限公司;芦丁(98%) 上海晶纯生化科技股份有限公司;福林酚试剂、苯酚(≥99.5%),分子量为401300、76900、43500、10500、5000 u的葡聚糖标准品、α-D-葡萄糖(96%)、对羟基苯甲酸(99%)、1-苯基-3-甲基-5-吡唑啉酮(PMP,99%) 美国Sigma公司;考马斯亮蓝试剂盒南京建成生物工程研究所;0.22μm微孔滤膜(水系,聚四氟乙烯) 上海安普公司;其他试剂分析纯。
3K-15离心机德国Sigma公司;R-201旋转蒸发器上海申科机械研究所;SHB-ⅢA循环水式多用真空泵上海豫康科技仪器设备有限公司;FD-1-50型冷冻干燥机北京博医康实验仪器有限公司;BSA124S-CW微量电子天平(0.00001) 瑞士赛多利斯公司;Spectrumlab 22pc型可见分光光度计上海光谱仪器厂;Waters2695高效液相色谱仪、Waters2996紫外检测器,Waters515凝胶色谱仪、Waters2414示差折光检测器美国Waters公司;ZORBAX Eclipse XDB-C18色谱柱美国安捷伦公司;TSK-GEL G4000SWXL凝胶色谱柱日本TOSOH公司;MCR302旋转流变仪奥地利安东帕有限公司;QBS-200B高密度蒸汽爆破机鹤壁市正道生物能源有限公司。
1.2实验方法
1.2.1竹茹原料预处理汽爆方法采用张英[12]的方法进行处理,自然风干后备用。
1.2.2竹茹多糖的提取将经汽爆处理后的竹茹原料用苯-乙醇(v/v,2∶1)混合溶剂进行热回流脱蜡处理(80℃,6 h),于烘箱中烘干(60℃,16 h),备用。称取500 g脱蜡后的原料,在一定料液比与温度下,进行一定时间的热回流提取,过滤后获得浸提液,向滤液中缓慢加入4倍体积的无水乙醇(同时不断搅拌),4℃下静置12 h,收集沉淀,并用80%乙醇充分洗涤;将沉淀溶于40℃蒸馏水中,蒸去残余乙醇,离心,取上清液,冷冻干燥,得到灰白色的竹茹多糖。
1.2.3单因素实验设计
1.2.3.1料液比对多糖得率的影响固定提取温度为100℃、提取时间为2.5 h,考察不同料液比(g/mL)1∶10、1∶15、1∶20、1∶25、1∶30对多糖得率的影响。
1.2.3.2提取时间对多糖得率的影响固定提取温度为100℃、料液比为1∶15(g/mL),考察不同提取时间1、2、3、4、5 h对多糖得率的影响。
1.2.3.3提取温度对多糖得率的影响固定提取时间为2.5 h,料液比为1∶15(g/mL),考察不同提取温度60、70、80、90、100℃对多糖得率的影响。
1.2.4正交实验设计在单因素基础上,以粗多糖得率为指标,通过L9(34)正交实验对竹茹多糖提取工艺参数进行优化,因素水平见表1。
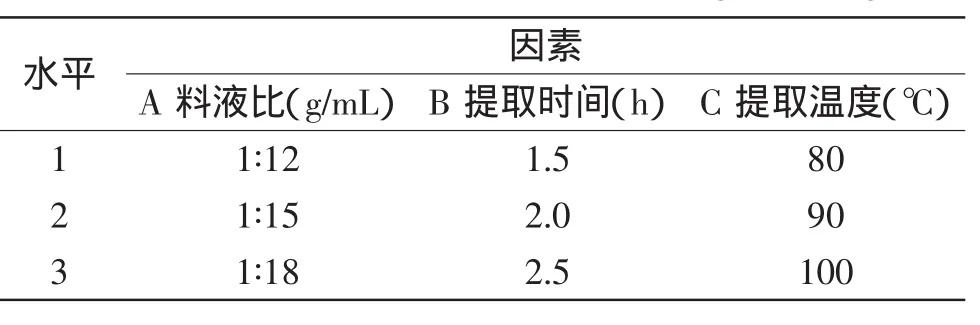
表1 L9(34)正交实验因素水平表Table 1 Factors and levers of L9(34)orthogonal design
1.2.5粗多糖得率的计算采用1.2.2方法提取得粗制的灰白色竹茹多糖,并以脱蜡后的竹茹原料(干基)为基础计算竹茹粗多糖的得率:

1.2.6多糖纯度测定采用苯酚-硫酸法,在Dobois M[13]的基础上略作修改。准确配制0.25 mg/mL葡萄糖标准溶液,分别量取该溶液0.1、0.2、0.4、0.6、0.8、1.0 mL于25 mL比色管中,蒸馏水补至2.0 mL,混匀,加入20 mg/mL苯酚试剂1.0 mL,浓硫酸试剂5.0 mL,立即摇匀,冷却30 min,490 nm波长处测定吸光度,以吸光值为纵坐标、浓度为横坐标绘制标准曲线(得回归方程)。取1.0 mg/mL样品0.1 mL,蒸馏水补至2.0 mL,摇匀,空白用蒸馏水代替样品,按照上述操作步骤,每组平行测试三次,从标准曲线中求取对应的葡萄糖含量,并以换算因子0.9计算多糖含量,并计算多糖纯度:
1.2.7粗多糖的精制参照俞泉宇[14]的方法略作修改。将上述得到的竹茹粗多糖用温水(40℃)重新溶解(浓度约为100 mg/mL),8000 r/min离心10min,取上清液,过0.22 μm微孔滤膜(水系,聚四氟乙烯)后加入乙醇至终浓度为80%左右,置于(4±1)℃的冰箱中冷沉12 h,取沉淀,依次用95%乙醇、无水乙醇进行淋洗,洗至近无色,挥干溶剂后冷冻干燥得BSP。
1.2.8BSP的化学组成成分测定BSP的蛋白质含量测定采用考马斯亮蓝法[15];BSP的酸可溶木质素测定参照Wen J L[16],酸不溶木质素测定参照波钦诺克[17];BSP的黄酮含量测定参照硝酸铝-亚硝酸钠比色法[18];BSP的酚酸含量测定参照福林酚试剂还原比色法[19]。
1.2.9BSP的单糖组成测定采用液相色谱法[20]。
1.2.10BSP的平均分子量测定采用凝胶过滤色谱法[21]。
1.2.11BSP溶液的黏度特性测定参照纵伟[22]的方法略作修改。配制5%的BSP水溶液,置于20℃和50℃水浴中保温30 min后置于校正好的流变仪测定平台,选择直径为25 mm的平板夹具,使平板与平台间距为0.051 mm,启动流变仪软件中的旋转测试模式,恒定温度为20℃或50℃,设置剪切速率为0至25 min-1,启动开始程序,待平板下降平稳后刮去平板外多余样品,继续程序,测定BSP溶液的表观黏度在不同温度下随剪切速率的变化曲线。
1.3统计分析
采用SPSS 21.0软件进行统计分析,数据均为三次测定结果的平均值,采用单因素方差分析(ANOVA)进行多组之间均数的差异性检验。
2 结果与分析
2.1竹茹多糖提取条件的优化
2.1.1葡萄糖标准曲线测得葡萄糖标准曲线如图1所示。由图1可以看出,采用苯酚-硫酸法,葡萄糖在(25~250 μg/mL)质量浓度范围内与OD490值呈良好的线性关系,回归方程为y=0.0035x+0.0735(n=6,r= 0.9971)。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.1.2料液比对竹茹粗多糖得率的影响从图2可以看出,在提取温度为100℃、提取时间为2.5 h时,随着料液比从1∶10(g/mL)增加到1∶15(g/mL),多糖得率呈现上升趋势,当液料比达到1∶15(g/mL)时,多糖得率最高,为1.92%,而当料液比为1∶20(g/mL)时,多糖得率为1.90%,与1∶15(g/mL)时多糖得率无显著差异(p>0.05),可知随着料液比增加,多糖得率基本趋于平稳,主要原因可能是该条件下多糖提取已较为充分,加大料液比,得率得不到显著提高[9]。
2.1.3提取时间对竹茹粗多糖得率的影响图3表明,在提取温度为100℃、料液比为1∶15(g/mL)时,随着提取时间从1 h增加到2 h,多糖得率显著提高(p<0.01),2 h时多糖的得率最高,为1.83%,超过2 h多糖得率反而有些下降,3 h多糖得率降为1.81%(p>0.05),4 h多糖得率降为1.74%(p<0.05),5 h多糖得率降为1.69%(p<0.05)。这可能是因为,随着提取时间的延长,部分多糖在高温条件下发生降解,从而导致其得率的下降[14]。
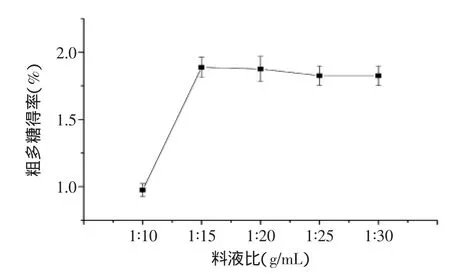
图2 料液比对竹茹粗多糖得率的影响Fig.2 Effect of solid-liquid ratio on extraction yield of crude bamboo-shaving polysaccharides
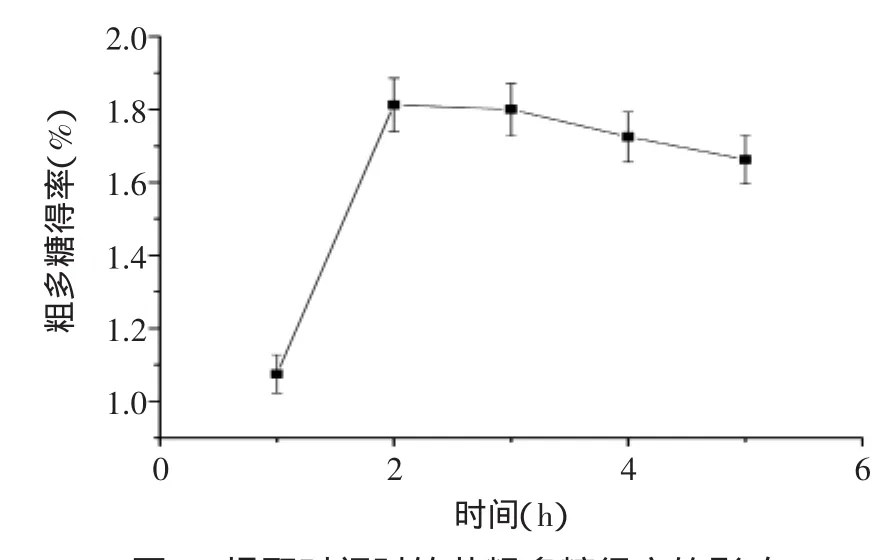
图3 提取时间对竹茹粗多糖得率的影响Fig.3 Effect of time on extraction yield of crude bamboo-shaving polysaccharides
2.1.4提取温度对竹茹粗多糖得率的影响从图4可以看出,提取温度对多糖得率有较大影响,当提取温度从60℃上升到90℃,竹茹多糖得率随温度的升高而较大幅度增加。提取温度达90℃时,竹茹多糖得率已较高,为1.84%,而提取温度从90℃上升到100℃,多糖得率上升至1.858%,与90℃无显著差异(p>0.05),这可能是由于提取温度的增加造成了部分糖苷键的断裂,使部分多糖分解,导致提取出的多糖得率增幅趋于零[14,23]。
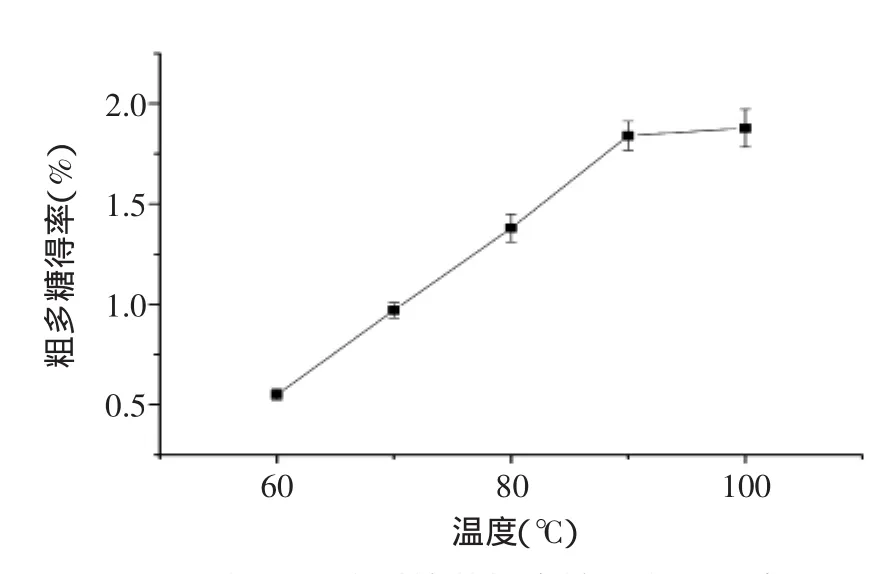
图4 提取温度对竹茹粗多糖得率的影响Fig.4 Effect of temperature on extraction yield of crude bamboo-shaving polysaccharides
2.1.5正交实验结果与分析根据单因素实验结果,选择提取温度90℃,提取时间2 h、料液比1∶15(g/mL)为中间变量进行L9(34)正交实验,实验结果如表2所示。
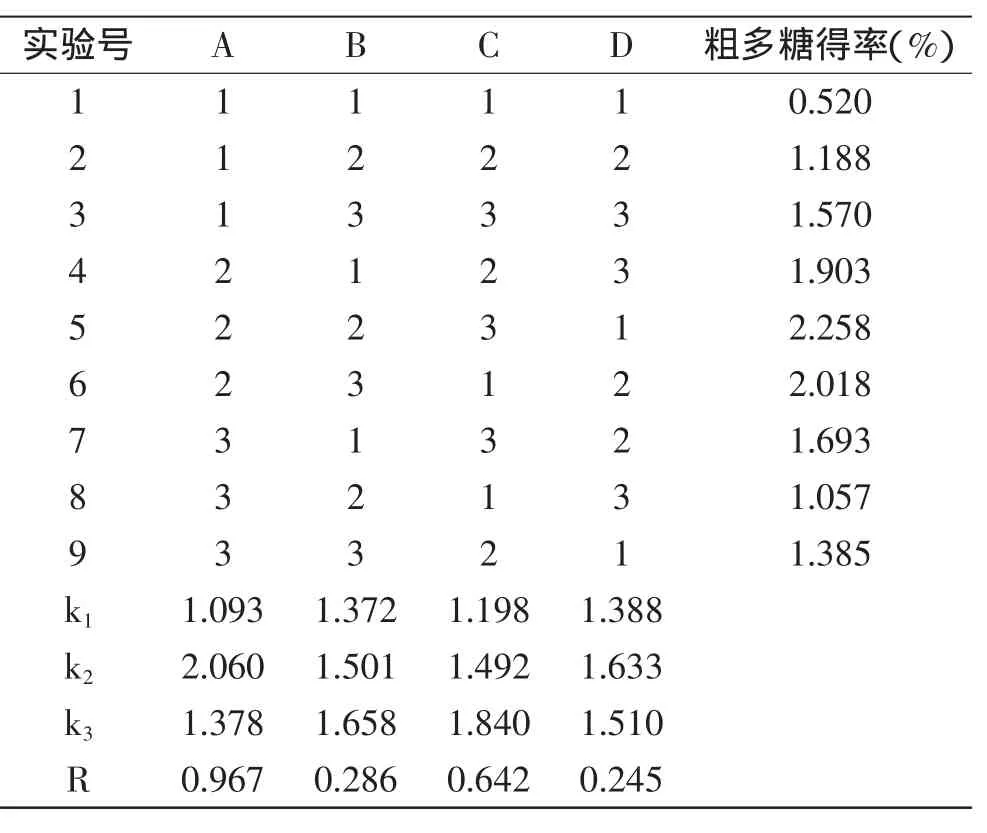
表2 正交实验结果Table 2 Results of orthogonal design
各因素对竹茹粗多糖得率的影响主次顺序为:料液比>提取温度>提取时间,优化的水平组合为A2B3C3,即料液比1∶15(g/mL),提取时间2.5 h,提取温度100℃。
在此优化工艺下,重复实验3次,测得竹茹粗多糖的平均得率为2.65%,纯度为65.56%。根据1.2.7方法精制后,得到BSP的平均得率为2.25%,纯度提高至80.75%。
2.2BSP的化学组成
对BSP的化学组成进行测定,结果如表3所示。从表中可看出,BSP多糖含量为80.75%;纯化过程并未进行脱蛋白处理,蛋白质含量只有0.71%,说明竹茹原料中蛋白含量较低;木质素(酸不溶+酸可溶木质素)含量占了5.45%,还含有3.21%的酚酸和少量黄酮(0.80%),所测组分合计为90.92%。

表3 BSP的组成(%)Table 3 Chemical composition of BSP(%)
2.3BSP的单糖组成
测得BSP的单糖组成如表4所示。由表4可以看出,BSP的单糖组成主要以葡萄糖和木糖为主,以葡萄糖醛酸摩尔浓度百分比记为1,换算得各单糖组成比例为:甘露糖∶葡萄糖醛酸∶葡萄糖∶半乳糖∶木糖∶阿拉伯糖=3.9∶1.0∶23.3∶1.9∶45.3∶1.5。

表4 BSP的单糖组成(摩尔浓度百分比)Table 4 Monosaccharide composition of BSP(molar concentration percentage)
从单糖组成分析,BSP主要由阿拉伯木聚糖和葡聚糖构成。
2.4BSP的分子量及其分布
BSP的凝胶过滤色谱图如图5所示。精制BSP只呈现一个对称峰,说明其纯度较高,分子量分布也相对比较集中,通过软件,得出平均分子量(Mw)约为7.6 ku。
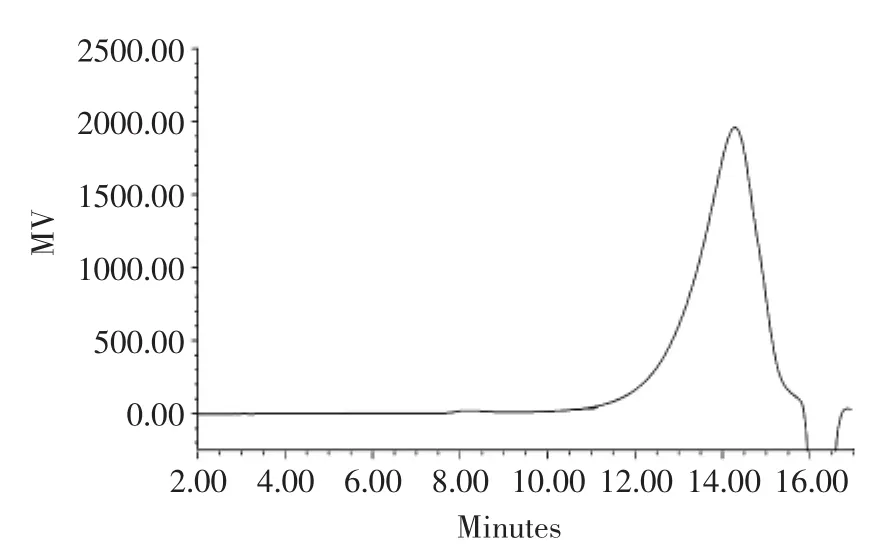
图5 竹茹多糖凝胶过滤色谱图Fig.5 GFC profile of BSP
2.5BSP的黏度特性
测得BSP黏度特性如图6所示。由图6可以看出:a.从单一温度下看,BSP溶液为假塑性流体,即随剪切速率的提高,溶液的黏度呈现下降并最后平稳的趋势,这种现象称为剪切稀化现象。这可能是因为在剪切力作用下多糖分子结构被破坏,从而表现为多糖溶液黏度下降;b.从两个温度比较来看,随着温度升高,BSP溶液的黏度也呈下降趋势。这可能是因为升温过程使多糖结构发生了变化,破坏了多糖分子侧链间的氢键和离子键,多糖降为小分子糖而导致了黏度的下降,并且升温也使得分子热运动加快,分子间距离扩大,从而表现为多糖溶液黏度下降[22]。
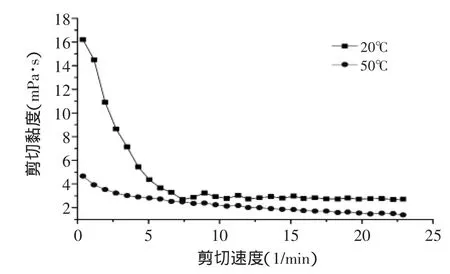
图6 剪切速度及温度对5%BSP溶液黏度特性的影响Fig.6 Effect of temperature and shear rate on the viscosity of BSP
3 结论与讨论
李义[9]报道了水提醇沉法提取毛竹笋多糖的最佳工艺,提取时间为4 h,并经脱脂、Svage法去蛋白、过氧化氢溶液脱色等纯化后竹笋多糖得率为0.32%(以鲜笋计,若按鲜笋含水量为80%估算,该竹笋多糖干基得率为1.6%);俞泉宇等[14]借助超声波辅助提取毛竹笋多糖,同样经过去蛋白、脱色等纯化后竹笋多糖得率为2.948%(干基)、纯度65.3%。周跃斌等[23]则用水提醇沉法研究了毛竹叶多糖,得率为0.661%(干基);丁红秀[24]用酶法处理后水提毛竹叶多糖,再经膜过滤处理,得超滤竹叶多糖(纯度为37.37%)和纳滤竹叶多糖(纯度为51.76%)。与上述源自于竹笋和竹叶部位的多糖相比,本研究发现,竹茹是竹多糖非常好的来源。与未经蒸汽爆破的竹茹相比(多糖得率为0.56%,纯度44.43%,数据未发表),经过蒸汽爆破预处理后,竹茹多糖不仅制备工艺简单(无需经历上述复杂纯化步骤),且多糖得率高(精制多糖得率为2.25%)、杂质含量少(纯度在80%以上),可见蒸汽爆破是竹茹多糖提取的关键。
Sun等[25]将毛竹竿切成100 mm×15 mm×15 mm的块状,研究不同汽爆条件(2.0 MPa 5 min和1.8 MPa 5 min)处理后碱溶液提取对毛竹竿半纤维素多糖的影响,所得多糖平均分子量在4700~14050 u之间,主要由葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、半乳糖醛酸6种单糖组成,以葡萄糖和木糖为主要单糖,与本研究所得BSP平均分子量约为7.6 ku,单糖组成相一致(BSP中含甘露糖而非半乳糖醛酸,也以葡萄糖和木糖为主要单糖),而本研究所得BSP中含有一定量的酚酸(3.21%),Sun等所得半纤维素多糖并不含有,主要是因为其碱液提取过程破坏了酚酸与多糖之间的酯键。
此外,本研究获得的竹茹多糖在体外抗氧化活性方面并不比竹叶来源和竹笋来源的多糖差。如在对羟基自由基清除实验中,在相同浓度下(2 mg/mL),丁秀红[24]制备的竹叶多糖对羟基自由基清除率约为20%、俞泉宇等[14]制备的竹笋多糖对羟基自由基清除率约为15%,本研究获得的竹茹多糖对羟基自由基清除率为15.26%(数据未发表),说明竹茹多糖抗氧化活性并不亚于竹叶多糖和竹笋多糖。
本研究获得竹茹多糖提取的优化工艺参数为:料液比1∶15(g/mL),提取温度100℃,提取时间2.5 h。所得粗多糖得率为2.65%,精制竹茹多糖(BSP)得率为2.25%。理化性质分析测试结果表明,BSP的化学组成主要由多糖(80.75%)、木质素(5.45%)和少量酚酸(3.21%)组成,BSP的单糖组成主要由木糖和葡萄糖组成,重均分子量约为7.6 ku,BSP水溶液为假塑性流体。
[1]傅懋毅,杨校生.我国竹类研究展望和竹林生境利用[J].竹子研究汇刊,2003,22(2):1-8.
[2]Chen G,Chen H.Extraction and deglycosylation of flavonoids from sumac fruits using steam explosion[J].Food Chemistry,2011,126:1934-1938.
[3]Xie J,Lin Y,Shi X,et al.Mechanochemical-assisted extraction of flavonoids from bamboo(Phyllostachys edulis) leaves[J]. Industrial Crops and Products,2013:276-282.
[4]申利红,王建森,李雅,等.植物多糖的研究及应用进展[J].中国农报,2011,27(2):349-352.
[5]Franz G.Polysaccharides in pharmacy[J].Advances in Polymer Science,1986:1-30.
[6]Gao Y,Tian C,Zhao L.Extraction,purification and antioxidant activity of polysaccharides from bamboo leaves[J].Journal of Forestry Research,2012,23:139-143.
[7]Li M F,Sun S N,Xu F,et al.Microwave-assisted organic acid extraction of lignin from bamboo:structure and antioxidant activity investigation[J].Food Chemistry,2012,134(3):1392-1398.
[8]唐莉莉.竹叶有效成分的研究——多糖的分离提取及其生物活性研究[D].无锡:无锡轻工业学院,1997.
[9]李义.竹笋水溶性多糖提取工艺研究[J].林产化学与工业,2008,28(1):108-110.
[10]Zhang Z,Wang X,Yu S,et al.Isolation and antioxidant activitiesofpolysaccharidesextractedfromtheshootsof Phyllostachys edulis(Carr.)[J].International journal of biological macromolecules,2011,49(4):454-457.
[11]Xiao X,Bian J,Peng X P,et al.Autohydrolysis of bamboo(Dendrocalamus giganteus Munro)culm for the production of xylooligosaccharides[J].Bioresource Technology,2013,138:63-70.
[12]张英,黄骆镰,龚凌霄,等.竹子多糖的提取法:中国,CN 201310064648.0[P].2013/03/01.
[13]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350-356.
[14]俞泉宇.竹笋多糖的制备、抗氧化活性及对中华绒螯蟹(Eriocheir sinensis)的免疫效应研究[D].苏州:苏州大学,2013.
[15]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[16]Wen J L,Sun S L,Xue B L,et al.Quantitative structural characterization of the lignins from the stem and pith of bamboo(Phyllostachyspubescens)[J].Holzforschung,2013,67(6):613-627.
[17]波钦诺克,荆家海.植物生物化学分析方法[M].北京:科学出版社,1981.
[18]刘聪,海妮,张英.红枣不同部位中有效成分含量的比较研究[J].现代食品科技,2014(3):258-261,205.
[19]倪勤学,刘颖坤,龚凌霄,等.6种地被竹叶有效成分及其抗氧化活性研究[J].中草药,2011,42(11):2317-2321.
[20]Zhang L,Ye X,Ding T,et al.Ultrasound effects on the degradation kinetics,structure and rheological properties of apple pectin[J].Ultrasonics Sonochemistry,2013,20(1):222-231.
[21]金鑫,赖凤英.仙人掌多糖的提取,分离纯化及GPC法测定其分子量[J].现代食品科技,2006,22(2):138-140.
[22]纵伟,王会晓,闵婉平,等.红枣多糖黏度特性的研究[J].食品科技,2011(2):69-71.
[23]周跃斌,王伟,李适,等.竹叶多糖提取条件的优化[J].湖南农业大学学报:自然科学版,2006(2):206-209.
[24]丁红秀,高荫榆,晁红娟,等.毛竹叶柄多糖体外抗氧化作用研究[J].食品科学,2007,28(11):122-125.
[25]Sun S N,Cao X F,Xu F,et al.Structure and thermal propertyofalkalinehemicellulosesfromsteamexploded Phyllostachys pubescens[J].Carbohydrate Polymers,2014,101:1191-1197.
Extraction and physicochemical properties of the polysaccharides from bamboo shavings
QI Rui-ting,HUANG Ju-qing,GAO Wang-lei,ZHANG Ying*
(Zhejiang University,College of Biosystems Engineering and Food Science,Zhejiang Key Laboratory for Agro-Food Processing,Zhejiang R&D Center for Food Technology and Equipment,Hangzhou 310058,China)
Steam explosion was applied in the pretreatment of bamboo shavings.Hot water extraction and ethanol precipitation were employed to extract the polysaccharides from steam-exploded bamboo shavings.Orthogonal test L9(34)was taken based on single-factor experiments to optimize the preparation of crude polysaccharides,which was further purified by redissolution,centrifugation and second ethanol precipitation to obtain the refined bamboo-shaving polysaccharides(BSP),and the physicochemical properties of BSP were analyzed.The extraction condition was optimized as follows:solid-liquid ratio 1∶15(g/mL),extraction time 2.5 h,extraction temperature 100℃.Under the condition,the yield of crude polysaccharides was 2.65%.Crude polysaccharides were further refined to get BSP with the purity being 80.75%,yield being 2.25%.Physicochemical analyses showed that,the main chemical composition of BSP was polysaccharide(80.75%),lignin(5.45%)and phenolic acid(3.21%),the main monosaccharide composition of BSP was glucose and xylose,with the average molecular weight being about 7.6 ku,and the solution of BSP was a kind of pseudoplastic fluid.
bamboo shavings;polysaccharides;extraction;physicochemical properties
TS209
B
1002-0306(2015)16-0299-05
10.13386/j.issn1002-0306.2015.16.052
2014-09-15
齐睿婷(1990-),女,硕士研究生,研究方向:天然产物与功能性食品,E-mail:474760103@qq.com。
张英(1961-),女,博士,教授,研究方向:天然产物与功能性食品,E-mail:yzhang@zju.edu.cn。
浙江大学馥莉食品研究院基金资助。

