五生饮的毒性研究
洪 日 于征淼
(广州中医药大学第一附属医院,广东 广州510405)
五生饮的毒性研究
洪 日 于征淼
(广州中医药大学第一附属医院,广东 广州510405)
目的 研究不同成份、剂型五生饮的急性和长期毒性。方法 急性毒性实验SPF级NIH小鼠40只分为4组:减味煎液组、煎液组、混悬液组和生理盐水组,予相应药物最大灌胃量1次,观察小鼠外观、行为活动、精神状态、食欲、大小便等,连续观察7 d。长期毒性实验96只SD大鼠根据性别和体质量,随机区组法分为6组:减味煎液组、低、中、高剂量组、混悬液组和生理盐水组,每天予相应药物1.5mL/100 g灌胃1次,连续2周,采血行常规、生化检查和取组织行病理检查,每组剩余大鼠再观察2周,然后取材进行上述检查。结果 急性毒性实验的各组小鼠均未出现死亡,精神状态良好,外观、行为活动、食欲和大小便正常。长期毒性实验中,混悬液组大鼠精神状态较差,活动减少,胃肠胀气较明显,其余5组大鼠精神状态较好,活动较好。各组体质量无明显差异(P>0.05)。减味煎液组和混悬液组死亡率高,生存分析示减味煎液组和混悬液组较生理盐水有显著差异(P<0.01),中位生存时间明显短于其他各组。低剂量组和中剂量组有少量大鼠死亡。与生理盐水组比较,混悬液组的白细胞水平增高,减味煎液组的白细胞、红细胞、血红蛋白、血小板水平降低,低剂量组的血小板水平升高(P<0.05或P<0.01)。与生理盐水组比较,低剂量组的肌酐水平降低而减味煎液组的肌酐水平升高,低、中、高剂量组总胆红素和谷草转氨酶水平升高。2周时葡萄糖、谷丙转氨酶结果示组间有统计学差异(P<0.05或P<0.01)。各组均有少数动物存在病理损害。其中最严重者,依次为混悬液组、高剂量组、减味煎液组。结论 五生饮急性毒性不明显。长期给药,各种剂型、剂量的五生饮均可能具有一定毒性,混悬液较煎液毒性增加,高剂量煎液较低剂量煎液毒性增加,减味煎液较相当剂量五生饮煎液的毒性增加。
五生饮 急性毒性 长期毒性 安全性
多版《中医内科学》教材[1-3]及《临床诊疗指南-癫痫病分册》[4]均以五生饮作为治疗阴痫的代表方。五生饮由生南星、生半夏、生白附子、川乌、黑豆5味药组成,与李仲南《玉机微义·卷四十一》所载五生丸相同,“风痫有痰,阴脉弦细缓者,五生丸主之”[5]。方中药物大多有毒,且存在“十八反”的半夏与川乌药对。当今临床仅可见五生饮类方的少量研究报道,本研究对其进行了初步研究。现报告如下。
1 材料与方法
1.1 动物 NIH小鼠40只,SPF级,体质量(30±5)g,雌雄各半;SD大白鼠96只,SPF级,雌性体质量(200± 20)g,雄性体质量(250±20)g。由广东省实验动物中心提供,生产许可证号:SCXK(粤)2008-0002。场地使用合格证号,SYXK(粤)2008-0092。
1.2 药物 1)减味煎液组:生南星(先煎)、生半夏(先煎)、制白附子、黑豆衣各15 g。先以250mL水浸泡生半夏、生南星约1 h,煮沸后再煎40min,然后加入制白附子和黑豆衣,再煎30min,所得煎液加热浓缩成35mL(折算成生药1.71 g/mL)。2)煎液组:生南星(先煎)、生半夏(先煎)、生川乌(先煎)、制白附子、黑豆衣各15 g。先以250mL水浸泡生半夏、生南星、生川乌约1 h,煮沸后再煎40min,然后加入制白附子和黑豆衣,再煎煮30min。取所得煎液,分别加热浓缩至低剂量140mL(折算成生药0.54 g/mL),中剂量70mL(折算成生药1.07g/mL),高剂量35mL(折算成生药2.14 g/mL)。3)混悬液组:生南星、生半夏、生川乌、制白附子、黑豆衣各15 g。将上述药物打成粉,过80目筛,用90mL水配成120mL混悬液(含生药0.62 g/mL)。4)所有中药均由广州中医药大学第一附属医院中药房提供。
1.3 仪器 日立7080全自动生化分析仪、Siemens ADVIA 2120i全自动血液分析仪。
1.4 急性毒性实验 经预实验无法测出半数致死量,故使用最大灌胃量和最大浓度。40只NIH小鼠根据性别和体质量,随机区组法分为4组,分别为减味煎液组、煎液组、混悬液组和生理盐水组,每组10只,雌雄各半。晚上21∶00之后禁食不禁水,次日早上9∶00一次给予小鼠最大灌胃量(0.4mL/10 g)。煎液浓缩液折算生药85.7 g/kg,相当于成人临床常用量的240倍;减味煎液浓缩液折算生药68.5 g/kg,相当于成人临床常用量的240倍;混悬液折算成生药25 g/kg。连续7 d观察小白鼠外观、行为活动、精神状态、食欲、大小便等。
1.5 长期毒性实验 96只SD大鼠根据性别和体质量,随机区组法分为6组,分别为减味煎液组、低剂量煎液组、中剂量煎液组、高剂量煎液组、混悬液组和生理盐水组,每组16只,雌雄各半。灌胃前6 h禁食。分别予以相应药物灌胃:减味煎液(相当于生药25.7 g/kg,成人临床用量89.6倍);低剂量煎液(相当于生药8 g/kg,成人临床用量22.4倍)、中剂量煎液(相当于生药16 g/kg,成人临床用量44.8倍)、高剂量煎液(相当于生药32g/kg,成人临床用量89.6倍);混悬液(相当于生药9.4 g/kg);0.9%氯化钠注射液。按照1.5mL/100 g每日灌胃1次,连续2周。末次给药24 h后,每组取10只大鼠麻醉后腹主动脉采血,检测血液学指标:红细胞(RBC)、白细胞(WBC)计数,血红蛋白(HGB)、血小板(PLT)、红细胞压积(HCT)、血尿素氮(BUN)、血肌酐(Cr)、谷丙转换酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、血糖(GLU);并取肝、肾、胃肠组织,固定于多聚甲醛溶液,进行病理学检查。剩下的每组6只大鼠继续观察2周以观察毒性反应的可逆程度和可能出现的延迟性反应,再麻醉采血和取脏器病理检查。
1.6 统计学处理 采用SPSS17.0统计软件。计数资料使用Fisher确切概率法。计量资料以(±s)表示,符合正态分布和方差齐性者使用单因素方差分析,否则使用非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组急性毒性实验结果 各组小鼠均未出现死亡,各组小鼠精神状态良好,外观、行为活动、食欲和大小便正常。
2.2 各组长期毒性实验结果
2.2.1 各组一般情况比较 混悬液组大鼠精神状态较差,活动减少,胃肠胀气较明显,其余5组大鼠精神状态较好,活动较好。各组体质量无明显差异(P>0.05)。
2.2.2 各组生存情况比较 见表1和图1。结果示,减味煎液组和混悬液组死亡率高,生存分析示减味煎液组和混悬液组较生理盐水有显著差异(P<0.01),中位生存时间明显短于其他各组。煎液低剂量组和中剂量组有少量大鼠死亡。
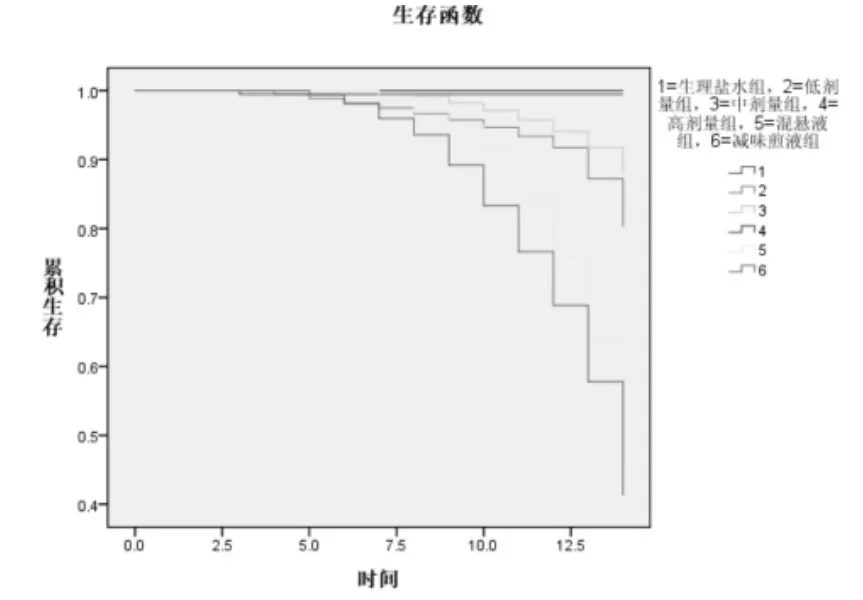
图1 各组生存函数情况
2.2.3 各组血液常规指标比较 见表2。与生理盐水组比较,混悬液组的WBC水平增高(P<0.05),减味煎液组的WBC、RBC、HGB、PLT水平降低 (P<0.05),低剂量组的PLT水平升高(P<0.05)。
表2 不同剂量与剂型五生饮对大鼠血分析指标的影响(±s)
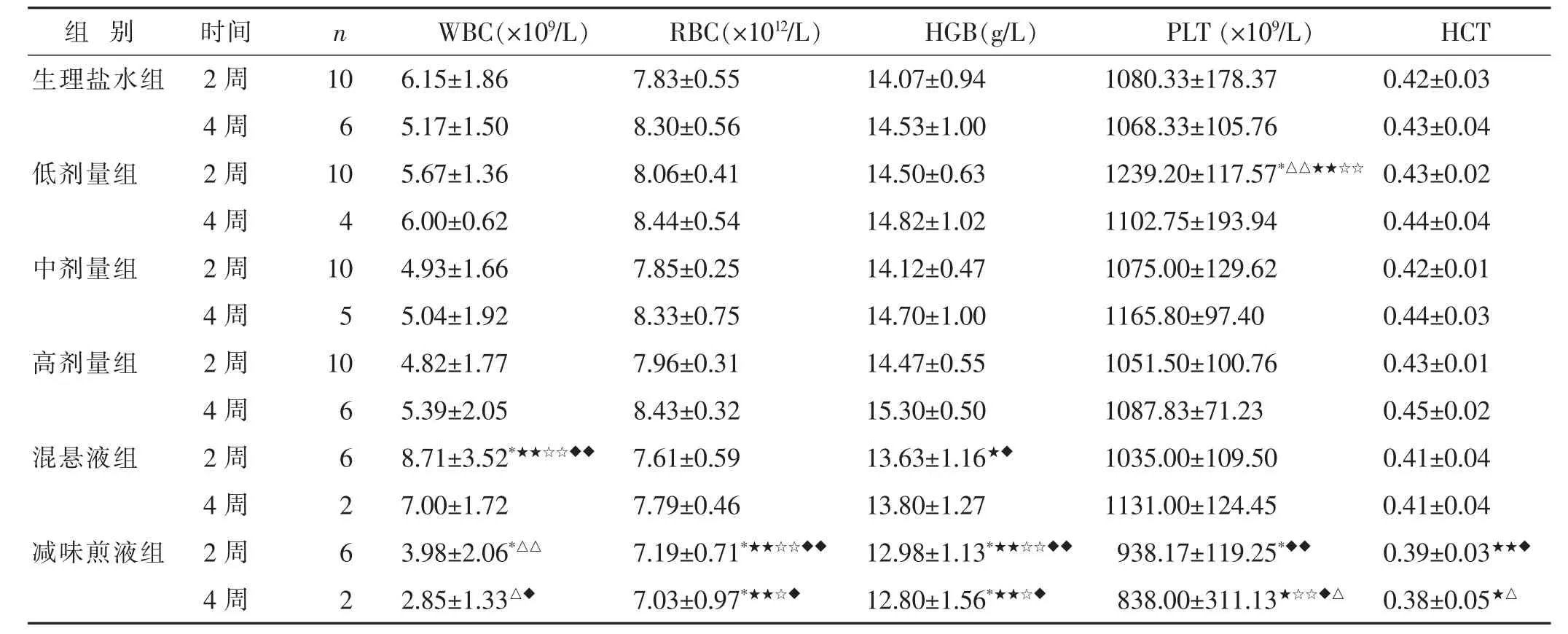
表2 不同剂量与剂型五生饮对大鼠血分析指标的影响(±s)
与生理盐水组比较,*P<0.05,**P<0.01;与混悬液组比较,△P<0.05,△△P<0.01;与高剂量组比较,★P<0.05,★★P<0.01;与中剂量组比较,☆P<0.05,☆☆P<0.01;与低剂量组比较,◆P<0.05,◆◆P<0.01。下同。
PLT(×109/L) HCT 1080.33±178.37 0.42±0.03 1068.33±105.76 0.43±0.04 1239.20±117.57*△△★★☆☆ 0.43±0.02 4周 4 6.00±0.62 8.44±0.54 14.82±1.02 1102.75±193.94 0.44±0.04中剂量组 2周 10 4.93±1.66 7.85±0.25 14.12±0.47 1075.00±129.62 0.42±0.01 4周 5 5.04±1.92 8.33±0.75 14.70±1.00 1165.80±97.40 0.44±0.03高剂量组 2周 10 4.82±1.77 7.96±0.31 14.47±0.55 1051.50±100.76 0.43±0.01 4周 6 5.39±2.05 8.43±0.32 15.30±0.50 1087.83±71.23 0.45±0.02混悬液组 2周 6 8.71±3.52*★★☆☆◆◆ 7.61±0.59 13.63±1.16★◆ 1035.00±109.50 0.41±0.04 4周 2 7.00±1.72 7.79±0.46 13.80±1.27 1131.00±124.45 0.41±0.04减味煎液组 2周 6 3.98±2.06*△△ 7.19±0.71*★★☆☆◆◆ 12.98±1.13*★★☆☆◆◆ 938.17±119.25*◆◆ 0.39±0.03★★◆4周 2 2.85±1.33△◆ 7.03±0.97*★★☆◆ 12.80±1.56*★★☆◆ 838.00±311.13★☆☆◆△ 0.38±0.05★△组别 时间生理盐水组 2周4周低剂量组 2周n WBC(×109/L) RBC(×1012/L)10 6.15±1.86 7.83±0.55 6 5.17±1.50 8.30±0.56 10 5.67±1.36 8.06±0.41 HGB(g/L)14.07±0.94 14.53±1.00 14.50±0.63
2.2.4 各组血液生化指标比较 见表3。与生理盐水组比较,高、低剂量组Cr水平降低而减味煎液组的Cr水平升高,低、中、高剂量组TBIL、AST水平升高(P<0.05或P<0.01)。2周时低剂量组GLU水平降低,混悬液组ALT水平升高(P<0.01)。
表3 不同剂量与剂型五生饮对大鼠血生化指标的影响(±s)
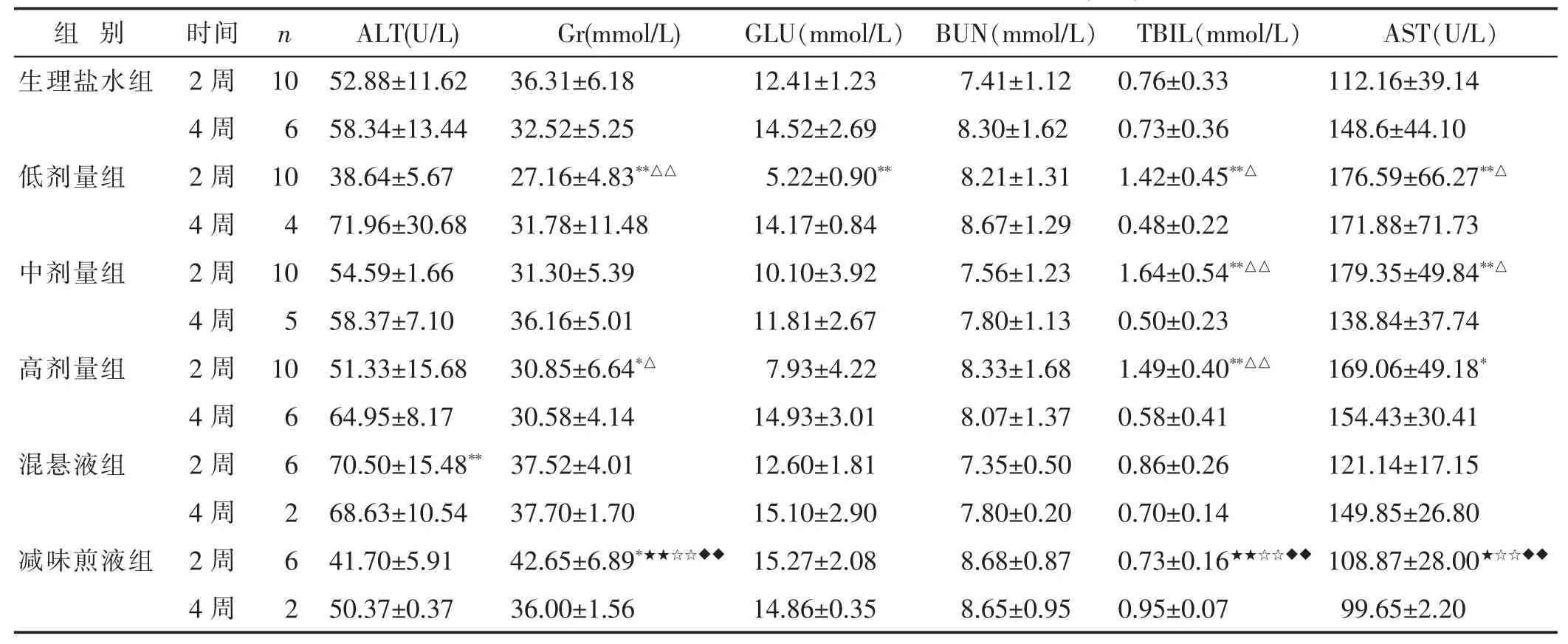
表3 不同剂量与剂型五生饮对大鼠血生化指标的影响(±s)
组 别 时间n ALT(U/L) Gr(mmol/L)GLU(mmol/L)BUN(mmol/L) TBIL(mmol/L)AST(U/L)生理盐水组 2周10 52.88±11.62 36.31±6.1812.41±1.237.41±1.12 0.76±0.33112.16±39.14 4周6 58.34±13.44 32.52±5.2514.52±2.698.30±1.62 0.73±0.36148.6±44.10低剂量组 2周10 38.64±5.67 27.16±4.83**△△5.22±0.90**8.21±1.31 1.42±0.45**△176.59±66.27**△4周 4 71.96±30.68 31.78±11.48 14.17±0.84 8.67±1.29 0.48±0.22171.88±71.73中剂量组 2周 10 54.59±1.66 31.30±5.39 10.10±3.92 7.56±1.23 1.64±0.54**△△179.35±49.84**△4周 5 58.37±7.10 36.16±5.01 11.81±2.67 7.80±1.13 0.50±0.23138.84±37.74高剂量组 2周 10 51.33±15.68 30.85±6.64*△ 7.93±4.22 8.33±1.68 1.49±0.40**△△169.06±49.18*4周 6 64.95±8.17 30.58±4.14 14.93±3.01 8.07±1.37 0.58±0.41154.43±30.41混悬液组 2周 6 70.50±15.48** 37.52±4.01 12.60±1.81 7.35±0.50 0.86±0.26121.14±17.15 4周 2 68.63±10.54 37.70±1.70 15.10±2.90 7.80±0.20 0.70±0.14149.85±26.80减味煎液组 2周 6 41.70±5.91 42.65±6.89*★★☆☆◆◆ 15.27±2.08 8.68±0.87 0.73±0.16★★☆☆◆◆108.87±28.00★☆☆◆◆4周 2 50.37±0.37 36.00±1.56 14.86±0.35 8.65±0.95 0.95±0.0799.65±2.20
2.2.5 各组病理学检查结果比较 见表4,图2和图3。各组均有少数动物存在病理损害,其中最严重者,依次为混悬液组(肝索排列紊乱,肝细胞肿大,细胞核挤至一侧,组织严重病变;肾小球新月体变,胞浆凝固变性,肾小球纤维化)、高剂量组(肾小球新月体变,肾小球和间质粉红色物质沉积)、减味煎液组(肾小球官腔变窄,肾小球炎细胞浸润,组织纤维化)。
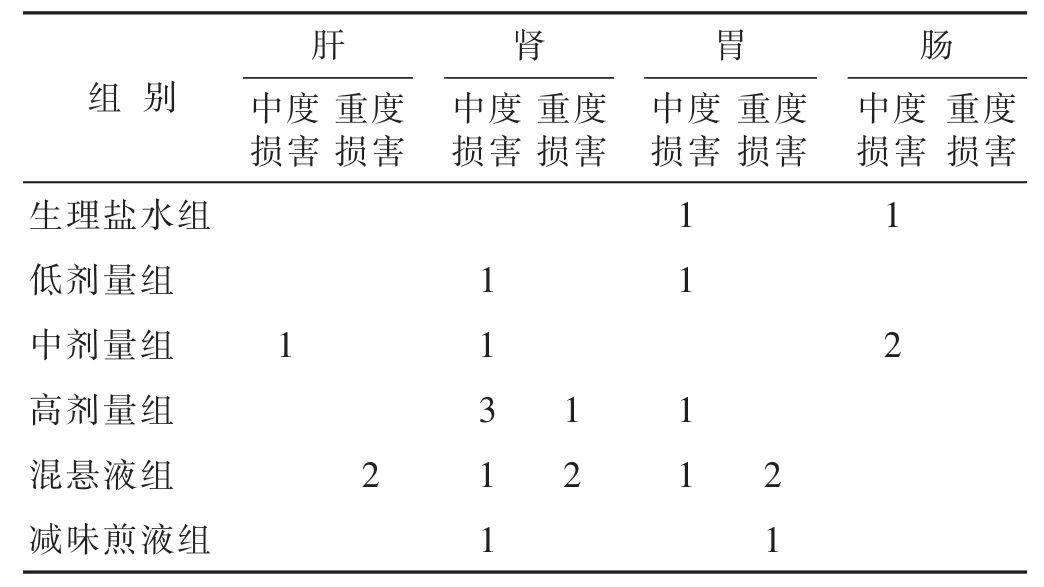
表4 各组动物脏器中度和重度病理损害情况(n)
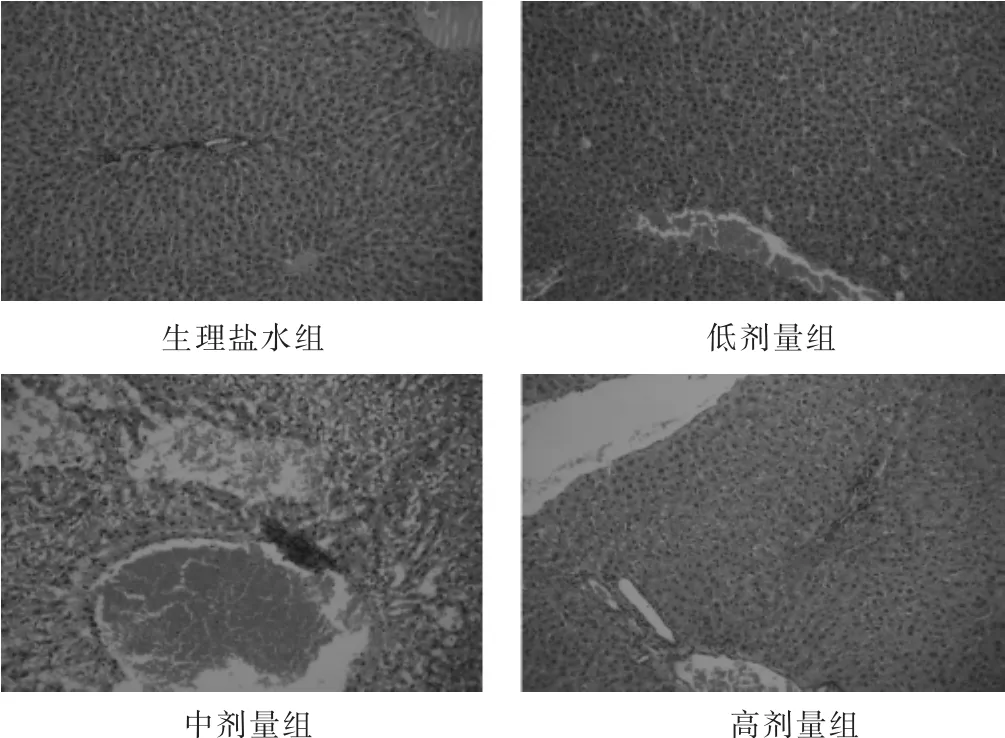
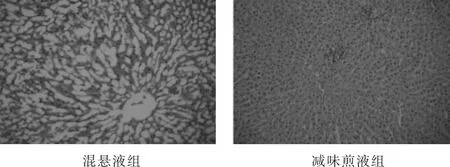
图2 各组肝脏组织学检查(HE染色,100倍)
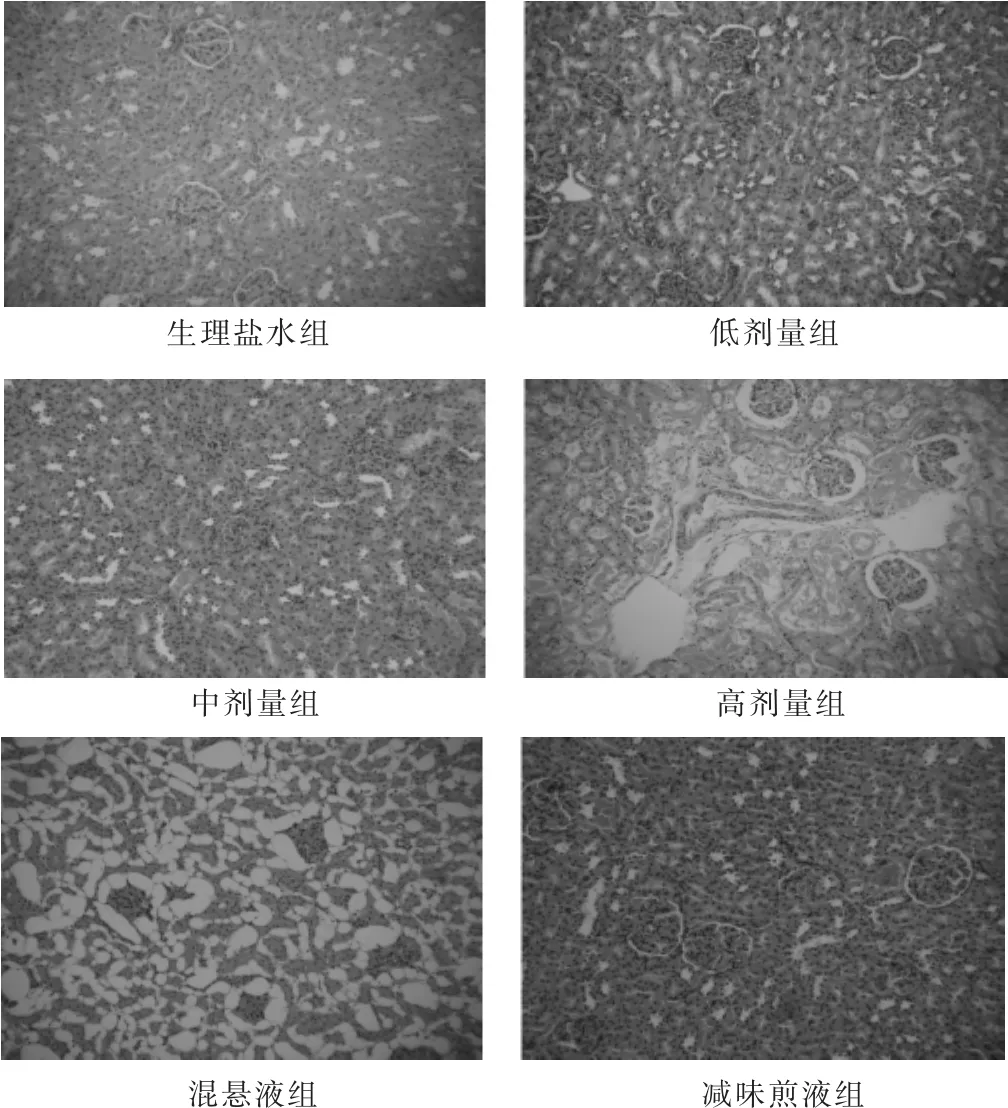
图3 各组肾脏组织学检查(HE染色,100倍)
3 讨 论
混悬液灌胃大鼠的精神状态较差,其余药物对大鼠一般情况无明显影响。各种药物灌胃均不影响大鼠的体质量。减味煎液组和混悬液组导致半数大鼠死亡(每组各死亡8只),具有较明显的毒性。低剂量煎液组(死亡2只)和中剂量煎液组(死亡1只)少量大鼠死亡原因尚不确定,可能由于动物对毒性反应的个体差异所致。生理盐水组和高剂量煎液组未出现实验大鼠死亡。
减味煎液组对大鼠血液分析影响较大,可能降低实验大鼠的WBC、RBC、HGB和PLT水平。减味煎液组Cr水平升高,可能对大鼠肾脏有损害。低、中、高剂量组TBIL、AST水平增高,可能对大鼠肝脏有一定损害。4周后各组血液指标无明显差异,可能对血液指标的改变存在可逆性。
在大多数实验动物中,使用各种剂型和剂量都是安全的,无明显病理损害。但各组均有个别动物出现脏器病理损害,说明五生饮是可能具有一定的毒性,动物是否出现毒性反应可能具有个体差异,个别动物对五生饮的毒性比较敏感。重度病理损害出现在高剂量五生饮组、减味五生饮组和五生饮混悬液组,说明高剂量和未经充分煎煮可能导致毒性增加。生理盐水组个别实验动物出现中度胃和肠的病理反应,说明负荷量灌胃操作本身可能对于消化道具有一定的损害。
报道证实半夏与乌头或附子合用,会增加实验动物的心、肝、肾、神经毒性[6-7]。还有报道该种合用方式提高煎液中生物碱的含量[8-12],肖成荣等[13]研究证实这种合用使大鼠肝微粒体细胞色素酶含量降低,从而可能影响毒性药物的代谢作用。但也有不少研究报道,认为半夏与乌头或附子合用不会增加毒性[14],或者降低了煎液中生物碱的含量[8-9,15],奚丽君[16]研究结果表明半夏附子配伍对CYP450三种亚型活性无明显作用。李新莉等[8]研究结果表明,生川乌与生半夏的共煎液中双酯型生物碱含量高于生川乌单煎液,而生川乌与法半夏的共煎液双酯型生物碱含量有所减少;长时间煎煮能更有效地降低川乌与半夏共煎液中双酯型生物碱的含量。朱日然等[9]研究结果表明与生附子相比,双酯型生物碱在附子加清半夏、姜半夏、生半夏共煎液中含量增高,附子加法半夏共煎液中的双酯型生物碱含量降低。从上述研究可以发现,半夏与乌头的“相反”问题十分复杂,目前尚难得到明确结论。而实际上,很多医家将半夏川乌药对应用于复方中,不仅没有明显不良反应,反而取得了很好疗效。古代医籍中也不乏五生饮等包含半夏川乌药对的方剂。笔者认为将含有半夏与乌头这一“相反”药对的经典中医方剂进行深入研究,是重要的解决途径之一,因为这种固定配方体现了古代中医增效减毒的治疗经验,而且使得实验结果比较稳定。
本研究结果示,各种剂型、剂量的五生饮均可能具有一定毒性,混悬液较煎液毒性增加,高剂量煎液较低剂量煎液的毒性增加,减味煎液较相当剂量五生饮煎液的毒性增加,动物的毒性反应可能具有个体差异。而高剂量五生饮煎液所致动物死亡较减味煎液明显减少,说明半夏与乌头的“相反”配伍并不使毒性增加,甚至可能具有减毒作用。
[1]田德禄,蔡淦.中医内科学[M].上海:上海科学技术出版社,2006:176-181.
[2]王永炎,沈绍功.今日中医内科[M].北京:人民卫生出版社,2000:166-191.
[3]王永炎,严世芸.实用中医内科学[M].2版.北京:上海科学出版社,2009:449-452.
[4]中华医学会.临床诊疗指南:癫痫分册[M].北京:人民卫生出版社,2007:130.
[5]徐彦纯.玉机微义[M].北京:中国医药科技出版社,2011:292.
[6]孙世晓,许蔚,王凤,等.生附子、生半夏配伍后急性毒性的实验研究[J].中医药信息,2011,28(2):104-106.
[7]李玲,马瑜红,欧阳静萍,等.附子配伍半夏对大鼠影响的实验研究[J].中国现代药物应用,2009,3(5):5-7.
[8]李新莉,赵华.半夏配伍川乌产生相反作用的物质基础研究[J].中医药导报,2012,18(2):82-84.
[9]朱日然,李启艳,张学顺,等.附子与半夏不同炮制品种配伍应用的ESI-MSn研究[J].中国实验方剂学杂志,2011,17(18):62-67.
[10]王超,王宇光,梁乾德,等.UPLC/Q-TOFMS分析十八反乌头半夏配伍化学成分的变化[J].药学学报,2010,45(10):1301-1306.
[11]宋俊英,赵平鸽,余陈欢,等.HPLC测定草乌与贝母配伍后乌头碱类成分含量的变化[J].中国生化药物杂志,2011,32(5):363-366.
[12]王超,王宇光,梁乾德,等.UPLC/Q-TOFMS分析十八反乌头半夏配伍化学成分的变化[J].药学学报,2010,45(10):1301-1306.
[13]肖成荣,陈鹏,王宇光,等.半蒌贝蔹及配伍乌头对大鼠肝细胞色素P450酶含量的影响[J].天津中医药,2004,21(4):311-314.
[14]王为民.对乌头反贝母、瓜蒌、半夏的探讨[J].时珍国医国药,2004,15(3):183-184.
[15]张琦.十八反“半蒌贝蔹及攻乌”物质基础及毒性研究[D].长春:长春中医药大学,2010.
[16]奚丽君.以半夏药对研究七情配伍对细胞代谢酶P450的影响[D].南京:南京中医药大学,2010.
R289.5
A
1004-745X(2015)05-0828-04
10.3969/j.issn.1004-745X.2015.05.027
2015-02-27)

