高效液相色谱法测定注射用单磷酸阿糖腺苷有关物质的含量
朱国光(淮安市第一人民医院分院,淮安市耳鼻喉医院药剂科,江苏淮安 223002)
单磷酸阿糖腺苷属于人工合成的嘌呤核苷酸类化合物,是阿糖腺苷的磷酸化产物,临床上主要用于治疗疱疹病毒和肝炎病毒感染所致的皮炎、口炎、脑炎和巨细胞病毒感染等疾病[1-4]。目前,其质量标准采用国家食品药品监督管理总局“新药转正标准第27册”,标准编号:WS1-(X-061)-2001Z,但未对其有关物质的测定进行相关规定。为贯彻药品质量安全、有效、可控的目标,保障人民群众用药安全,本研究建立了高效液相色谱法测定注射用单磷酸阿糖腺苷中的主要杂质阿糖腺苷和腺嘌呤的含量,该法检测结果准确、操作简单、灵敏度高,现报告如下。
1 材料
1.1 仪器
Waters e2695型高效液相色谱仪、Waters 2998型二极管阵列检测器(美国沃特世公司);梅特勒XS64电子天平(万分之一,美国梅特勒-托利多公司);PRO-R双级反渗透超纯水机(上海砾鼎水处理设备有限公)。
1.2 药品与试剂
甲醇为色谱纯(德国默克公司),实验用水为自制超纯水,磷酸二氢钠和磷酸氢二钠为分析纯(国药集团);单磷酸阿糖腺苷(中国食品药品检定研究院,批号:140710-201002),阿糖腺苷(上海万疆生物技术有限公司,批号:Z0119),腺嘌呤(购自中国食品药品检定研究院,批号:110886-201102)。
2 方法与结果
2.1 色谱条件
色谱柱:依利特 Hypersil BDS C18(4.6 mm×250 mm,5 μm);柱温:30 ℃;流动相:甲醇-磷酸盐缓冲液(V∶V=20∶80,磷酸氢二钠26.9 g+磷酸二氢钠29.3 g溶于超纯水,并定容至1000 ml);流速:1 ml/min;进样量:10 μl;检测波长:260 nm。
2.2 系统适应性试验
按“2.1”项下色谱条件进行试验,单磷酸阿糖腺苷、阿糖腺苷、腺嘌呤均能很好地分离,保留时间分别为5.6、13.3和22.1 min,理论塔板数分别为8754、6570和8855,分离度均 >3,见图1。
2.3 溶液的制备
2.3.1 对照品溶液的制备:分别精密称取单磷酸阿糖腺苷、阿糖腺苷、腺嘌呤49.8、50.3、50.5 mg,分别置于10 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至10 ml,得到对照品溶液;分别精密量取对照品溶液1 ml,分别置于10 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至10 ml,得到对照品使用液,质量浓度分别为 498、503、505 μg/ml。
2.3.2 供试品溶液的制备:精密称取注射用单磷酸阿糖腺苷0.5117 g,置于10 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至10 ml,样品溶液质量浓度为51.17 mg/ml;精密量取1 ml样品溶液,置于100 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至100 ml,得供试品溶液,质量浓度为511.7 μg/ml。
2.4 专属性试验
2.4.1 酸破坏试验:取供试品溶液2 ml,置于25 ml容量瓶中,加入0.5 mol/L盐酸溶液5 ml,置于40℃恒温水浴锅中30 min,放冷至室温(25℃),用0.5 mol/L氢氧化钠溶液调节pH值至中性,然后用磷酸盐缓冲液流动相稀释并定容至25 ml,摇匀,按“2.1”项下色谱条件操作。
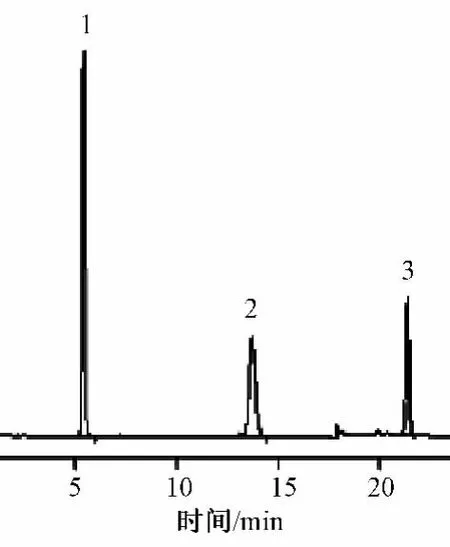
图1 主峰与已知杂质峰色谱图Fig 1 The chromatograms of main peak and impurity peaks
2.4.2 碱破坏试验:取供试品溶液2 ml,置于25 ml容量瓶中,加入0.5 mol/L氢氧化钠溶液5 ml,置于40℃恒温水浴锅30 min,放冷至室温,用0.5 mol/L盐酸溶液调节pH值至中性,然后用磷酸盐缓冲液流动相稀释并定容至25 ml,摇匀,按“2.1”项下色谱条件操作。
2.4.3 加热破坏试验:称取注射用单磷酸阿糖腺苷约5 g,置于105℃烘箱中2 h;精密称取经烘烤的样品10.3 mg,置于25 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至25 ml,摇匀,按“2.1”项下色谱条件操作。
2.4.4 光照试验:称取注射用单磷酸阿糖腺苷约5 g,铺平后置于照度为4500 Lx下照射24 h;精密称取经照射的样品10.5 mg,置于25 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至25 ml,摇匀,按“2.1”项下色谱条件操作。
2.4.5 氧化破坏试验:取供试品溶液2 ml,置于25 ml容量瓶中,加入30%过氧化氢溶液1 ml,然后用磷酸盐缓冲液流动相稀释并定容至25 ml,摇匀,按“2.1”项下色谱条件操作。
专属性试验结果显示,注射用单磷酸阿糖腺苷对酸破坏试验和光照试验不敏感,对碱破坏试验、加热破坏试验和氧化破坏试验高度敏感,见图2。
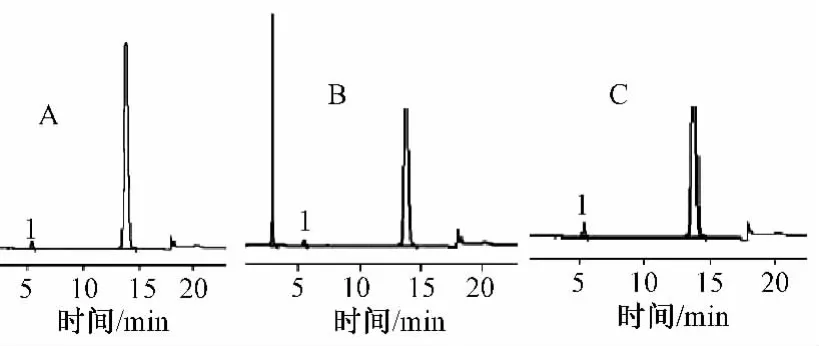
图2 专属性试验色谱图Fig 2 Chromatogram of specificity test
2.5 方法学考察
2.5.1 线性关系考察:精密量取对照品使用液0.1、0.2、0.4、0.8、1.0、2.0、4.0 ml,分别置于 100 ml容量瓶中,用磷酸盐缓冲液流动相稀释并定容至100 ml,摇匀,按“2.1”项下色谱条件操作。以峰面积A为纵坐标,质量浓度C为横坐标,绘制标准曲线,计算得回归方程:A阿糖腺苷=384.511 C+12.735,R2=0.9998,线性范围为 0.503 ~ 20.120 μg/ml;A腺嘌呤=563.847 C+15.674,R2=0.9999,线性范围为0.505 ~20.200 μg/ml。
2.5.2 检出限和定量限:以信噪比(S/N)=3∶1为检出限,S/N=10∶1为定量限,逐步吸收供试品溶液,计算得阿糖腺苷、腺嘌呤的检出限分别为0.89、1.04 ng,定量限分别为3.01、3.45 ng。
2.5.3 重复性试验:取样品批号为20140511的样品按“2.1”项下色谱条件操作,平行试验6份,测定样品中阿糖腺苷和腺嘌呤的含量,结果分别为0.19%(RSD=0.22%)、0.21%(RSD=0.19%)。
2.5.4 回收率试验:分别取“2.3.2”项下样品溶液1 ml置于9个50 ml容量瓶中,分别取“2.3.1”项下对照品溶液0.8、0.8、0.8、1.0、1.0、1.0、1.2、1.2 和 1.2 ml,照“2.1”项下色谱条件操作,测定试样中阿糖腺苷和腺嘌呤的含量,结果分别为99.8%(RSD=0.21%)、100.1%(RSD=0.20%)。
2.6 有关物质的测定
按“2.1”项下色谱条件测定3批注射用单磷酸阿糖腺苷中有关物质的含量,结果见表1。
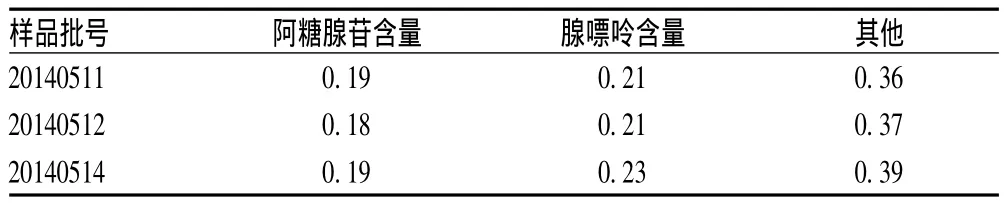
表1 注射用单磷酸阿糖腺苷中有关物质含量的测定结果(%)Tab 1 Determination result of related substances in vidarabine monophosphate(%)
3 讨论
有关物质主要是指在生产过程中带入的起始原料、中间体、聚合体、副反应产物,以及贮藏过程中的降解产物等[5-9]。有关物质的研究是药品质量研究中关键性的项目之一,其含量是反映药品纯度的直接指标。药品在临床使用中产生的不良反应除了与药品本身的药理活性有关外,有时与药品中存在的杂质也有很大关系[10-13]。单磷酸阿糖腺苷是以阿糖腺苷、腺嘌呤和磷酸为原料合成的药物,首先,阿糖腺苷和腺嘌呤在酶的作用下,生成阿糖腺苷中间产物,经提取、浓缩、精制得到高纯度的阿糖腺苷;然后,阿糖腺苷经磷酸化得到单磷酸阿糖腺苷。由其生成工艺过程可见,阿糖腺苷和腺嘌呤在精制过程中难以除尽;另外,单磷酸阿糖腺苷在储藏中受温度、湿度等外界环境条件的影响,可分解产生阿糖腺苷和腺嘌呤,成为主要杂质成分,对药物的疗效和安全性构成潜在的风险[14-16]。目前,注射用单磷酸阿糖腺苷的国家标准未对其有关物质进行相关的规定。
本研究结合单磷酸阿糖腺苷、阿糖腺苷和腺嘌呤的紫外光谱图,确定3种化合物在260 nm波长处有较大吸收,因此,选择260 nm为检测波长。预实验结果表明,采用依利特Hypersil BDS C18色谱柱(4.6 mm ×250 mm,5μm)、柱温为30℃、流动相为甲醇-磷酸盐缓冲液时,样品中各色谱峰分离度好,峰对称性好,因此,本研究采用以上色谱条件。本研究结果表明,注射用单磷酸阿糖腺苷对碱、高温和氧化敏感,主要功效成分会显著降低或完全被破坏。
综上所述,本法用于测定注射用单磷酸阿糖腺苷的有关物质,分离度高、理论塔板数高、峰对称性好、检出限低、重现性高,已知杂质成分线性方程相关系数高,可用于实践检测、控制注射用单磷酸阿糖腺苷的质量,保障其临床疗效,同时提高用药安全性。
[1]修佳,毛影,连莹.高效液相色谱法测定注射用单磷酸阿糖腺苷的有关物质[J].中国医院药学杂志,2012,32(21):1769-1771.
[2]吴昌振.单磷酸阿糖腺苷联合康复新液治疗小儿疱疹性口腔炎的效果分析[J].中国现代药物应用,2014,8(16):136-137.
[3]文九芳.注射用单磷酸阿糖腺苷治疗疱疹性咽峡炎的疗效观察[J].临床合理用药杂志,2011,4(24):64.
[4]钟永平,唐慧敏.单磷酸阿糖腺苷治疗老年带状疱疹疗效观察[J].中华全科医学,2010,8(5):565-566.
[5]王燕平,梁玲.重视对临床治疗药品的评价与监护[J].中国医院用药评价与分析,2014,14(11):1048-1051.
[6]金瓯.高效液相色谱法测定注射用氟脲苷的含量及有关物质[J].药物分析杂志,2014,34(2):325-328.
[7]李理宇,张波,张东娜,等.高效液相色谱法测定马来酸桂哌齐特注射液有关物质的含量[J].中国医院药学杂志,2010,30(14):1244-1246.
[8]钟秀娟,张春艳,熊璐琪.惠州市中心人民医院糖皮质激素类药物门急诊使用分析[J].中国医院用药评价与分析,2014,14(8):725-727.
[9]彭茗,杨永健,宋冬梅.高效液相色谱法测定复方氯唑沙宗片的有关物质[J].药物分析杂志,2010,30(4):737-740.
[10]杜宁,王玉,蔡美明,等.高效液相色谱法测定氨甲环酸注射液的含量和有关物质[J].中国药学杂志,2010,45(2):144-147.
[11]杨玉敏,窦媛媛,王洪权,等.高效液相色谱法测定注射用福莫司汀有关物质和含量[J].解放军药学学报,2011,27(6):535-536,539.
[12]吕晴,郝玲花,李东辉,等.高效液相色谱法测定缬沙坦氢氯噻唪片有关物质[J].中国新药杂志,2014,23(15):1754-1757,1810.
[13]耿志旺,杨永健,刘蔚,等.反相高效液相色谱法测定甲泼尼龙琥珀酸钠注射液含量和有关物质[J].药物分析杂志,2012,32(6):1093-1095,1084.
[14]李喆宇,张春然,王宇驰,等.高效液相色谱法测定帕潘立酮的含量及有关物质[J].中国抗生素杂志,2013,38(2):125-129.
[15]刘俊华,梁星晖,王斌荣.高效液相色谱法测定二甲苯磺酸拉帕替尼片有关物质[J].中国药学杂志,2013,48(8):644-648.
[16]李逢春.注射用单磷酸阿糖腺苷细菌内毒素检查法的建立[J].中国药房,2014,25(29):2762-2763.

