无机层状材料在电化学传感中的应用
谢赛丹+刘洋+吴朝阳+沈国励+俞汝勤
摘 要 无机层状材料具有低维的开放结构和良好的生物兼容性及稳定性,被认为是固载生物分子最有前景的材料之一,它不仅可以根据固载分子的尺寸调层间距,防止泄露,而且可以有效保护固载分子不受外界影响。它还可以促进酶与电极之间的电子转移。因此,无机层状材料在电化学传感中的具有很大的应用潜力。本文分别对无机层状材料固载客体分子的方式、不同类型的无机层状材料, 包括阳离子型、阴离子型和非离子型无机层状材料, 在电化学传感中的应用进行了综述,并对其应用前景进行了展望。
关键词 无机层状材料; 电化学传感; 酶; 评述
1 引 言
无机层状材料在结构上最明显的特征就是层层叠加,从而形成纵向有序的三维结构,其层板由无机元素的原子以共价键作用排列而成,而相邻层板间的原子以范德华力和氢键等弱键作用相连,层间距具有可扩展性,因此层板之间可以发生相互错位平移,层间距离也可以在外界的作用下发生改变,从而使得客体分子可通过静电力嵌入层间[1]。无机层状材料根据层板所带的电荷不同,可以分为以下阴离子型层状材料(即层板带正电,层间以阴离子平衡电荷),如水滑石等;阳离子型层状材料(即层板带负电,层间以阳离子平衡电荷),如蒙脱土、二氧化钛、磷酸氢锆等;非离子型层状材料(即层板不带电),如石墨、层状双硫属化物、V2O5、MoO3等。
电化学传感器是由检测分子识别元件和电化学信号转换元件组成的,具有成本低、操作简单、体积小、快速、灵敏以及实时和现场检测等优点,在临床诊断、食品分析、生物过程监测、环境监测等方面广泛应用[2~4]。根据检测物质种类,电化学传感器可分为离子传感器、气体传感器和生物传感器等。在构建生物传感器中,生物分子固定化对其性能的影响至关重要。传统的固定方法(如交联法、键合法、包埋法等)容易造成生物分子流失或活性降低,导致生物传感器灵敏度低或者重现性较差等问题[5~7]。近年来,纳米材料, 如碳纳米管、石墨烯、纳米金等,由于其独特的物理和化学性质,在生物传感器中得到广泛关注。尤其是层状纳米材料,其结构规则、机械性能高、化学稳定及热稳定性好[8],被认为是固载生物分子最有前景的材料之一[9]。无机层状材料可以根据固载的生物分子的尺寸调整层间距大小,防止生物分子泄漏,并且有效保护固载的生物分子不受外界干扰物质影响[10]。另外,层状材料的低维结构决定了其具有开放结构,使各种分子靠近成为可能,有利于有机大分子的插入。无机层状材料还具备电催化活性、离子可交换性、良好的生物相容性和稳定性等特点,使得其在电化学生物传感领域具有广阔的应用前景, 与其它纳米材料、聚合物等复合, 极大地改善了固载分子的稳定性和活性,提高了传感器的灵敏度,如今,越来越多的层状材料被开发应用于电化学传感。本文对无机层状材料固载客体分子的方式和不同类型的层状材料在电化学传感器方面的应用进行了综述。
2 无机层状材料固载客体分子的方式
通常,将客体分子固载到层状材料中包括直接嵌入法和间接嵌入法两种方式。
2.1 直接嵌入法
无机层状材料的直接嵌入过程伴随着层间化学键的断裂、主体层板与客体分子之间新作用力的生成[11]。这个过程,可以通过“阶段模型”说明,即客体分子通过多个阶段逐步填充到层板之间。对于层间作用力不是很强的层状材料,客体分子的嵌入很容易就使层间距增大,并且嵌入反应发生在层状材料的整个层间区域;而有些层状材料的层间作用力是很强的,随着客体分子的嵌入层状材料的层间区域才逐渐被打开。
2.2 间接嵌入法
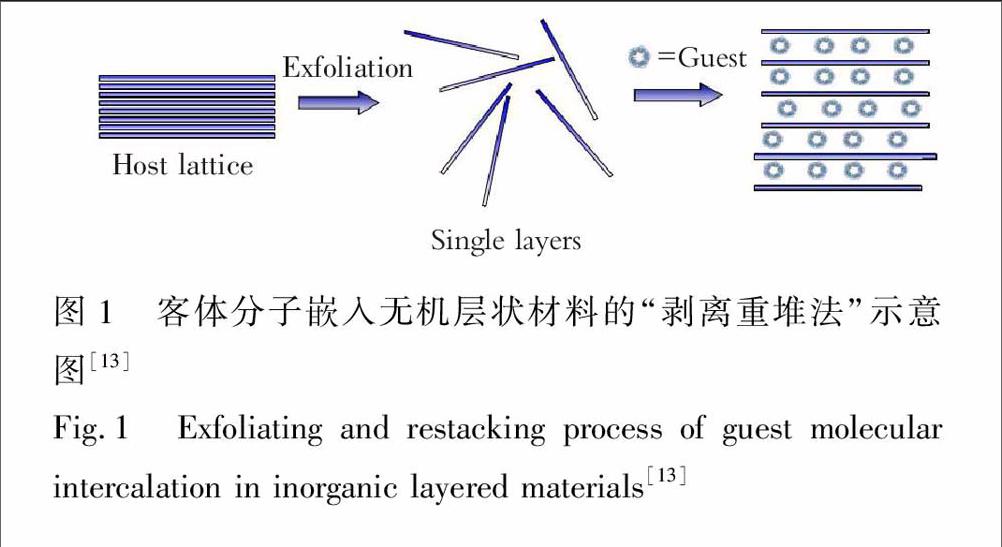
无机层状材料的间接嵌入过程是根据某些层状材料能剥离的特点[12],通过剥离反应获得独立的片状材料,然后再与客体分子重新堆叠起来形成层状复合物,如图1。目前,已经发展了很多层状材料的剥离方法,其中液相剥离层状材料是一个很重大的发现,包括氧化、离子插入或交换、
表面钝化等方法[14]。当层状材料的层间距被无限膨胀,层与层之间互不依赖,最终导致层板的分离。例如,层状双金属氢氧化物在丁醇中通过十二烷基磺酸交换层间阴离子被剥离开[15],也可以在甲酰胺或水等溶剂中发生剥离反应[15,16],MoS2通过Li+的插入也可发生剥层反应[17]。利用剥离得到的片状材料与客体分子通过静电作用等间接获得客体分子嵌入的层状复合物。通过层层组装方法构建无机纳米片与生物分子复合层状结构材料相对于直接将生物分子插入到层状材料中更容易实现,因为剥离后的无机纳米片可以根据固载生物分子的尺寸来调整重新堆叠起来的层间距,而不受固载生物分子大小的限制。
3 无机层状材料在电化学传感中的应用
3.1 阴离子无机层状材料
阴离子型无机层状材料是由阳离子的层板和层间吸附带相反电荷的阴离子或溶剂分子组成的[18,19],典型的是水滑石,它与类水滑石统称为层状双金属氢氧化物(Layered Double Hydroxide,L )。其分子式可以表示为:[M2+1-x M3+x(OH)2][An]x/n·zH2O,M2+代表二价金属离子,常见的有Mg2+, Zn2+, Ni2+等,M3+代表三价金属离子,常见的有Al3+, Fe3+, Mn3+等。An
代表无机或有机阴离子,如CO2
3, Cl
, SO2
4 , RCO2
等。x一般在0.2~0.4之间。除了二价和三价的金属离子,也有含一价和四价金属离子的水滑石,如Li和Ti4+。
层状双金属氢氧化物是固定蛋白质的载体之一,可以提供一个生物相容性的微环境,保持酶原有的活性。其最常用的固载方式是剥离-重组。Chen等[20]剥离Ni-Al-NO3层状双金属氢氧化物得到Ni/Al纳米片,在pH=7.5的条件下,等电点为7.2的HRP带负电荷, 与带正电荷的Ni/Al纳米片重新堆叠成层状复合物,研究了HRP与电极之间的直接电子转移,该传感器表明对H2O2和三氯乙酸(TCA)的还原有很好的电催化活性。Liu等[21]通过剥离-重组的方法将血红蛋白和DNA同时插入到Ni/Al层状双金属氢氧化物中,制得了无媒介生物传感器。DNA的插入不仅有利于血红蛋白插入层间,而且改善了血红蛋白的生物活性。DNA和L s共同作用促使蛋白和电极之间进行快速的电子转移,并且在高温(85℃)或在有机溶剂甲氰中还能保持酶的活性。endprint
另外,在水滑石中插入一些有机化合物可以改善酶的稳定性和催化活性。比如凝胶、聚合物、表面活性剂,具有很好的亲水性,可以插入到层状无机材料的间隙中,使得层与层之间的空间变大,更有利于保护催化剂以免被氧化而失活。Fernández等[22]通过共沉淀法合成Co/Al水滑石,然后与十二烷基苯磺酸钠复合,不需要交联剂就能有效地固定HRP,高灵敏检测2-氯苯酚。Zhu等[23]在修饰了离子液体的碳刷电极上进一步修饰Ni/Al水滑石类层状材料,将带负电荷的有机分子插入层板之间,制得了高灵敏的多巴胺电化学传感器。
水滑石不仅可以固载大分子蛋白质,由于其离子可交换的性质,还可以固定小分子。Jin等[24]通过化学方法合成了普鲁士兰-Mg/Al L s 复合物。首先,Fe(CN)4
6阴离子和L s层间的阴离子交换,然后,Fe2+在L s上沉积形成普鲁士蓝纳米颗粒,这种方法比直接吸附普鲁士蓝纳米颗粒效率更高。因此制备检出限低、灵敏度高的H2O2传感器。
此外,其中某些水滑石层状材料本身具有电催化活性,拓展了其在电化学传感器中的应用。比如Chen等[25]通过循环伏安法揭示了花瓣状Ni/Al水滑石类层状材料在碱性溶液中具有类似过氧化物酶能电催化葡萄糖氧化的活性,通过将花瓣状的Ni/Al水滑石类层状材料固定在电极表面,制备了新型简单又便宜的无酶葡萄糖传感器,检出限达到0.11 μmol/L。Li等[26]通过电化学处理的方法在玻碳电极表面形成Zn/Al层状双金属氢氧化物膜,在间二苯酚存在下,同时检测出邻二苯酚和对二苯酚。与Zn/Al层状双金属氢氧化物直接修饰在电极表面相比,它显示出更高的峰电流和更低的电势差,这可能是由于大的比表面积和强的吸附能力。与其它方法相比,它具有更高的稳定性和灵敏度、更好的抗干扰能力。
3.2 阳离子无机层状材料
阳离子无机层状材料是层板带负电荷,层间以阳离子平衡电荷。电化学传感领域里常见的阳离子无机层状材料主要包括粘土、金属氧化物和金属磷酸盐。粘土如蒙脱土,氧化物有TiO2、MnO2等, 典型的磷酸盐有α-磷酸锆、磷酸钡。
3.2.1 粘土
粘土无机层状材料在电化学传感领域里应用广泛,因为其空间二维结构能够插入大量有机小分子、大分子和生物分子。常见的是蒙脱石类粘土,包括锂皂石(Laponite)、蒙脱石(Montmorillonite)、绿脱石(Nontronite)。蒙脱石类粘土是层状硅酸盐类粘土矿物,其结构单元是由一个八面体层和两个四面体硅酸层组成。中心阳离子的配位使得层周围带负电荷,因此层间通过插入阳离子互补,这类粘土也称为阳离子粘土[27]。
阳离子粘土作为一种生物兼容性无机层状材料,是蛋白质固载的良好平台。Charmanay等[28]将半乳糖氧化酶和锂皂石混合,制得了灵敏度高,重复性好的半乳糖传感器。半乳糖氧化酶具有很高的等电点,在中性条件下带正电荷,因而能很好的固定在锂皂石上。粘土固载酶的方式除了与酶直接混合,还可以和聚合物复合通过非共价或共价的作用来固载酶。Kesik等[29]在电极表面上电聚合导电聚合物,构建了一个全新的固载酶的平台,制得了灵敏度高,检出限低的葡萄糖传感器。聚甲基甲酰胺导电聚合物是由含氨基的单体电聚合而成的,在戊二醛的作用下,共价交联葡萄糖氧化酶。另外,在粘土材料中插入其它分子来提高蛋白质的固定效率已越来越受到关注。例如,Seleci等[30]在蒙脱土中插入甲胺、二甲胺,获得氨基修饰的蒙脱土,通过戊二醛共价修饰上葡萄糖氧化酶,实现对葡萄糖高灵敏检测,得到了很好的线性关系。同样地,Demir等[31]在蒙脱土中插入三甲胺,通过戊二醛共价连接了微生物细胞,对葡萄糖的电化学响应体现了在生物应用中的前景。
粘土和金属纳米颗粒的复合增强了蛋白质和电极之间的直接电子转移。Zhao等[32]将用壳聚糖稳定的金纳米颗粒和剥离的蒙脱土堆叠成层状复合物,固载在中性条件下带正电荷的辣根过氧化物酶,再覆盖上蒙脱土,制备了稳定的酶传感器。该传感器对H2O2响应快,线性范围宽。
3.2.2 过渡金属氧化物
层状过渡金属氧化物种类繁多,由于具有空的d轨道和强的电子捕获能力,在光学、电学等领域备受青睐。其中典型的属层状钛酸盐材料,自20世纪90年代中期以来,Sasaki等[33]研究了层状二氧化钛的膨胀-剥离现象,层状二氧化钛可以通过离子交换、嵌入、膨胀,机械振荡等方法获得二氧化钛纳米片[34],二氧化钛纳米片的厚度很薄,10
9~10
5 m,等电点也很低,约1.2,因此在pH>1.2范围内,均带负电荷。通过加入适量正电荷,就可以使带负电的纳米片与带正电荷的客体分子以层层组装的方式组合起来,构成复合层状结构材料[35]。
由于静电作用的存在,通过简单的混合方法就能够制备生物分子嵌入的无机层状复合材料。Zhang等[13]将制得的二氧化钛钛酸盐在四丁基氢氧化铵(TBAOH)水溶液中进行剥离,得到了二氧化钛纳米片(TNS)悬浮液,将pH值调至弱酸性(pH≈5),带负电的TNS与带正电的HRP(等电点=8.9)分子之间相互吸引, 并以层层组装的方式形成HRP嵌入的层状结构复合物。这样的固载方式使HRP分散性很好,没有发现HRP团聚现象。利用TNS-HRP层状复合物构建第三代生物传感器,实现对H2O2的检测。Zhang等[36]还将肌红蛋白(Mb)和TNS通过静电作用,以层层组装的方式构建了Mb嵌入二氧化钛的层状复合物。在强酸(pH =2.2)或高温(85℃)下仍然能够实现对H2O2的检测。
层状二氧化钛由于其良好的生物兼容性、化学及热力学稳定,是一种很好的固定蛋白的载体,但是层状二氧化钛在酸性条件下不稳定,因而固定的蛋白是有限的,能直接吸附的蛋白像肌红蛋白(pI=7.0)、血红蛋白(pI=7.1)、辣根过氧化物酶(pI=7.0)等。Han等[37]采用带正电荷的聚合物--聚二烯丙基二甲基氯化铵与蛋白质混合形成多层膜,再与二氧化钛纳米片组装成复合的层状材料, 使得蛋白固定多样化。endprint
层状二氧化钛也是一类典型的无机阳离子交换材料,可用于重金属离子的检测。Yuan等[38]通过浓NaOH和无机钛盐之间的水热反应得到交错的网络结构Na-TNS,基于Na-TNS的传感平台,通过阳离子交换过程,可以有效捕获Hg2+,促进Hg2+在表面富集,然后在HCl溶液中Hg还原Hg(0),从而利用溶出伏安法实现对Hg2+的高灵敏检测。
3.2.3 金属磷酸盐
金属磷酸盐中四价金属磷酸盐即磷酸锆研究颇多,层状磷酸锆有α-磷酸锆(α-Zr(HPO4)2·H2O)、γ-磷酸锆(γ-Zr(PO4)(H2PO4)·2H2O)、θ-磷酸锆(θ-Zr(HPO4)2·6H2O及其有机衍生物[39]。它们除了具备层状材料的共性,还有耐强酸和一定的碱、热稳定性很好等特性[40]。α-磷酸锆是一种表面含有酸性羟基的无机层状材料,剥离的α-磷酸锆纳米片会暴露出更多的负电荷,可以更加有效地吸附带正电荷的蛋白质,另外,α-磷酸锆具有很好的生物兼容性,使固定在其表面的蛋白质保持原有活性。Zhang等[41]采用水热法合成磷酸锆, 并剥离得到α-磷酸锆纳米片,将肌红蛋白静电吸附固定在电极表面,α-磷酸锆纳米片促进肌红蛋白与电极之间的直接电子转移,因此有效催化H2O2, O2, NaNO2, TCA等的还原,H2O2的检出限为1.4×107 mol/L,且响应快,线性范围宽。Liu等[42]将血红蛋白和剥离好的α-磷酸锆纳米片反应, 获得复合材料,不仅改善了血红蛋白的热稳定性,即在85℃下还能保持其生物活性,而且增强了蛋白与电极之间的电子传递能力,该传感器对H2O2有很好的响应和重复性。这些都表明α-磷酸锆适用于第三代传感器的制备。
磷酸锆的导电性常会限制其电化学应用,Liu等[43]通过对α-磷酸锆剥离再组装,在层间同时插入了带正电荷的血红蛋白和带负电荷的双链DNA,制备了无电子媒介的电化学生物传感器。由于电子能够在双链DNA上传递,通过α-磷酸锆和双链DNA的协同作用,可有效促进血红蛋白和电极之间的直接电子转移。此传感器显示了对H2O2有很好的电催化活性,且在温度高达85℃下或在甲氰溶液中仍保持着活性。Liu等[44]还通过类似的方法在α-磷酸锆层间同时插入了壳聚糖和葡萄糖氧化酶,制备无电子媒介的葡萄糖传感器,检出限达到0.076 mmol/L。Santiago-Berríos等[45]通过二-2, 2′, 2″, 6-四吡啶合钴([Co(tpy)2]2+)与θ-磷酸锆的直接插入反应生成了[Co(tpy)2]3+插入θ-磷酸锆的复合材料,其电化学行为表明了它是很好的电子媒介,能够在酶活性位点之间实现快速的电子转移,可以检测到低浓度NA 。将该材料固定在电极表面,制备了双酶乳酸传感器,检出限达到10 mol/L。
3.3 非离子无机层状材料
非离子层状材料的层板不带电荷,分子层之间以范德华力联接成网络,典型的有石墨、层状双硫属化物、V2O5、MoO3等。
3.3.1 石墨 石墨是元素碳的一种同素异形体,每一个碳原子以sp2杂化与其它3个原子相连,6个碳原子在同一个平面上形成了正六边形的环,伸展成片层结构,层与层之间通过范德华力堆叠起来[46]。石墨是碳材料家族中的一种各向异性材料,它的边缘有很多活性位点,平面上的惰性缺陷也可以经过电化学预处理得到激活。例如,Ku等[47]利用石墨和Nafion混合物修饰在丝网印刷电极表面,经过电化学预处理,原本顺滑的表面被刻蚀成约100 nm的纳米片, 制备了高选择性的多巴胺电化学传感器。Nafion是带负电荷的聚合物,不仅可以插入在石墨纳米片层中,并且能够阻碍抗坏血酸、尿酸等干扰物靠近电极表面。这样预处理得到的复合物对多巴胺有很强的电催化活性,检出限达到0.023 μmol/L。
石墨具有良好的化学稳定性,在电化学传感中的应用往往需要剥离成片。最早,石墨通过物理剥离获得了石墨烯纳米片,这种方法简单,但是产率较低,不适合大量生产; 后来, 化学剥离法得到广泛使用。石墨纳米片是石墨烯衍生物,包含几层石墨烯纳米片,是通过剥离原始石墨得来的。它具有和石墨烯类似的物理性质,且相对比较稳定和制备方法更温和。因此,在电化学传感领域受到关注。Zhu等[49]将剥离的石墨纳米片修饰在电极表面,制得了NA 的电化学生物传感器。石墨纳米片促进了NA 氧化过程中的电子转移,其氧化峰降至0.32 V。Fu等[50]首次将剥离的石墨纳米片和Nafion复合,固定葡萄糖氧化酶在电极表面,研究其直接电化学性质。该复合物不仅使得酶与电极之间实现了快速的电子转移,而且也没有损失酶的活性。
石墨烯自发现以来,在电化学传感领域获得迅速的发展。由于其具有快速电子转移能力,电催化活性,良好的生物兼容性,大的比表面积以及容易固定酶等性质,已经构建了基于石墨烯的葡萄糖、H2O2、核酸等电化学传感器[51]。
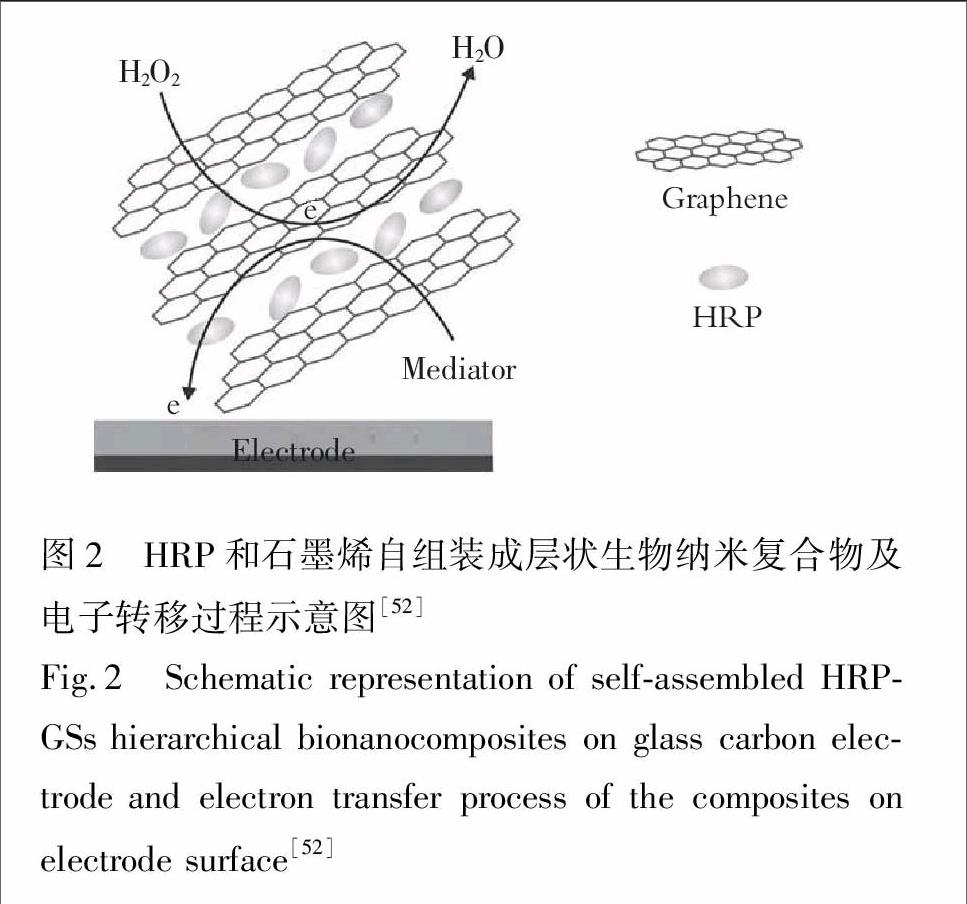
Zeng等[52]通过Hummer方法将石墨剥离得到氧化石墨, 再还原获得石墨烯,并首次将石墨烯片和辣根过氧化物酶通过静电作用组装成层状纳米复合物,这是由于十二烷基苯磺酸钠的功能化使石墨烯片带负电荷,而在pH=7.0下,辣根过氧化物酶(pI=8.8)带正电荷,如图2。这样的复合物显示了对H2O2良好的电催化活性,线性范围为1.0× 10
6~2.6×10
3 mol/L,且检出限达到1.0×10
7 mol/L。
Kang等[53]将壳聚糖功能化的石墨烯复合葡萄糖氧化酶,制得了高灵敏的葡萄糖电化学传感器。该传感器展示了快速的电子转移能力,其速率常数为2.83 s
1,且酶负载量高,达到1.12×10
9 mol/cm2。
石墨烯通过一定的处理可以修饰上羧基、氨基、羟基的等官能团,可以有效固定一些生物分子,丰富了其在电化学生物传感器中的应用。Huang等[54]将羧基化石墨烯修饰在电极表面研究了腺嘌呤和鸟嘌呤的直接电化学行为,检测限分别为5.0×10endprint
8 mol/L和2.5×10
8 mol/L。石墨烯也可以通过π-π共轭作用固定一些生物分子,如单链DNA。Zhu等[55]将化学串联反应和石墨烯与DNA的相互作用结合起来发展了一种全新的电化学传感策略,即通过串联反应控制双链DNA的打开和折叠,从而改变DNA与石墨烯作用,间接检测底物浓度。Su等[56]将相互作用的石墨烯和单链DNA修饰在电极表面建立起三明治型的电化学免疫传感器。
图2 HRP和石墨烯自组装成层状生物纳米复合物及电子转移过程示意图[52]
Fig.2 Schematic representation of self-assembled HRP-GSs hierarchical bionanocomposites on glass carbon electrode and electron transfer process of the composites on electrode surface[52]
石墨烯与金属纳米颗粒、小的有机分子或聚合物复合拓展了其在电化学传感领域里的应用。Zhang等[57]在石墨烯表面电沉积铂纳米颗粒,这样复合的纳米复合物对H2O2的还原展示了很高的峰电流和低的超电势,检出限低至0.2 μmol/L,可以检测到活细胞释放的H2O2。Liu等[58]采用温和的、环保的方式合成了Au纳米颗粒、多金属氧酸盐和石墨烯三元复合纳米材料,对H2O2有很好的电催化活性,制得了选择性好、稳定性高、检出限低的H2O2无酶传感器。Gao等[59]通过电聚合获得了聚吡咯-石墨烯复合膜,它具有很好的导电性,可以实现对腺嘌呤和鸟嘌呤的定量检测。
由于石墨烯在电化学传感领域的广泛应用,一些类石墨烯的层状材料逐渐进入人们的视野。例如,C3N4 纳米片是具有类似石墨烯结构的二维层状材料,其热、化学稳定性好,具有光学,电学性质及催化能力,在光电、荧光传感器等领域已经有了广泛的应用,引起了人们对其在电化学传感领域的应用。Tian等[60]首次提出了超声剥离的C3N4 纳米片能高效地电催化H2O2还原,构建了葡萄糖电化学传感器。Mriganka等[61]通过自组装合成C3N4,由于对Hg2+的吸附,采用阴极溶出伏安法检测Hg2+。另外,六方氮化硼片(h-BN)也是和石墨烯有类似结构,B原子和N原子以sp2杂化形成蜂窝状结构。其结构稳定,环保,在电化学生物传感领域里也有所应用[62]。Xu等[63]将h-BN和壳聚糖混合负载了过氧化氢酶,实现了酶的直接电化学,灵敏地检测了氯吡脲。由于h-BN难以分散在许多的水溶液或有机溶剂中,且本身导电性差,所以其在电化学传感领域的应用受到限制。但是最近很多研究发现,可以改善BN的电学和磁学性质,如掺杂碳元素可以增强其导电性。对BN材料的不断挖掘,会进一步延伸其在电化学传感的应用。
3.3.2 层状双硫属化物 在过去的几年里,类石墨烯二维纳米材料受到了高度关注[64]。特别是层状过渡金属双硫属化物,它们与石墨有类似的层状结构,其中有一些还具有半导体特性,如MoS2, WS2等。单层过渡金属双硫属化物可以用MX2来表达,M代表过渡金属,如Mo, V, Hf, W等元素; X代表硫属化物,包括S, Se, Te。由于它们独特的化学和物理性质,在催化、能源储存、电子设备、传感等领域受到广泛关注[65]。
MoS2作为层状双硫属化物的代表之一,它具有与石墨类似的层状结构,Mo原子层夹在两个S原子层之间,以极强的共价键作用在一起,而分子层之间通过较弱的范德华作用力堆叠在一起,这样,原子或分子插入在MoS2层中而不会影响层内的结构。通过机械剥离、液相剥离或化学气相沉积等方法剥离成单层或几层的MoS2在电化学传感中具有很大的应用潜力。Li等[65]利用机械剥离得到的薄层MoS2的半导体性质制备了NO气体传感器。而在MoS2层中插入一些碳材料和金属或金属氧化物纳米颗粒[66,67](如Au、Ag、Pt等)往往会对电催化起到协同效应。Huang等[68]通过修改的L-半胱氨酸辅助的溶液相方法合成了层状的MoS2-石墨烯复合物,构建了醋氨酚电化学传感器。该复合物修饰的玻碳电极与单独的石墨烯修饰的玻碳电极和裸玻碳电极相比,对醋氨酚的电化学响应更好,表明其具有更好的电子转移能力。Huang等[69]还通过水热合成了MoS2和碳纳米管复合物,制得了电化学DNA生物传感器。Su等[70]将MoS2纳米片和Au纳米颗粒通过水热法合成了纳米复合物,该复合物对多巴胺有很好的电催化活性,并不受抗坏血酸的干扰。Sun等[71]利用电沉积的方法制备了MoS2纳米片和Au纳米颗粒复合膜,可以同时检测抗坏血酸、多巴胺和尿酸。
4 总结与展望
无机层状材料固载客体分子的方式主要分为直接嵌入法和间接嵌入法,其中,通过间接嵌入法获得的无机纳米片能够根据客体分子的大小调整层间距,可不受固载分子的大小限制。本文分别对阴离子型层状材料(水滑石)、阳离子型层状材料(粘土、TiO2、α-磷酸锆)和非离子型层状材料(石墨、MoS2)在电化学传感中的应用进行介绍。近年来的研究表明,无机层状材料由于其低维的开放结构、化学稳定,生物兼容等性质,在电化学传感器中的应用越来越受到关注。例如,由石墨剥离得到的石墨烯材料表面含有缺陷、易官能团化、导电性好,并且,石墨烯材料常含有杂质,掺入B, S, N等杂环原子可以极大地增强其电化学性质,在电化学传感中已经得到广泛应用。另外,无机层状材料与其它材料的复合,如金属纳米颗粒、导电聚合物、有机小分子等,表现出优良的电化学性质,可以促进电子转移或有利于客体分子的组装,拓展了其在电化学传感中的应用。
而提高灵敏度和选择性一直是层状材料在电化学传感中应用追求的目标,一些层状材料本身导电性差、难以剥离,不易分散等缺陷限制其发展,因此对这些材料的性质的研究和多样化设计还具有很大的发展空间,此外,如何发展新型层状材料在电化学传感中应用也是目前面临的一个的挑战。endprint
References
1 Ren L, He J, Zhang S, Evans D G, Duan X. J. Mol. Catalysis B: Enzymatic, 2002, 18(1-3): 3-11
2 Wang J. Chem. Rev., 2008, 108(2): 814-825
3 Chen D, Feng H B, Li J H. Chem. Rev., 2012, 112(11): 6027-6053
4 Saei A A, Najafi-Marandi P, Abhari A, Guardia M, Dolatabadi J E N. TRAC-Trend. Anal. Chem., 2013, 42: 216-227
5 Mascini M, Guilbault G G. Anal. Chem., 1997, 49(6): 795-798
6 Ansari S A, Husain Q. Biotechnol. Adv., 2012, 30(3): 512-523
7 Fu G G, Yue X L, Dai Z F. Biosens. Bioelectron., 2011, 26(9): 3973-3976
8 Gunjakar J L, Kim T W, Kim H N, Kim I Y, Hwang S J. J. Am. Chem. Soc., 2011, 133 (38): 14998-15007
9 Liu A, Wei M, Honma I, Zhou H. Anal. Chem., 2005, 77(24): 8068-8074
10 Gong J M, Guan Z Q , Song D D. Biosens. Bioelectron., 2013, 39(1): 320-323
11 Solin S A. J. Mol. Catal., 1984, 27: 293-303
12 Ramakrishna M H S S, Gomathi A, Manna A K, Late D J, Datta R, Pati S K, Rao C N R. Angew. Chem., 2010, 122(24): 4153-4156
13 Zhang L, Zhang Q, Lu X B, Li J H. Biosens. Bioelectron., 2007, 23(1): 102-106
14 Nicolosi V, Chhowalla M, Kanatzidis M G, Strano M S, Coleman J N. Science, 2013, 340(6139): 1226419-1
15 Ma R Z, Liu Z P, Li L, Iyi N, Sasaki T. J. Mater. Chem., 2006, 16: 3809-3813
16 Hibino T, Kobayashi M. J. Mater. Chem., 2005, 15: 653
17 Eda G, Yamaguchi H, Voiry D, Fujita T, Chen M W, Chhowalla M. Nano Lett., 2011, 11(12): 5111-5116
18 Wang Q, O′Hare D. Chem. Rev., 2012, 112(7): 4124-4155
19 ZHAN Tian-Rong, CHEN Hui, HOU Wan-Guo. Acta Chem., 2011, 74(11): 1033-1040
詹天荣, 陈 慧, 侯万国. 化学通报, 2011, 74(11): 1033-1040
20 Chen X, Fu C L, Wang Y, Yang W S, Evans D G. Biosens. Bioelectron., 2008, 24(3): 356-361
21 Liu L M, Jiang L P, Liu F, Lu G Y, Abdel-Halim E S, Zhu J J. Anal. Methods, 2013, 5: 3565-3571
22 Fernández L, Ledezma I, Borrás C, Martínezb L A, Carrero H. Sens. Actuators B, 2013, 182: 625-632
23 Zhu Z H, Qu L N, Guo Y Q, Zeng Y, Sun W, Huang X T. Sens. Actuators B, 2010, 151: 146-152
24 Jin R R, Li L F, Lian Y H, Xu X F, Zhao F. Anal. Methods, 2012, 4(9): 2704-2710
25 Chen Z B, Guo J X, Zhou T, Zhang Y W, Chen L. Electrochim. Acta, 2013, 109 : 532-535
26 Li M G, Ni F, Wang Y L, Xu S D, Zhang D D, Chen S H, Wang L. Electroanal., 2009, 21(13): 1521-1526
27 Mousty C. Anal. Bioanal. Chem., 2010, 396(1): 315-325
28 Charmantray F, Touisni N, Hecquet L, Mousty C. Electroanal., 2013, 25(3): 630-635endprint
29 Kesik M, Kocer O, Kanik F E, Unlu N A, Rende E, Aslan-Gurel E, Rossi R M, Udum Y A, Toppare L. Electroanal., 2013, 25(8): 1995-2006
30 Seleci M, Ag D, Yalcinkaya E E, Demirkol D O, Guler C, Timur S. RSC Adv., 2012, 2(5): 2112-2118
31 Demir B, Seleci M, Ag D, Cevik S, Yalcinkaya E E, Demirkol D O. RSC Adv., 2013, 3(20): 7513-7519
32 Zhao X J, Mai Z B, Kang X H, Zou X Y. Biosens. Bioelectron., 2008, 23(7): 1032-1038
33 Sasaki T, Watanabe M, Michiue Y, Komatsu Y, Izumi F, Takenouchi S. Chem. Mater., 1995, 7(5): 1001-1007
34 Wang L Z, Sasaki T. Chem. Rev., 2014, 114 (19): 9455-9486
35 Wang Q G, Gao Q M, Shi J L. Langmuir, 2004, 20(23): 10231-10237
36 Zhang L, Zhang Q, Li J H. Adv. Funct. Mater., 2007, 17(12): 1958-1965
37 Han Z P, Fu J, Ye P, Dong X P. Enzyme Microb. Technol., 2013, 53(2): 79-84
38 Yuan S, Peng D H, Song D D, Gong J M. Sens. Actuators B, 2013, 181: 432-438
39 ZHOU Gui-Feng, WANG Qin, ZENG Ren-Quan, FU Xiang-Kai, YANG Xin-Bin. Prog. Chem., 2014, 26(1): 87-99
周贵凤, 王 勤, 曾仁权, 傅相锴, 杨新斌. 化学进展, 2014, 26(1): 87-99
40 GENG Li-Na, XIANG Ming-Hui, LI Na, LI Ke-An. Prog. Chem., 2004, 16(5): 718-727
耿利娜, 相明辉, 李 娜, 李克安. 化学进展, 2004, 16(5): 718-727
41 Zhang Y H, Chen X, Yang W S. Sens. Actuators B, 2008, 130 (2): 682-688
42 Liu Y G, Lu C L, Hou W H, Zhu J J. Anal. Biochem., 2008, 375 (1): 27-34
43 Liu L M, Shen B, Shi J J, Liu F, Lu G Y, Zhu J J. Biosens. Bioelectron., 2010, 25(12): 2627-2632
44 Liu L M, Wen J W, Liu L J, He D Y, Kuang R Y, Shi T Q. Anal. Biochem., 2014, 445: 24-29
45 Santiago-Berríos M B, Declet-Flores C, David A, Borrero S, Ve-lez M M, Díaz-Díaz A, Guadalupe A R, Colon J L. Langmuir, 2012, 28(9): 4447-4452
46 Jiang H J. Small, 2011, 7(7): 2413-2427
47 Ku S H, Palanisamy S, Chen S M. J. Colloid Interface Sci., 2013, 411: 182-186
48 WANG Lu, ZANG Xiao-Huan, WANG Chun, WANG Zhi. Chinese J. Anal. Chem., 2014, 42(1): 136-144
王 璐, 臧晓欢, 王 春, 王 志. 分析化学, 2014, 42(1): 136-144
49 Zhu J, Chen X, Yang W S. Sens. Actuators B, 2010, 150(2): 564-568
50 Fu C L, Yang W S, Chen X, David G E. Electrochem. Commun., 2009, 11(5): 997-1000
51 Kuila T, Bose S, Khanra P, Mishra A K, Kim N H, Lee J H. Biosens. Bioelectron., 2011, 26(12): 4637-4648
52 Zeng Q, Cheng J S, Tang L H, Liu X F, Liu Y Z, Li J H, and Jiang J H. Adv. Funct. Mater., 2010, 20(19): 3366-3372endprint
53 Kang X H, Wang J, Wu H, Ilhan A A, Liu J, Lin Y H. Biosens. Bioelectron., 2009, 25(4): 901-905
54 Huang K J, Niu D J, Sun J Y, Han C H, Wu Z W, Li Y L, Xiong X Q. Colloids Surf. B, 2011, 82(2): 543-549
55 Zhu X L, Sun L Y, Chen Y Y, Chen G N, Huang J X, Tang D P. Biosens. Bioelectron., 2013, 47: 32-37
56 Su B L, Tang J, Yang H H, Chen G N, Huang J X, Tang D P. Electroanal., 2011, 23(4): 832-841
57 Zhang Y Y, Bai X Y, Wang X M, Shiu K K, Zhu Y L, Jiang H. Anal. Chem., 2014, 86(19): 9459-9465
58 Liu R J, Li S W, Yu X L, Zhang G J, Zhang S J, Yao J N, Keita B, Nadjo L, Zhi L J. Small, 2012, 8(9): 1398-1406
59 Gao Y S, Xu J K, Lu L M, Wu L P, Zhang K X, Nie T, Zhu X F, Yao W. Biosens. Bioelectron., 2014, 62: 261-267
60 Tian J Q, Liu Q, Ge C J, Xing Z C, Abdullah M A, Abdulrahman O A, Sun X P. Nanoscale, 2013, 5(19): 8921-8924
61 Mriganka S, Sudip B. J. Mater. Chem. A, 2013, 1(8): 2752-2756
62 Xu M S, Liang T, Shi M M, Chen H Z. Chem. Rev., 2013, 113(5): 3766-379
63 Xu Q, Cai L J, Zhao H J, Tang J Q, Shen Y Y, Hu X Y, Zeng H B. Biosens. Bioelectron., 2015, 63: 294-300
64 Chhowalla1 M, Shin H S, Eda G, Li L J, Loh K P, Zhang H. Nat. Chem., 2013, 5: 263-275
65 Li H, Yin Z Y, He Q Y, Li H, Huang X, Lu G, Fam D W H, Tok A I Y, Zhang Q, Zhang H. Small, 2012, 8(1): 63-67
66 Yuwen L H, Xu F, Xue B, Luo Z, Zhang Q, Bao B, Su S, Weng L, Huang W, Wang L H. Nanoscale, 2014, 6(11): 5762-5769
67 Huang X, Zeng Z, Bao S, Wang M, Qi X, Fan Z, Zhang H. Nat. Commun., 2013, doi: 10.1038/ncomms2472
68 Huang K J, Wang L, Li J, Liu Y M. Sens. Actuators B, 2013, 178: 671-677
69 Huang K J, Liu Y J, Wang H B, Wang Y Y, Liu Y M. Biosens. Bioelectron., 2014, 55: 195-202
70 Su S, Sun H F, Xu F, Yuwen L H, Wang L H. Electroanal., 2013, 25(11): 2523-2529
71 Sun H F, Chao J, Zuo X L, Su S, Liu X F, Yuwen L H, Fan C H, Wang L H. RSC Adv., 2014, 4(52): 27625-27629endprint

