温度、光照和磷酸盐脉冲输入对三角褐指藻的交互影响
周慧敏,冯剑丰,朱 琳,李文娇 (南开大学环境科学与工程学院,污染过程与环境基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
温度、光照和磷酸盐脉冲输入对三角褐指藻的交互影响
周慧敏,冯剑丰*,朱 琳,李文娇 (南开大学环境科学与工程学院,污染过程与环境基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
研究了光照和温度联合作用下磷酸盐脉冲输入对三角褐指藻生长的影响.结果表明随着温度的升高,磷酸盐脉冲输入频率对三角褐指藻生长的影响趋于显著,连续添加磷酸盐和低频脉冲更有利于三角褐指藻快速增长,但较高的光照强度[125μmol/(m2·s)]和较高的温度(18℃、25℃)同时作用将抑制三角褐指藻的磷酸盐吸收能力.研究证实了温度、光照和脉冲对三角褐指藻的生长存在交互影响.
磷酸盐脉冲输入;温度;光照;交互作用;浮游植物
随着经济的快速发展,大量生产和生活废水排放入海,导致我国近岸海域水质不断恶化,富营养化程度日趋严重,藻华灾害频发[1-2].藻华的发生包括了一系列复杂的海洋学和生态学过程,是各种环境因素综合作用的结果.营养物质作为生物生长的限制性因素,在藻华形成过程中有非常重要的作用[3-5].近岸海域的营养盐输入主要有陆源输送、与开放海域的海水交换、沉积物与水界面交换和大气沉降等方式.在工农业比较发达的沿海地区,近海区域的营养盐浓度水平很大程度上取决于陆源营养物的输入强度及频度.陆源营养盐的输入方式有连续输入和脉冲输入两种形式[6-7]. 由降水决定的陆源输入具有高度的脉冲特征,从而导致近海区域营养盐水平的脉冲性响应[8-9].营养盐脉冲输入可以理解为“营养盐间歇性的大量供给”[10]或“营养物质含量在短时间内快速增高的低频发生行为”[11-12]. 营养盐脉冲输入可导致短期内可利用营养盐浓度的大幅度变化,从而影响生物生长,改变种群数量及群落结构[13-18].研究发现营养盐输入的时间差异性(输入频率的变化)在赤潮藻类的生长过程中可能会发挥更大的作用[19-22].藻华的形成是多种因素共同作用的结果,除营养盐之外,温度与光照也是影响藻类生长的重要环境因子.目前相关研究多侧重于单个环境因子(温度或光照)的研究,对于多种环境因子与营养盐脉冲的交互作用的研究还比较少.考虑到藻华形成过程的复杂性以及其中关键环境因子可能存在的交互作用,本文进行了光照和温度联合作用下营养盐脉冲输入对典型赤潮藻类—三角褐指藻生长的影响.由于目前我国近海处于总氮严重超标状态,N/P比值严重失衡,我国海域整体处于严重的磷胁迫压力下[23].因此本文选择磷酸盐为限制性营养盐,探讨不同温度和光照强度下不同脉冲方式添加磷酸盐对三角褐指藻生长的影响.
1 材料与方法
1.1 实验设计
本研究选取我国近岸海域的典型赤潮藻三角褐指藻(Phaeodactylum tricornutum.)作为实验藻种.实验在3个温度水平(10,18,25℃)和2个光照水平[31.25,125μmol/(m2·s)]正交下进行.每一个水平下磷酸盐添加方式为4种频率的脉冲,分别是每天投加1次磷酸盐、每2d投加1次磷酸盐、每4d投加1次磷酸盐和每8d投加1次磷酸盐.其中在1个周期内(8d)磷酸盐(NaH2PO4)加入的总量是相同的,添加方式如表1.在每次实验接种的第1d投加所需磷酸盐,每次实验时间为3个周期,共24d.整个实验周期内氮均处于充足状态(N/P>16).

表1 四种脉冲输入模式下磷酸盐的供给量Table 1 The supply amount of phosphate in four pulse modes
1.2 藻种接种及培养
实验所用藻种为三角褐指藻(硅藻门,羽纹纲,褐指藻目,褐指藻属),由中科院海洋研究所提供,在光照培养箱内培养,温度为(23±1)℃,光照强度为93.75μmol/(m2·s),周期为L:D = 12:12.采用f/2改良培养基[19],人工海水(AW)的配制参考人工海水介质[20].
三角褐指藻保存在f/2AW培养基中,每5d转接种一次,重复2次,所得三角褐指藻浓度经镜检计数均超过5×106cells/mL时,便可作为实验藻种.实验前,将处于指数增长期的藻液进行离心(3000r/min),将离心后的藻种转入无磷培养基中饥饿培养3d.经过饥饿培养后取一定体积(约20mL)的藻种以3000r/min的速度离心10min,弃掉上清液,用无菌人工海水洗涤后再离心,重复3次,稀释后接种至实验培养基.实验在添加了100mL培养基的体积为250mL锥形瓶中进行,每个实验组设置3个平行,每天人工摇动3~4次[21],每天在同一时间取样,用生物显微镜测定藻细胞密度,并且按照不同脉冲方式添加营养盐.
1.3 藻细胞计数
采用血球计数板计数的方法,每天取样在生物显微镜下检测细胞数量(误差在5%以内).接种的当日起为第1d,三角褐指藻的初始接种密度2×104cells/mL.将每天的细胞数量相加,得到实验周期内的细胞总量.
1.4 比生长率计算
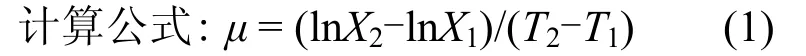
式中:X2为某一时间间隔终结时的藻类现存量;X1为某一时间间隔开始时的藻类现存量;T2-T1为某一时间间隔.
由于磷酸盐的脉冲式添加导致营养物质浓度在短时间内急剧变化会直接影响藻类的生长,即生长率的变化.而三角褐指藻在适合的条件下可以迅速繁殖(生长率>1d-1).因此比生长率的短期变化(比如2~3d)更能体现三角褐指藻对营养盐脉冲输入的响应.本实验为24d,分为了3个周期(1~8d、9~16d、17~24d),这3个周期大致对应了藻类生长的3个阶段:生长延缓期、指数增长期及稳定增长期.相比于每个周期内比生长率的平均值,每个周期内比生长率的最大值(μmax)更能反映微藻对营养盐脉冲输入的短期响应.本文选择μmax作为微藻的短期响应指标进行研究.首先通过公式(1)计算每天的比生长率μ,然后按周期分别得到每个周期内比生长率的最大值μmax.分析温度、光照和脉冲对三角褐指藻μmax的影响.
2 结果与讨论
2.1 不同温度和光照条件下磷酸盐脉冲输入频率对三角褐指藻μmax的影响
在第1周期内,无论单因子还是多因子对三角褐指藻μmax的影响均不显著.在指数增长期内(第2个周期)脉冲输入方式在不同温度和光照条件下对三角褐指藻μmax的影响如图1.
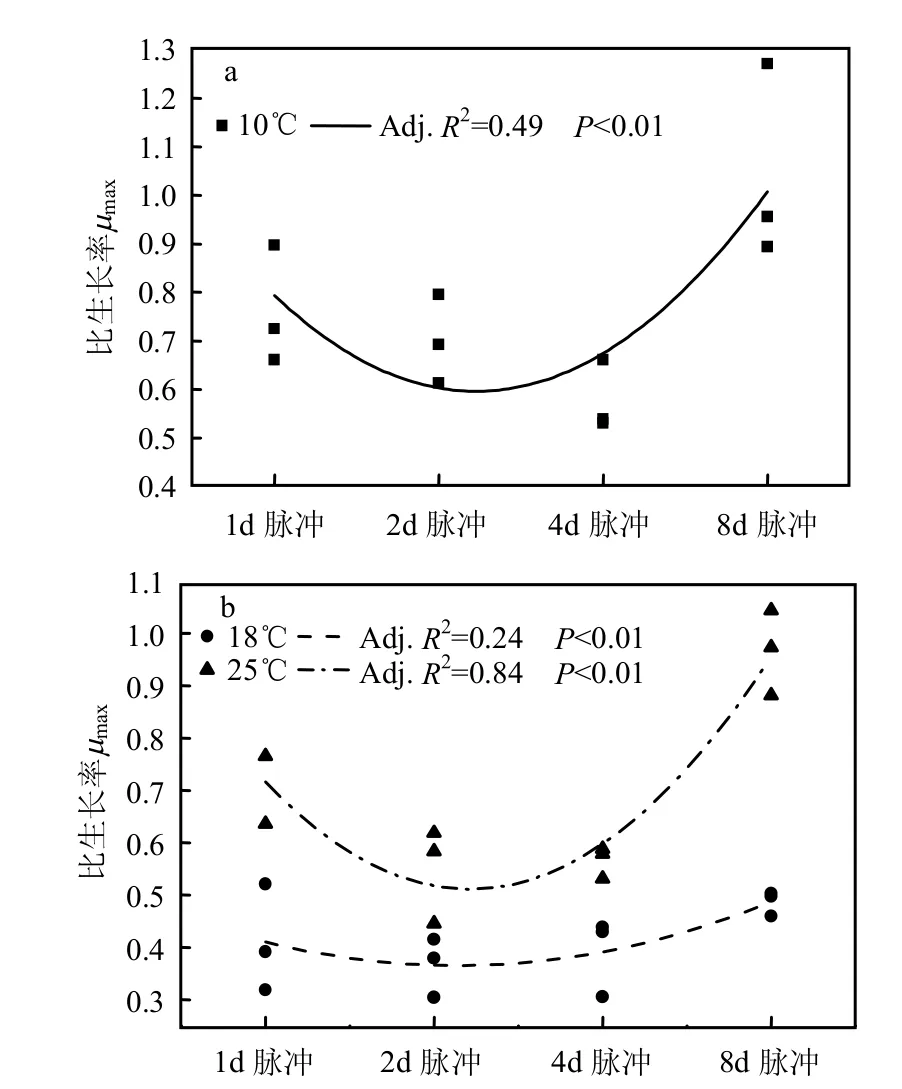
图1 指数增长期脉冲输入对三角褐指藻μmax的影响Fig.1 The effects of phosphate pulse on μmaxtricornutum in exponential growth phase
低光照时,在低温(10℃)下随脉冲频率的降低μmax先降低后升高,中等频率脉冲的μmax较小,低频和连续添加方式下μmax值较大;而在中温(18℃)和高温条件下(25℃)变化趋势均不明显.在高光照下,中温(18℃)和高温(25℃)下μmax均呈现先下降后上升的趋势,中等频率脉冲下μmax值小于低频和连续添加方式.低温条件下(10℃)μmax变化趋势不明显.
低温下(10℃),脉冲输入对μmax在低光照强度下有显著影响,而高光照下影响不显著;中温(18℃)及高温下(25℃),脉冲输入对μmax在高光照强度下有显著影响,而低光照下影响不显著.

图2 稳定增长期脉冲输入对三角褐指藻μmax的影响Fig.2 The effects of phosphate pulse on μmax(Phaeodactylum tricornutum.) in stable growth phase
在稳定增长期内(第3周期),低光照时,中温(18℃)和高温下(25℃)下,μmax随着脉冲频率的降低整体呈现出升高趋势(图2a),低频脉冲(8d)下μmax值大于另外3种脉冲.高光照时, 中等温度(18℃)下μmax随着脉冲频率降低而增大.高温(25℃)下曲线呈现出先增加后降低的变化趋势,中等频率脉冲下μmax值大于低频脉冲和连续添加方式.
低温下(10℃),脉冲输入频率对三角褐指藻的μmax的影响均不显著;中温下(18℃),随着光照增强,μmax随着脉冲频率的降低整体呈现出升高趋势;高温下(25℃),μmax曲线变化基本一致,但在高光照强度下,低频脉冲(8d1次)下μmax显著下降.
2.2 不同温度和光照条件下磷酸盐脉冲输入频率对三角褐指藻细胞数量的影响
低温低光照下(图3a),三角褐指藻在第12d进入对数增长期,8d脉冲下波动较大.藻细胞平均密度最大值分别为6.34×106, 6.88×106,6.74×106, 6.97×106cells/mL.高光照下(图3b),第9d进入对数增长期,连续添加方式下藻生长比较平稳,其余3种脉冲方式下藻密度波动较大.藻细胞平均密度最大值分别为6.35×106, 6.85×106,5.63×106, 6.0×106cells/mL.

图3 10℃磷酸盐脉冲式输入对三角褐指藻生长的影响Fig.3 Effects of phosphate pulse on Phaeodactylum tricornutum under 10℃
温度为18℃光照为31.25μmol/(m2·s)(图4a)下,三角褐指藻在第6d左右进入对数增长期.1d脉冲频率下藻平均密度稳定上升,在16d以后占据较大的优势,在21d后趋于稳定,藻平均密度最大值出现在23d,为9.47×106cells/mL.而2d和4d脉冲藻密度最大峰值分别为8.34×106cells/mL和7.99×106cells/mL,2d脉冲藻密度变化呈现出波动性.8d脉冲下的藻密度曲线波动更大,在第19d出现了最大峰值,为8.29×106cells/mL,随后由于营养物质的消耗,藻细胞平均数量开始下降. 在光照为125μmol/(m2.s)条件(图4b)下,藻细胞平均数量整体大于低光照条件下.在第6d进入对数增长期.8d脉冲下,有一些波动,在第15d达到第一个峰值,为5.66×106cells/mL,随后稍有下降,在17d后继续增加,最大值出现在24d,为1.21× 107cells/mL.1d脉冲下藻密度最大值为1.12× 107cells/mL.2d脉冲和4d脉冲最大值分别为1.25×107,1.1×107cells/mL.

图4 18℃磷酸盐脉冲式输入对三角褐指藻生长的影响Fig.4 Effects of phosphate pulse on Phaeodactylum tricornutum under 18℃
由图5发现, 25℃、125μmol/(m2·s)时最大藻平均密度值明显大于31.25μmol/(m2·s)条件下的,4种脉冲生长曲线也有较大差别.在温度为25℃光照为31.25μmol/(m2·s)条件下,第7d左右进入对数期,1d脉冲下藻细胞稳定的上升,占据明显优势,藻平均密度最大值为6.09×106cells/mL.其余3种脉冲有较大的波动,并且波动周期与磷酸盐添加周期大致相关,藻平均密度最大值分别为6.01×106,6.20×106,6.99×106cells/mL.光照为125μmol/(m2·s)时,藻平均密度值达到了所有条件下最大值,明显大于其它温度、光照条件下的最大藻密度.第6d进入对数增长期,在初始阶段也是1d脉冲稍占优势,藻平均密度值大于其余3种.8d脉冲在实验的第10d才开始快速增长,生长曲线与脉冲添加频率基本一致.4种脉冲下藻平均密度最大值分别为1.07×107,1.62×107,1.44×107,1.24×107cells/mL.

图5 25℃磷酸盐脉冲式输入对三角褐指藻生长的影响Fig.5 Effects of phosphate pulse on Phaeodactylum tricornutum under 25℃
对于细胞总量来说,在低光照条件下(图6a,c,e),无论低温、中温或高温,连续添加磷酸盐脉冲方式下的藻细胞总量始终占据明显优势,而低频率脉冲(8d脉冲)随着温度的升高,藻细胞总量逐渐显现优势(图6c,e),但是整体上仍小于1d脉冲;在高光照条件下(图6b,d,f),连续添加磷酸盐脉冲方式下的藻细胞总量在低温和中温下仍然占据优势(图6b,d),但在高温条件下(25℃,图6f),中等添加磷酸盐脉冲方式(2d和4d)下的藻细胞总量占据明显优势,而连续添加(1d)和低频脉冲(8d)下的藻细胞总量较低.
2.3 讨论
本文采用实验的研究手段,模拟不同环境条件(温度、光照)下磷酸盐脉冲输入对三角褐指藻生长的影响.在三角褐指藻的指数增长期,低光照低温(10℃,图1a)及高光照较高温度下(18℃,25℃,图1b),最大生长率μmax随磷酸盐输入频率的降低,均呈现出先降低后升高的显著变化趋势(图1,P<0.01).中等频率的磷酸盐脉冲下,三角褐指藻具有相对较小的最大生长率μmax.也就是说,对于处于指数增长期的三角褐指藻,连续性的脉冲输入和低频率的脉冲输入都可能促进藻类生长率在短期内升高.而低频率脉冲(8d1次)相对于连续性的脉冲输入(1d1次),三角褐指藻具有更大的μmax.在三角褐指藻的稳定增长期内,只有低温下(10℃)磷酸盐输入频率的变化影响不明显. 在较高温度下(18℃,25℃),最大生长率μmax随磷酸盐输入频率的降低,基本均呈现出升高的显著变化趋势(图2,P<0.01).与指数增长期类似,三角褐指藻在磷酸盐低频脉冲下(8d1次)均具有较大的μmax.对于细胞数量而言,本文的结果也表明,连续脉冲(1d1次)和低频脉冲输入下,三角褐指藻整体上具有较大的细胞总量(图6a,c,d,e),这与三角褐指藻的μmax的变化趋势基本一致(图1,2).
低频脉冲方式下(8d1次)磷酸盐间歇性的大量供给增加了短期内磷酸盐的可利用量.对于营养盐的浓度变化,浮游植物存在三种生理响应策略:生长策略、亲和策略和储存策略[24].由于三角褐指藻具有较高的生长率,是典型的“生长策略”者. 因而在磷酸盐浓度增加时,会快速吸收从而获得较高的生长率,这种现象在稳定增长期表现的更为突出(图2).观察细胞生物量的变化趋势(图3~图5),我们发现,在磷酸盐脉冲输入条件下,藻细胞密度呈现出与脉冲输入频率一致的波动性,相关的研究也证实了这一点[22].这种现象表明,三角褐指藻具有较快的生长速率,并能及时的反映到细胞数量上(细胞密度).

图6 不同温度和光照下三角褐指藻细胞总量的变化Fig.6 Changes of the total Phaeodactylum tricornutum biomass in different temperature and light
Sofie等[21]的研究结果也表明,高浓度营养盐脉冲可能会极大的促进有害赤潮藻的爆发性增殖,与本文的实验研究结果相一致.但值得注意的是,在稳定增长期,高光照和高温下,三角褐指藻的μmax和细胞总量均有所降低(图2b,图6f).这种现象表明,三角褐指藻的营养物的吸收能力跟温度和光照强度均有关系.较高的光照强度和较高的温度同时作用降低了三角褐指藻藻细胞的磷酸盐吸收能力,导致μmax有所降低(图2b).藻类的光合自养特性和光辐射作为生态系统的能量来源,决定了光辐射是影响藻类生长的重要因子之一.而温度则会直接影响藻类的生长速率乃至种群演替变化.藻华的形成涉及复杂的物理、化学和生物过程,是多种因素共同作用的结果.本文的研究也表明,只有在一定的温度和光照条件下,磷酸盐输入频率的变化才会对三角褐指藻的生长产生显著影响(P<0.01).证实了营养盐、温度和光照作为影响浮游植物生长的重要环境因子,具有显著的交互作用.而其生理生态学机制有待进一步研究.
3 结语
随着温度的升高,磷酸盐脉冲输入频率对三角褐指藻生长的影响趋于显著,整体上呈现出连续输入(1d1次)和低频脉冲(8d1次)更能促进三角褐指藻生长的特征.但较高的光照强度和较高的温度同时作用将抑制三角褐指藻的磷酸盐吸收能力,降低其生长率和细胞数量.这些结果表明,温度、光照和磷酸盐脉冲输入频率对三角褐指藻的生长存在显著影响,并且存在交互作用.
[1]周名江,于仁成.有害赤潮的形成机制、危害效应与防治对策[J]. 自然杂志, 2007,29(2):72-77.
[2]Fu F X, Tatters A O, Hutchins D A. Global change and the future of harmful algal blooms in the ocean [J]. Marine Ecology Progress Series, 2012,470:207-233.
[3]徐 宁,王 萌,孙凯峰,等.有机氮对大亚湾亚历山大藻种群生长的促进作用 [J]. 中国环境科学, 2012,32(3):504-509.
[4]Liu H, Laws E A, Villareal T A., Nutrients-limited growth of Aureoumbra lagunensis (Pelagophyceae), with implications for its capability to outgrow other phytoplankton species in phos phate-limited environments [J]. Phycology, 2001,37(4):500-508.
[5]TWOMEY L, THOMPSON P. Nutrient limitation of phytoplankton in a seasonally open bar-built estuary: Wilson Inlet, Western Australia [J]. Phycology, 2001,37(1):16-29.
[6]刘亚林.营养盐输入对富营养河口、海湾微藻群落的影响 [D].青岛:中国海洋大学, 2007.
[7]牛海凤.磷酸盐脉冲输入对海洋浮游植物的影响 [D]. 天津:南开大学, 2013.
[8]Glibert P M, Harrison J, Heil C, et al. Escalating worldwide use of urea - a global change contributing to coastal eutrophication[J]. Biogeochemistry, 2006,77:441-63.
[9]Glibert P M, Magnien R, Lomas M W, et al. Harmful algal blooms in the Chesapeake and coastal bays of Maryland, USA: Comparison of 1997, 1998, and 1999events [J]. Estuaries, 2001, 24:875-83.
[10]Schmidt K A. Linking frequencies of acorn masting in temperate forests to long-term population growth rates in a songbird: the Veery (Catharus fuscescens) [J]. Oikos, 2003,103:548-558.
[11]Yang L H. Periodical cicadas as resource pulses in North American forests [J]. Science, 2004,306:1565-1567.
[12]Yang L H. Interactions between a detrital resource pulse and a detritivore community [J]. Oecologia., 2006,147:522-532.
[13]Cermeño P, Lee J B, Wyman K, et al. Competitive dynamics in two species of marine phytoplankton under non-equilibrium conditions [J]. Marine Ecology Progress Series, 2011,429:19-28.
[14]Van de Waal D B, Ferreruela G, Tonk L, et al. Pulsed nitrogen supply induces dynamic changes in the amino acid composition and microcystin production of the harmful cyanobacterium Planktothrix agardhii [J]. FEMS microbiology ecology, 2010,74(2):430-438.
[15]Armitage A R, Frankovich T A, Fourqurean J W. Long-term effects of adding nutrients to an oligotrophic coastal environment[J]. Ecosystems, 2011,14(3):430-444.
[16]Van de Waal D B, Tillmann U, Zhu M, et al. Nutrient pulse induces dynamic changes in cellular C: N: P, amino acids, and paralytic shellfish poisoning toxins in Alexandrium tamarense [J]. Marine Ecology Progress Series, 2013,493:57-69.
[17]Buyukates, Y., Roelke, D. Influence of pulsed inflows and nutrient loading on zooplankton and phytoplankton community structure and biomass in microcosm experiments using estuarine assemblages [J]. Hydrobiologia, 2005,548,233-249.
[18]Yamamoto T, Hatta G. Pulse nutrient supply as a factor inducing phytoplankton diversity [J]. Ecological Modelling, 2004,171(3): 247-270.
[19]牛海凤,冯剑丰,周慧敏,等.脉冲式磷酸盐输入在不同温度对三角褐指藻生长的影响 [J]. 海洋环境科学, 2013,32(5):657-662.
[20]樊 娟.氮、磷浓度及氮输入频度对两种海洋微藻生长的影响研究 [D]. 天津:南开大学, 2010.
[21]Sofie S, George T, Daniel B D, et al. Effects of pulsed nutrient inputs on phytoplankton assemblage structure and blooms in an enclosed coastal area [J]. Estuarine, Coastal and Shelf Science,2007(73):807-815.
[22]刘亚林,韩笑天,白 洁,等.脉冲式营养盐输入对中肋骨条藻生长的影响 [J]. 海洋科学, 2008,32(2):51-55.
[23]中国近岸海域环境质量公报 [R]. 2012.环境保护部.
[24]Edwards K F, Litchman E, Klausmeier C A. Functional traits explain phytoplankton community structure and seasonal dynamics in a marine ecosystem. Ecology Letters, 2013,16:56-63
The interactive effects of temperature, light, and pulsed phosphate supply on the growth of Phaeodactylum tricornutum.
ZHOU Hui-min, FENG Jian-feng*, ZHU Lin, LI Wen-jiao (Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China). China Environmental Science, 2015,35(1):244~250
Effect of phosphate pulsed supply on the growth of Phaeodactylum tricornutum under different temperature and light levels wes explored. More significant effects of pulsed phosphate supply on Phaeodactylum tricornutum under higher temperature levels were found. The continuous phosphate supply and low-frequency pulses promoted rapid growth of Phaeodactylum tricornutum. However, the interactions of high temperature (18℃、25℃)and light intensity[125μmol/(m2·s)]would inhibit the absorption ability of Phaeodactylum tricornutum on phosphate. Results confirmed that temperature, light and pulsed phosphate supply had significant interactive influences on the Phaeodactylum tricornutum.
phosphate pulse supply;temperature;light;interaction;phytoplankton
X145
A
1000-6923(2015)01-0244-07
周慧敏(1986-),女,河南淮阳人,南开大学硕士研究生,主要从事海洋生物学研究.发表论文1篇.
2014-04-25
国家自然科学基金资助项目(41006065)
* 责任作者, 副教授, fengjf@nankai.edu.cn

