海南岛沿海牡蛎体中PAHs的时空分布及其健康风险评价
于紫玲,林 钦,孙闰霞,谷阳光,柯常亮,石凤琼(.中国水产科学研究院南海水产研究所,广东省渔业生态环境重点实验室,农业部南海渔业资源开发利用重点实验室,广东 广州 5000;2.上海海洋大学海洋科学学院,上海 2006;.中国科学院广州地球化学研究所,广东 广州 50640)
海南岛沿海牡蛎体中PAHs的时空分布及其健康风险评价
于紫玲1,2,林 钦1*,孙闰霞3,谷阳光1,柯常亮1,石凤琼1,2(1.中国水产科学研究院南海水产研究所,广东省渔业生态环境重点实验室,农业部南海渔业资源开发利用重点实验室,广东 广州 510300;2.上海海洋大学海洋科学学院,上海 201306;3.中国科学院广州地球化学研究所,广东 广州 510640)
2009~2014年对海南岛沿岸近江牡蛎(Crassostrea rivularis)体中16种PAHs的污染水平、空间分布及趋势变化进行了研究.结果表明,海南岛沿岸牡蛎体中多环芳烃(PAHs)含量范围为289~2426ng/g d.w.,平均值为856.7ng/g d.w..与国内外相比,海南岛牡蛎体PAHs含量处于中等水平.海南岛牡蛎体PAHs含量表现出一定的空间差异,平均含量大小顺序为:八所港>榆林港>马袅港>东寨港. Mann-Kendall检验结果显示,八所港牡蛎体中PAHs含量有显著上升趋势(P<0.05),而其余的变化趋势不显著(P>0.05).组分分析结果显示,海南岛牡蛎主要以2~3环的低分子量PAHs为主(62.3%~92.5%).来源分析表明牡蛎体PAHs主要为石油源和油类燃烧源.风险评价结果显示,八所港牡蛎的PAHs致癌风险超过最大可接受致癌风险(10-5),但尚未达到严重的致癌风险(10-4),而其他站点牡蛎均处于可接受致癌风险水平.本研究建议居民对八所港牡蛎和海南其它牡蛎的日均消费量分别不超过56g和 67g.
海南岛沿岸;近江牡蛎;多环芳烃;风险评价
多环芳烃(PAHs)是一类广泛存在于环境中且具有潜在“三致作用”(致癌、致畸、致突变)的持久性有机污染物(POPs).这类物质脂溶性高并且较难降解,对水生生态环境造成很大危害,并最终通过食物链等作用对人体健康构成威胁[1-2].因此,环境中PAHs问题日益受到世界各政府、组织及相关学者的普遍关注.1979年,美国环保局(USEPA)将16种PAHs列为优先控制污染物.我国首批公布的68种优先污染物中有7种属于PAHs.近几十年来,工业化和城市化的迅猛发展,环境中PAHs的输入不断增加[3],增加了环境中生物的健康风险.因此,加强对PAHs污染监测十分重要.
牡蛎等双壳类软体动物作为南海重要的养殖经济贝类,营底栖固着生长,蓄积污染物的能力较强[4],常用于海洋环境污染的指示生物[3].自1975年Goldberg等[5]提出利用贻贝或牡蛎来监测污染物以来,一些如“国际贻贝观察”、“美国贻贝观察”、“亚太地区贻贝观察”、“南海贻贝观察”等陆续展开,其中“美国贻贝观察”、“国际贻贝观察”的监测项目中便包括了PAHs[6-7].我国于20世纪80年代中期开始对南海贻贝中污染物进行监测.其中许多污染物(如HCHs、DDTs、PCBs等)已展开了持续研究[8-9].然而有关海南岛牡蛎体中PAHs残留研究甚少报道.本研究对海南岛沿岸4个重要港湾2009~2014年牡蛎体中多环芳烃(PAHs)连续监测,分析讨论了牡蛎体内PAHs的残留水平和时空分布特征,并对牡蛎的食用安全性进行了评价.旨在为后续研究提供基础数据和依据.
1 材料与方法
1.1 牡蛎采集与制备
海南岛沿海近江牡蛎(Crassostrea rivularis)采样站点如图1所示,分别为海南岛沿岸的东寨港、马袅港、八所港和榆林港4个典型港口.样品采集与处理参考国外贻贝观察[10-11]及南海贻贝污染监测的方法[8-9,12],样品采集于每年的3~4月(春季),各站点分别采集个体肥满度相近的3~4龄近江牡蛎样品30只左右,壳长在85~93mm之间,各年份站点的平均壳长无统计学差异.现场取其软组织和体液,冰冻送回实验室置-20℃下保存.冷冻样品于实验室解冻后制成混合匀浆,待分析.样品的保存和运输均参考《海洋监测规范》(GB 17378-2007)[13].
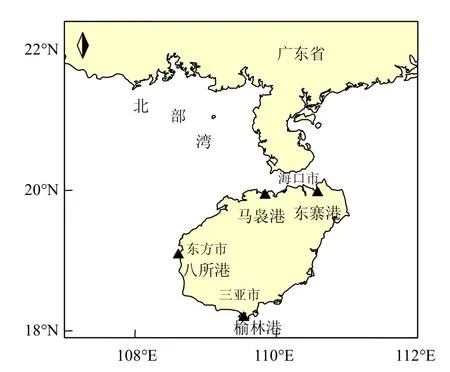
图1 海南岛沿岸牡蛎采样站点Fig.1 Sampling sites of oysters along the coast of Hainan Island
1.2 PAHs分析
1.2.1 样品前处理 牡蛎样品前处理方法参考孙闰霞等[14]建立的分析方法并对其优化.称取5.00g牡蛎匀浆样品于50mL具塞玻璃离心管中,加入20mL正己烷-二氯甲烷(2:1)混合试剂超声萃取30min,离心后将有机相转移至鸡心瓶内,重复萃取1次,合并提取液,40℃旋蒸至近干,60%硫酸脱脂,离心后取上层有机相至混合层析柱(从上至下分别为3cm无水硫酸钠、3cm中性氧化铝、3cm弗罗里硅土)净化,45mL正己烷-二氯甲烷(4:1)混合试剂洗脱.洗脱液旋蒸浓缩后用正己烷定容至1mL,待分析.
1.2.2 GC-MS分析 采用Agilent 7890A-5975C气相色谱-质谱联用仪(GC-MS),选择离子监测模式(SIM)进行PAHs的分析.色谱条件:色谱柱为HP-5MS石英毛细管柱(30m×0.32mm× 0.25μm);载气为高纯氦气(纯度>99.999%),恒流模式,流速为1.3mL/min;进样方式为脉冲不分流进样,进样量为1μL;进样口温度为290℃;程序升温条件为:初始温度50℃保持1min,20℃/min升至100℃, 10℃/min升至210℃,保持1min,最后以5℃/min升至290℃,保持5min.质谱条件:电子轰击源(EI),电子能量为70eV,离子源温度为230℃,接口温度280℃,四级杆温度150℃.
1.3 牡蛎体中PAHs的健康风险评价
1.3.1 膳食暴露量估算 PAHs通过食用牡蛎进入人体,每日膳食暴露PAHs 的计算公式如下:
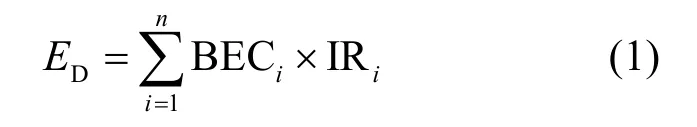
式中:BECi为牡蛎体中PAHs浓度等当量于BaP的浓度,ng/g;IRi为每天摄入该食物量g/d;
食物中PAHs等当于BaP的浓度:
PBL教学中,护生为获得问题答案,主动运用多种手段(如教材、图书馆、文献检索系统、网络及多媒体等)进行自学,与同学沟通交流,在具体实践中验证及修正答案,很大程度上锻炼了他们的沟通及理论实践能力,为以后独立走向临床护理工作岗位、减少护患矛盾打下了良好基础[5]。
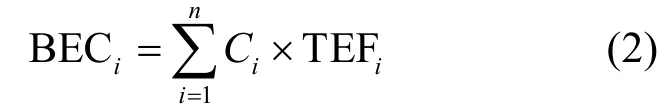
式中:BECi为牡蛎中PAHs浓度等当量于BaP的浓度;Ci为PAHs组分i在牡蛎体中的浓度,mg/kg;TEFi为组分i的毒性当量因子,16种PAHs中其中BaA、BaP、BkFA、BbFA、CHR、DBahA和IP 7种致癌PAHs采用EPA规定[15]的BaP毒性当量因子,其余PAHs采用Nisbet等[16]提出的毒性当量因子(表1).

表1 PAHs各组分的BaP毒性当量因子Table 1 BaP toxicity equivalency factor (TEFs) for individual PAHs
1.3.2 致癌风险评价 牡蛎体中PAHs的风险评价采用USEPA推荐使用的健康风险评价方法[17],计算公式如下:
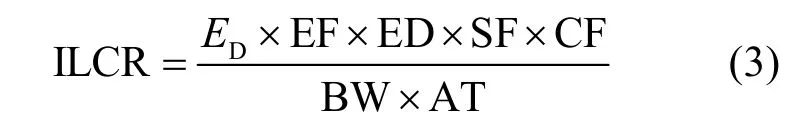
式中:ILCR为癌症风险指数;ED为每日膳食PAHs水平,ng/d;EF为暴露频率,365d/a;ED为暴露历时,通常取70a;SF为苯并[a]芘致癌强度系数,经口暴露取值为7.3mg/(kg·d);BW为人体体重,60kg;AT 为平均致癌寿命,25,550d;CF 为换算因子,10-6mg/ng.
2 结果与讨论
2.2 牡蛎体PAHs含量水平及空间分布特征
2009~2014年海南岛沿岸牡蛎体中16种PAHs总量范围为289~2426ng/g d.w.,平均值为856.7ng/g d.w. (表2).表3列出了国内外一些海域贝类体中PAHs含量,以求通过粗略的比较对海南岛牡蛎体中PAHs含量水平有一大致的了解.由表3可知,海南岛牡蛎体中PAHs含量高于深圳海域牡蛎[18],但远低于香港维多利亚港的翡翠贻贝[19].与国外相比,海南岛牡蛎体中PAHs含量略高于法国阿卡雄湾紫贻贝[20]、美国旧金山湾牡蛎[21]、东亚及东南亚沿海翡翠贻贝[22]和阿根廷布兰卡港条纹短齿蛤[23],但低于巴西瓜纳巴拉湾的翡翠贻贝[24].总的来说,海南岛沿岸牡蛎体PAHs含量与国内外其他海域相比处于中等水平.
表2和图2显示,海南岛沿岸4个站点牡蛎体PAHs含量存在一定的空间差异. 2009~2014年牡蛎体PAHs平均含量最高值出现在八所港(1320.8ng/g d.w.,下同),其它的含量由高到低依次为榆林港(793.0ng/g)、马袅港(699.3ng/g)和东寨港(613.6ng/g).其中,八所港牡蛎体中PAHs平均含量是东寨港牡蛎的2.15倍. Duncan分析结果显示(P<0.05),海南岛4个地点牡蛎体PAHs含量水平可以分2个等级,即八所港>榆林港、马袅港、东寨港.八所港牡蛎体PAHs含量较高可能与其特殊的地理位置有关.八所港作为海南重要的工业港口,以其为依托的东方市是我国最大的天然气化工城.为满足该港口化工产品及油气的输运服务,目前已发展成为6个万t级泊位、2个千t级泊位的综合性港口[25],来往船舶、港口建设及港口物流等活动可能是导致其牡蛎体PAHs含量较高的重要原因.此外,该区域工业排污、生活废水等途径也可能对八所港PAHs的输入有一定影响.与八所港不同,东寨港、马袅港等属于普通渔港, 来往船舶及人类活动对这些区域PAHs的输入相对较少.

表2 2009~2014海南岛沿岸各站点牡蛎体内PAHs含量(ng/g d.w.)Table 2 Concentrations of PAHs in oysters along Hainan Island coast from 2009to 2014 (ng/g, dry weight)
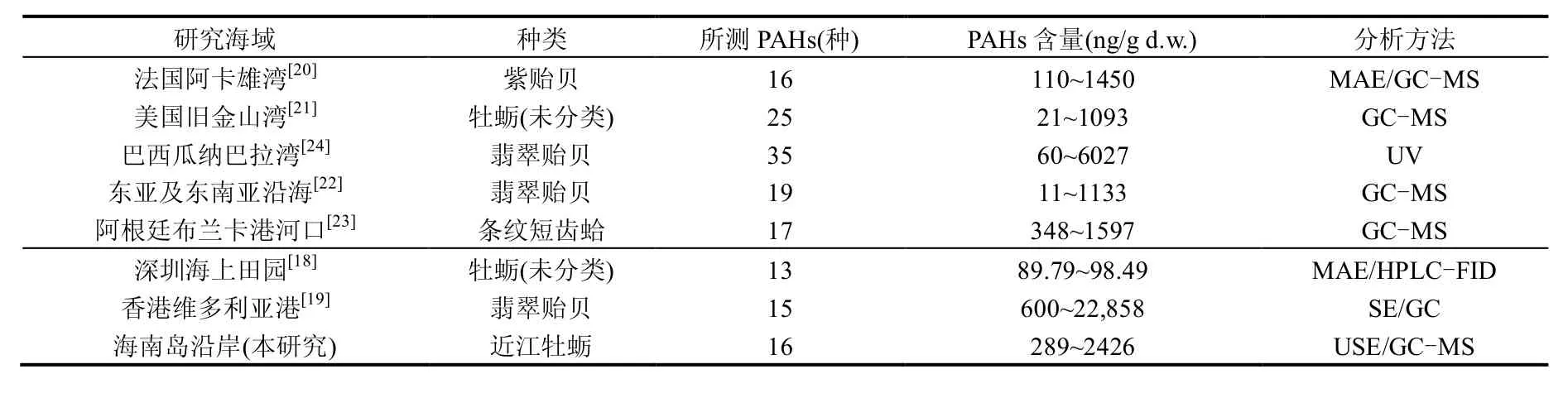
表3 海南岛沿岸牡蛎体PAHs含量与国内外比较Table 3 Comparison of PAHs levels in oysters from Hainan Island with other locations

图2 海南岛沿岸牡蛎体PAHs的空间变化Fig.2 Spatial distribution of PAHs in oysters along the coast of Hainan Island
2.2 牡蛎体PAHs年际变化
2009~2014年海南岛沿岸牡蛎体中PAHs含量年际变化如图3所示. 4个站点中,八所港牡蛎体中PAHs含量在2009~2014年间呈明显的上升趋势, 2014年达到最高值(2426ng/g,干重,下同).东寨港PAHs含量水平的年际变化与马袅港相似,均在2012年出现高值后表现出较大幅度的下降.榆林港PAHs含量除2011年明显较高(1174ng/g)外,年际间未观察到明显变化.采用Mann-Kendall[26-27]检验分析,结果表明,2009~2014年间东寨港、马袅港、八所港、榆林港的Kendall相关系数r值分别为-0.467,-0.333,0.867, 0.467.4个站点中除八所港具有显著上升趋势(P<0.05)外,其他的均没有明显的趋势变化.八所港作为环北部湾经济圈主要的贸易港口,据《海南统计年鉴-2013》[28]显示, 2009~2013年,八所港货物吞吐量由652万t增加到1277万t,据港口规划,2014年吞吐量达1500万t以上.该海域牡蛎体中PAHs含量持续升高,可能与该港口货物吞吐量变化有密切关系.因此,今后需加强对八所港海域的污染监测.总体而言,海南岛牡蛎体中PAHs平均含量略呈上升趋势(r=0.600).
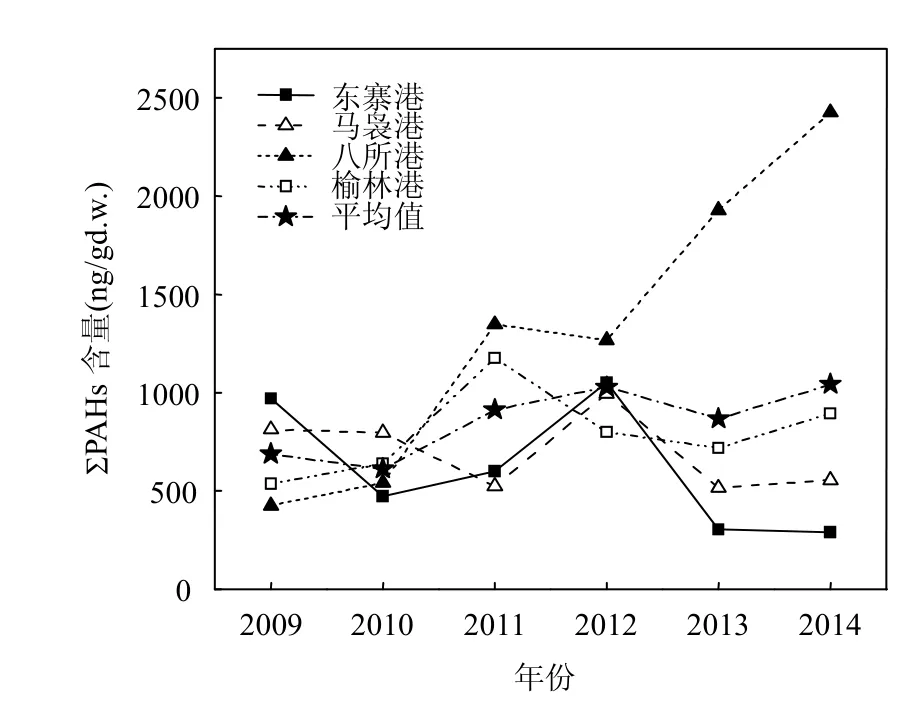
图3 海南岛各站点牡蛎体PAHs年际变化Fig.3 Temporal variations of PAHs in oysters along the coast of Hainan Island
2009~2014海南各站点牡蛎体中16种PAHs组分百分比见图4.其中2~3环的低分子量PAHs(NA、ACL、AC、FL、PHE、AN)所占比例最高,为62.3%~92.5%;4环的中分子量PAHs(PY、BaA、CHR)次之,所占比例为6.1%~23.9%;5~6环的高分子量PAHs(BbFA、BkFA、BaP、IP、DBahA、BghiP)所占比重较低为0.4%~6.4%.该研究结果与Wu等[29]对北京市售鱼样中PAHs的结果接近,其市售鱼样品中低、中和高分子量PAHs所占比例分别为85.4%~96.6%、3.3%~14.4%、0~0.5%.此外,Perugini等[30]指出意大利亚得里亚海生物体PAHs组分也存在相似的结果.本研究发现低环PAHs组分在牡蛎体内的富集较高环PAHs组分高1~2个数量级,这可能与牡蛎对水溶性PAHs的优先吸收有关[12,30].另外也有学者指出沉积物对高环PAHs的吸附也可能是高环PAHs在牡蛎等生物体中比重较低的重要原因[31-32].
就PAHs各单组分而言,16种PAHs中主要以NA、FL、PHE为主,所占比例分别为3.72%~57.56%、7.50%~25.38%、10.92%~36.42%.NA属于2环多环芳烃,易溶于水,溶解度达30mg/L[33].然而,该组分极不稳定,在样品的采集和处理过程易挥发和降解,这也许是某些站位中NA组分比重较低的一个重要原因.PHE是一种3环PAHs,主要来源于化石燃料的燃烧,能通过大气进行长距离迁移,最终经大气沉降、雨水径流等途径进入海洋环境.目前化石燃料仍然是能源供应的主要来源,这可能是牡蛎体内PHE比重较高的原因.而对于其他2~3环PAHs如ACL和AN,其在牡蛎体中虽均被检出但所占比例相对较低,这可能与组分本身易光解有关[34-35].
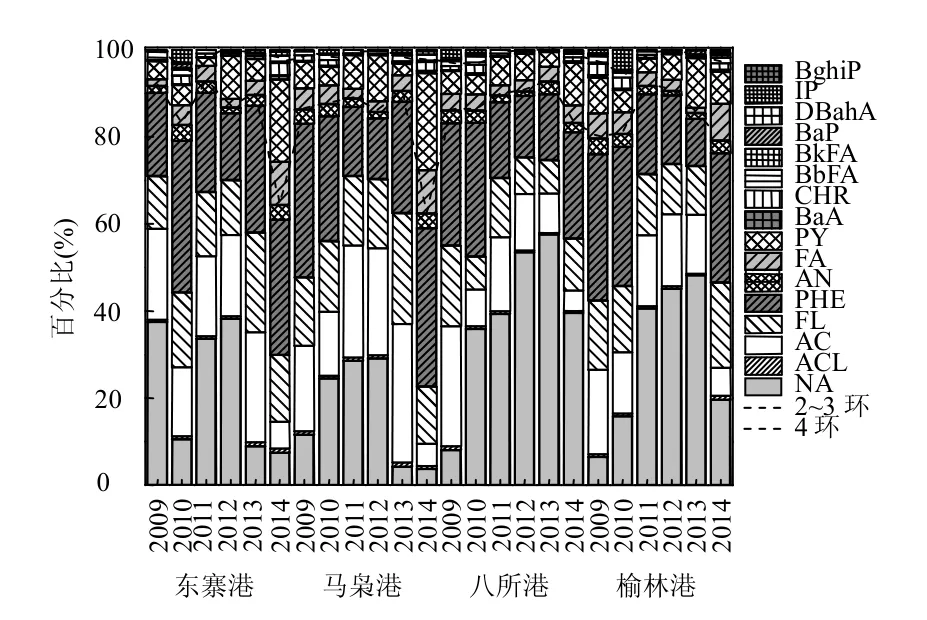
图4 海南岛牡蛎体中16种PAHs组分百分比Fig.4 Composition patterns of 16PAHs in oysters along the coast of Hainan Island
2.4 牡蛎体PAHs来源分析
一般生物体中PAHs来源分析主要采用比值法,包括轻重组分比(LMW/HMW)[36]、同分异构比值如PHE/AN[37-38]、AN/(AN+PHE)[39]、FA/(FA+PY)[23]、BaA/(BaA+CHR)[40]等.考虑到某些同分异构组分在迁移过程易分解[40]以及某些组分低于检出限情况,本研究采用FA/(FA+PY)和BaA/(BaA+CHR)两种比值对海南岛牡蛎体中PAHs的来源进行探讨,结果见图5.
海南岛牡蛎体中FA/(FA+PY)比值范围为0.10~0.67,其中石油源(FA/(FA+PY)<0.4)占45.8%,木材、煤燃烧 (FA/(FA+PY)>0.5)占29.2%,其余为石油燃烧占25%; BaA/(BaA+CHR)比值范围为0.11~0.39,其中石油源(BaA/(BaA+CHR)<0.20)占54.2%,燃烧源(BaA/(BaA+CHR)>0.35)占4.2%,其余为混合源(41.6%).综合FA/(FA+PY)和BaA/(BaA+CHR)两种判别方法(图5),其比值主要集中在石油源和油类燃烧的范围内.因此,海南岛沿岸主要表现出石油源和油类燃烧的特征.

图5 海南岛沿岸牡蛎体FA/(FA+PY)和BaA/(BaA+CHR)比值Fig.5 Isomeric ratios of FA/(FA+PY) and BaA/(BaA+ CHR) in oysters along the coast of Hainan Island
2.5 健康风险评价
2.5.1 牡蛎体中苯并[a]芘等效浓度 本研究利用各组分PAHs相对苯并[a]芘(BaP)的毒性当量因子(TEFs) (表1),采用公式(2)将PAHs浓度转化为等效苯并[a]芘浓度.各组分PAHs浓度均使用湿重数据计算,结果见表4.2009~2014年间,海南岛沿岸4个站点牡蛎体苯并[a]芘等效浓度平均值中,榆林港(1.14ng/g,湿重,下同)的等效BaP浓度明显高于全海区总平均值(0.86ng/g),而马袅港(0.60ng/g)的等效BaP浓度则明显低于总平均值,其余2个站点牡蛎体中等效BaP浓度与总平均值接近(图6). q检验结果显示(P<0.05),4个站点牡蛎体等效BaP浓度水平呈榆林港>八所港、东寨港>马袅港的特点.图7为2009~2014年海南岛沿岸牡蛎体等效BaP含量年际变化.从图6中曲线的表观特征看,海南岛全海区牡蛎体等效BaP浓度平均值在2011~2014年间略呈上升趋势.各站点中除榆林港未表现出明显的上升趋势外,其余站点与全海区牡蛎的变化趋势相近.此外,本研究牡蛎样品PAHs总量与等效BaP浓度之间相关关系不显著(R2=0.0126,P<0.05).这说明∑PAHs总量高并不意味着食用牡蛎危险系数高.因此,今后在对生物体中PAHs的食用安全危害判别时不能单从PAHs总量上判断,还需要结合等效BaP浓度等判断其危害程度.

表4 海南沿岸牡蛎体中PAHs苯并[a]芘等效浓度(ng/g湿重)Table 4 BaP equivalent concentration (BaPeq) of PAHs in oysters along the coast of Hainan Island(ng/g,wet weight)

图6 海南岛沿岸牡蛎体苯芘[a]芘等效浓度的空间变化Fig.6 Spatial distribution of BaP equivalent concentration in oysters along the coast of Hainan Island
2.5.2 牡蛎体PAHs致癌风险指数 考虑到海南沿岸牡蛎体等效BaP浓度平均值有增加的趋势以及评价的时效性,本研究仅对2014年海南沿岸牡蛎体中PAHs进行致癌风险评价,具体参照1.3.2.其中城镇和农村居民对牡蛎的消费量分别以74.71g/d和57.31g/d计[41],结果见表5.海南城市居民食用牡蛎的PAHs致癌风险指数范围为6.95×10-6~1.33×10-5,平均值为1.01×10-5;农村居民食用牡蛎PAHs致癌风险指数范围为5.33×10-6~1.02×10-5,平均值为7.76×10-6.很显然海南城市居民的致癌风险略高于农村居民.USEPA通常把风险值ILCR≤10-5为最大可接受的致癌风险,而ILCR>10-4则认为有严重的致癌风险.本研究海南城市居民和农村居民食用牡蛎的PAHs致癌风险水平(八所港除外)基本位于最大可接受的风险水平1×10-5内,处于可接受致癌风险水平.八所港牡蛎致癌风险值虽超过最大可接受致癌风险水平(10-5),但尚未达到严重的致癌风险(10-4).根据国外风险管理经验,通常将风险值为10-5作为控制水平,即最大的致癌几率为每10万人群中有一个致癌.本研究根据PAHs暴露公式和风险水平(10-5)推算牡蛎安全消费量.结果显示,对于体重为60kg的成人来说,海南岛牡蛎可食组织的日均消费(湿重)范围为56~107g.研究发现,当人体对海南岛牡蛎的日均消费为67g时,致癌风险范围为6.24×10-6~1.20×10-5,其中除八所港牡蛎(1.20×10-5)外,其余牡蛎的致癌风险均低于10-5的控制水平(表5).基于此,本研究建议对八所港牡蛎日均消费量为56g,其对应的致癌风险为1.00×10-5,处于致癌风险控制水平.因此,本研究建议居民对八所港牡蛎的日均消费量低于56g,对海南岛其它牡蛎的日均消费量不高于67g.
3 结论
3.1 2009~2014年海南岛沿岸牡蛎样品中PAHs总量范围为289~2426ng/g d.w.,平均值为856.7ng/g d.w..与国内外其他海域相比,海南岛牡蛎体中PAHs含量处于中等水平.
3.2 海南岛沿岸牡蛎体中PAHs含量存在一定的差异,其含量平均值由高到低为八所港>榆林港>马袅港>东寨港.2009~2014年八所港牡蛎PAHs含量表现出显著的上升趋势,其他站点牡蛎的趋势变化不显著.
3.3 海南岛牡蛎体中主要以2~3环的低分子量PAHs为主.来源分析主要为石油源和油类燃烧. 3.4 风险评价结果显示城市居民食用牡蛎的致癌风险指数(6.95×10-6~1.33×10-5)高于农村居民(5.33×10-6~1.02×10-5). 海南岛八所港牡蛎的PAHs致癌风险值超过最大可接受致癌风险(10-5),但尚未达到严重的致癌风险(10-4),而其他站点牡蛎均处于可接受致癌风险水平.本研究建议居民对八所港牡蛎和海南其它牡蛎的日均消费量分别不超过56g和67g.
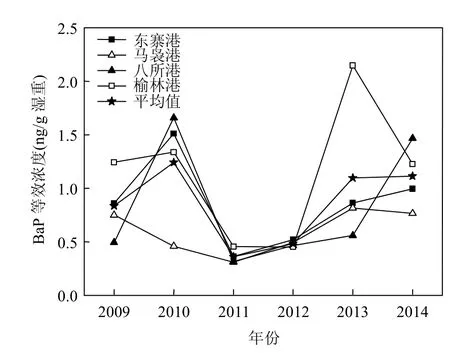
图7 海南沿岸牡蛎体苯并[a]芘等效浓度的变化趋势Fig.7 Temporal trends of BaP equivalent concentration in oysters along the coast of Hainan Island
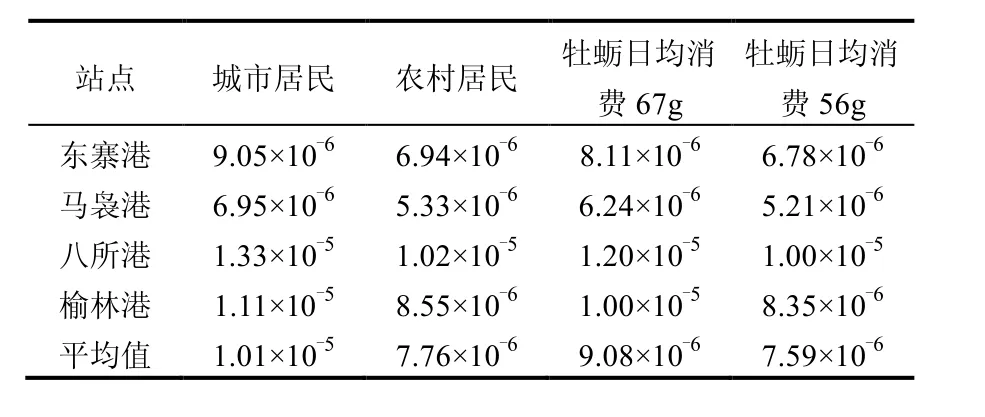
表5 海南岛沿岸牡蛎体PAHs对人体的致癌风险水平Table 5 Cancer risk levels of PAHs in oysters along the coast of Hainan Island
[1]Bixian M, Jiamo F, Gan Z, et al. Polycyclic aromatic hydrocarbons in sediments from the Pearl river and estuary, China: spatial and temporal distribution and sources [J]. Applied Geochemistry, 2001,16(11/12):1429-1445.
[2]Ssebugere P, Sillanpää M, Wang P, et al. Polychlorinated biphenyls in sediments and fish species from the Murchison Bay of Lake Victoria, Uganda [J]. Science of the Total Environment,2014,482/483:349-357.
[3]Melwani A R, Gregorio D, Jin Y, et al. Mussel watch update: Long-term trends in selected contaminants from coastal California, 1977-2010 [J]. Marine Pollution Bulletin, 2014,81: 291-302.
[4]Beg M U, Gevao B, Al-Jandal N, et al. Polycyclic aromatic hydrocarbons in three varieties of fish from Kuwait Bay [J]. Polycyclic Aromatic Compounds, 2009,29(2):75-89.
[5]Goldberg E D.The Mussel Watch-a first step in global marine monitoring [J]. Marine Pollution Bulletin, 1975,6(7):111.
[6]Sericano J, Wade T, Jackson T, et al. Trace organic contamination in the Americas: an overview of the US national status and trends and the international ‘mussel watch'programmes [J]. Marine Pollution Bulletin, 1995,31(4):214-225.
[7]Wade T L, Sericano J, Gardinali P R, et al. NOAA's ‘mussel watch'project: Current use organic compounds in bivalves [J]. Marine Pollution Bulletin, 1998,37(1):20-26.
[8]甘居利,贾晓平,林 钦,等.2003~2005年和1991~1993年广东沿海牡蛎体六六六和滴滴涕残留比较 [J]. 中国水产科学,2008,15(4):652-658.
[9]王清云,甘居利,陈海刚,等.南海北部沿岸牡蛎体内PCBs的时空分布特征及评价 [J]. 中国环境科学, 2013,33(10):1791-1798.
[10]National Research Council. The international mussel watch [M]. National Academy of Sciences, 1980.
[11]Apeti D A, Lauenstein G G, Evans D W. Recent status of total mercury and methyl mercury in the coastal waters of the northern Gulf of Mexico using oysters and sediments from NOAA's mussel watch program [J]. Marine Pollution Bulletin, 2012,64(11): 2399-2408.
[12]贾晓平,林 钦.广东沿海牡蛎石油烃污染研究V.牡蛎体中的芳香烃化合物 [J]. 海洋环境科学, 1992,(3):18-23.
[13]GB173786-2007 海洋监测规范第6部分:生物体分析 [S].
[14]孙闰霞,柯常亮,林 钦,等.超声提取/气相色谱-质谱法测定海洋生物中的多环芳烃 [J]. 分析测试学报, 2013,32(1):57-63.
[15]EPA/600/R-93/089.1993.Provisional guidance for quantitative risk assessment of polycyclic aromatic hydrocarbons [S].
[16]Nisbet I C, LaGoy P K. Toxic equivalency factors (TEFs) for polycyclic aromatic hydrocarbons (PAHs) [J]. Regulatory toxicology and pharmacology, 1992,16(3):290-300.
[17]EPA/600/Z-92/001. 1992. EPA Guidlines exposure assessment[S].
[18]陈冠秋,李耀初,黄晋沐,等.滩涂红树林种植-养殖耦合系统水产品中多环芳烃含量水平分析 [J]. 环境科学, 2012,33(6):1846-1851.
[19]Fang J K H, Wu R S S, Zheng G J, et al. The use of muscle burden in rabbitfish Siganus oramin for monitoring polycyclic aromatic hydrocarbons and polychlorinated biphenyls in Victoria Harbour, Hong Kong and potential human health risk [J]. Science of the Total Environment, 2009,407(14):4327-4332.
[20]Devier M H, Augagneur S, Budzinski H, et al. One-year monitoring survey of organic compounds (PAHs, PCBs, TBT),heavy metals and biomarkers in blue mussels from the Arcachon Bay, France [J]. Journal of Environmental Monitoring, 2005,7(3): 224-240.
[21]Oros D R, Ross J R M, Spies R B, et al. Polycyclic aromatic hydrocarbon (PAH) contamination in San Francisco Bay: A 10-year retrospective of monitoring in an urbanized estuary [J]. Environmental Research, 2007,105(1):101-118.
[22]Isobe T, Takada H, Kanai M, et al. Distribution of polycyclic aromatic hydrocarbons (PAHs) and phenolic endocrine disrupting chemicals in south and southeast Asian mussels [J]. Environmental Monitoring and Assessment, 2007,135(1-3):423-440.
[23]Arias A H, Spetter C V, Freije R H, et al. Polycyclic aromatic hydrocarbons in water, mussels (Brachidontes sp., Tagelus sp.)and fish (Odontesthes sp.) from Bahia Blanca Estuary, Argentina[J]. Estuarine Coastal and Shelf Science, 2009,85(1):67-81.
[24]Francioni E, Wagener A D, Scofield A L, et al. Evaluation of the mussel Perna perna as a biomonitor of polycyclic aromatic hydrocarbon (PAH) exposure and effects [J]. Marine Pollution Bulletin, 2007,54(3):329-338.
[25]苏庆威.海南西部海域船舶溢油应急管理研究 [D]. 大连:大连海事大学, 2013.
[26]Vinas L, Franco A, Blanco X, et al. Temporal and spatial changes of PAH concentrations in Mytilus galloprovincialis from Ria de Vigo (NW Spain) [J]. Environmental Science and Pollution Research, 2012,19(2):529-539.
[27]Leon V M, Martinez G C, Garcia I, et al. Spatial distribution and temporal trends of polycyclic aromatic hydrocarbons in Mytilus galloprovincialis from the Iberian Mediterranean coast [J]. Environmental Monitoring and Assessment, 2013,185(2):1055-1070.
[28]符国瑄,刘 恒.海南统计年鉴-2013 [M]. 北京:中国统计出版社, 2013:14-14.
[29]Wu W J, Qin N, He W, et al. Levels, Distribution, and health risks of polycyclic aromatic hydrocarbons in four freshwater edible fish species from the Beijing market [J]. Scientific World Journal,2012,2012:1-12.
[30]Perugini M, Visciano P, Giammarino A, et al. Polycyclic aromatic hydrocarbons in marine organisms from the Adriatic Sea, Italy [J]. Chemosphere, 2007,66(10):1904-1910.
[31]Nakata H, Sakai Y, Miyawaki T, et al. Bioaccumulation and toxic potencies of polychlorinated biphenyls and polycyclic aromatic hydrocarbons in tidal flat and coastal ecosystems of the Ariake Sea, Japan [J]. Environmental science & technology, 2003,37(16): 3513-3521.
[32]Mirza R, Mohammadi M, Sohrab A D, et al. Polycyclic Aromatic Hydrocarbons in Seawater, Sediment, and Rock Oyster Saccostrea cucullata from the Northern Part of the Persian Gulf(Bushehr Province) [J]. Water Air and Soil Pollution, 2012,223(1):189-198.
[33]Soclo H H, Budzinski H, Garrigues P, et al. Biota accumulation of polycyclic aromatic hydrocarbons in benin coastal waters [J]. Polycyclic Aromatic Compounds, 2008,28(2):112-127.
[34]Wild E, Dent J, Thomas G O, et al. Real-time visualization and quantification of PAH photodegradation on and within plant leaves [J]. Environmental science & technology, 2005,39(1):268-273.
[35]Cvrčková O, Ciganek M. Photostability of polycyclic aromatic hydrocarbons (PAHs) and nitrated polycyclic aromatic hydrocarbons (NPAHs) in dichloromethane and isooctane solutions [J]. Polycyclic Aromatic Compounds, 2005,25(2):141-156.
[36]Li J, Liu G, Yin L, et al. Distribution characteristics of polycyclic aromatic hydrocarbons in sediments and biota from the Zha Long Wetland, China [J]. Environmental Monitoring and Assessment,2013,185(4):3163-3171.
[37]Ruiz Y, Suarez P, Alonso A, et al. Environmental quality of mussel farms in the Vigo estuary: Pollution by PAHs, origin and effects on reproduction [J]. Environmental Pollution, 2011,159(1): 250-265.
[38]Shahbazi A, Zakaria M P, Yap C K, et al. Spatial distribution and sources of polycyclic aromatic hydrocarbons (PAHs) in green mussels (Perna viridis) from coastal areas of Peninsular Malaysia: implications for source identification of perylene [J]. International Journal of Environmental Analytical Chemistry, 2010,90(1): 14-30.
[39]Yunker M B, Macdonald R W, Vingarzan R, et al. PAHs in the Fraser River basin: a critical appraisal of PAH ratios as indicators of PAH source and composition [J]. Organic Geochemistry, 2002,33(4):489-515.
[40]Oros D R, Ross J R. Polycyclic aromatic hydrocarbons in bivalves from the San Francisco estuary: spatial distributions,temporal trends, and sources (1993-2001) [J]. Marine Environmental Research, 2005,60(4):466-488.
[41]海南统计局.海南统计年鉴http://www.hi.stats.gov.cn/ tjsj/tjsu/ndsj/.
致谢:本研究得到南海水产研究所马胜伟老师、陈海刚老师等渔业环境研究室相关人员以及暨南大学姜仕军老师的帮助,特致谢忱.
Spatial-temporal distribution and health risk assessment of polycyclic aromatic hydrocarbons in oysters along the coast of Hainan Island.
YU Zi-ling1,2, LIN Qin1*, SUN Run-xia3, GU Yang-guang1, KE Chang-liang1, SHI Feng-qiong1,2(1.Key Laboratory of Fishery Ecology and Environment, Guangdong Province of China; Key Laboratory of South China Sea Fishery Resources Exploitation and Utilization, Ministry of Agriculture; South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences, Guangzhou 510300, China;2.College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;3.Guangzhou Institute of Geochmistry, Chinese Academy of Science, Guangzhou 510640, China). China Environmental Science, 2015,35(5):1570~1578
Levels, spatial and temporal trends of 16 polycyclic aromatic hydrocarbons (PAHs) in oyster Crassostrea rivularis along the Hainan Island coast were investigated from 2009 to 2014. Results showed that the total concentrations of PAHs in oysters ranged from 289 to 2426ng/g with an average of 856.7ng/g on a dry weight basis. The PAHs levels from Hainan Island coast fell within moderate levels compared with those from other coastal areas in the world. The average concentrations of PAHs exhibited definite spatial differences and decreased in the order : Basuo Harbor> Yulin Harbor> Maniao Harbor>Dongzhai Harbor. Based on Mann-Kendall test, only Basuo Harbor showed a significant increasing trend (P<0.05). The composition of PAHs was characterized by 2~3rings of PAHs (ranging from 62.3%~92.5%). PAHs may originate mainly from petroleum and combustion of oil. Risk assessment suggested that the cancer risks in oysters from Basuo Habor exceeded the maximum acceptable risk (10-5), but did not reach the serious cancer risk level (10-4), while the cancer risks in other sites were acceptable. Further assessment suggested that daily intake of edible oyster tissue from Basuo Habor and other areas of Hainan Island should not exceed 56g and 67g,respectively.
the coast of Hainan Island;Crassostrea rivularis;polycyclic aromatic hydrocarbons (PAHs);risk assessment
X171.1
A
1000-6923(2015)05-1570-09
于紫玲(1989-),女,湖南邵阳人,上海海洋大学硕士研究生,主要从事渔业生态环境保护研究.
2014-09-21
国家科技支撑计划项目(2009BADB7B02);中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院南海水产研究所)资助项目(2012TS15);农业部水产品加工重点实验室开放基金(nybjg201204)
* 责任作者, 研究员, linqinscs@21cn.com

