探针熔解曲线法快速检测结核分枝杆菌注射类二线药耐药突变
张 婷,付 军,王国治,陈保文,杨 蕾,卢锦标,许 晔,李庆阁
2.中国食品药品检定研究院结核病疫苗室,北京100050
我国结核分枝杆菌的耐药情况严重,耐药率高,给结核病的预防和治疗带来严峻挑战。耐多药结核病(Multidrug-resistant tuberculosis,MDR-TB)是指至少对异烟肼和利福平具有耐药性,广泛耐药结核 病 (Extensively drug-resistant tuberculosis,XDR-TB)则是指在耐多药结核病的基础上,对二线药物中的氟喹诺酮类药物以及3种二线抗结核注射剂(卷曲霉素、卡那霉素、阿米卡星)中的至少一种耐药。MDR-TB和XDR-TB的不断增多,使得快速、可靠地对二线抗结核药物的耐药性进行检测的需求更加迫切。
常用的注射类二线抗结核药物主要有氨基糖苷类抗生素(卡那霉素、阿米卡星)和多肽类抗生素(卷曲霉素)。通过药物敏感性试验进行耐药检测是目前普遍采用的方法,包括比例法和绝对浓度法[1]。但由于结核分枝杆菌生长缓慢而使药敏试验周期过长,通常需要4-6周,延误患者治疗。基于分子生物学的耐药检测可以大大减少得到药敏结果的时间,如线性探针杂交法[2-3]、焦磷酸测序法[4]、DNA 测序法等。然而,这些基于PCR的方法均涉及PCR后处理,易引起PCR产物污染造成假阳性结果,且操作复杂,需要具备专业背景的技术人员。
基于实时PCR技术的探针熔解曲线法将扩增和检测合二为一,无PCR后处理,具有快速、特异、灵敏等优点,在突变检测领域得到广泛应用,在结核分枝杆菌耐药性检测上的应用也引起人们极大兴趣[5-11]。注射类二线药的耐药主要由点突变引起,适合采用探针熔解曲线法进行检测。卡那霉素、阿米卡星和卷曲霉素的耐药机制存在交叉耐药现象,主要是由rrs基因的点突变导致,3种药的耐药株中发生该基因突变的比例分别为25%~40%、95%和70%~80%,包括rrs1401A→G、rrs1402C→T和rrs1484G→T等位点。另外,rrs1473G→A/T的突变导致部分卷曲霉素的耐药。60%~80%的卡那霉素耐药株在eis基因启动子区发生突变,主要有-10G→A、-14C→T和-37G→T等突变类型[12-15]。
本研究利用厦门致善生物科技股份有限公司生产的结核分枝杆菌注射类二线药耐药突变检测试剂盒(探针熔解曲线法)MeltPro TB/SL对241份结核分枝杆菌临床分离株进行注射类二线药耐药相关突变检测,并对该试剂盒进行检测性能的考察。
1 材料与方法
1.1 结核分枝杆菌注射类二线药耐药突变检测试剂盒MeltPro TB/SL试剂盒由厦门致善生物科技股份有限公司提供。试剂盒采用探针熔解曲线法检测,使用双管双色体系检测rrs基因(1401、1402、1473和1484位点)、eis基因启动子区(-10、-14和-37位点)的突变。包括提取体系(TB DNA提取液)、扩增体系(PCR反应混合液A、B和酶混合液)以及对照体系(阳性对照和阴性对照)。
探针熔解曲线法的检测原理基于野生型序列具有特定的熔点,基因突变会导致探针结合能力下降,导致熔点下降。根据熔点的变化即可判断突变的有无。对于一份未知的待检样本,需要结合反应体系A和B的FAM和HEX通道共4个检测区域的结果,进行整体的分析。结核分枝杆菌在4个检测区域均应存在野生型或突变型熔解峰,若有一个或一个以上检测区域无熔解峰,则提示待检样本可能不是结核分枝杆菌或其浓度低于检测限。
反应程序:50。C2min;95。C10min;95。C10 s,71。C15s(每个循环下降1。C),78。C15s,循环10次;95。C10s,61。C15s(检测荧光),78。C15 s,循环45次,荧光通道选用FAM和HEX。熔解分析程序:95。C2min;40。C2min;40。C~85。C,升温过程中每1。C采集FAM和HEX通道荧光信号。
注射类二线药耐药突变检测分两管在双色实时PCR仪进行。一管检测rrs基因突变,另一管检测eis基因启动子区突变。PCR体系按照试剂盒说明书配制,25μL检测体系含20μL PCR反应混合液和5μL模板DNA。
1.2 菌株来源及处理
1.2.1 临床样本 来自中国食品药品检定研究院结核病疫苗室的结核分枝杆菌培养样本96份,均有卡那霉素、阿米卡星和卷曲霉素的药敏信息;来自山东胸科医院的结核分枝杆菌培养样本145份,无药敏信息。
文献[11]提出了基于余弦函数(记为COSGWO)和二次函数(记为2GWO)的非线性动态变化收敛因子更新方法,更新公式为式(23)、式(24),仿真结果表明优于基本GWO,且基于余弦函数和二次函数的收敛因子非线性动态变化效果接近。
按照试剂盒说明书,采用热裂解法进行基因组DNA的提取:取样本的灭活菌液,与TB DNA提取液按照体积比1∶1混匀;99。C加热20min;13 000 r/min离心10min,取上清作为模板。
1.2.2 非结核分枝杆菌 用于分析特异性评价的23株非结核分枝杆菌标准株灭活菌液由中国食品药品检定研究院结核病疫苗室提供。23株菌浓度为1×106个菌/mL,包括:鸟分枝杆菌、胞内分枝杆菌、蟾蜍分枝杆菌、溃疡分枝杆菌、土地分枝杆菌、胃分枝杆菌、不产色分枝杆菌、施氏分枝杆菌、次要分枝杆菌、玛尔摩分枝杆菌、堪萨斯分枝杆菌、海分枝杆菌、猿分枝杆菌、瘰疠分枝杆菌、戈登分枝杆菌、苏加分枝杆菌、龟分枝杆菌、脓肿分枝杆菌、偶然分枝杆菌、耻垢分枝杆菌、草分枝杆菌、浅黄分枝杆菌、亚洲分枝杆菌。基因组DNA提取方法与临床样本的提取方法相同。
1.2.3 含不同耐药突变的质粒 用于突变检出能力验证的12个质粒由生工生物工程(上海)股份有限公司合成,其中包括2个野生型质粒(分别对应rrs基因和eis基因启动子区)以及10个突变型质粒(1个野生型多态性eis-12C>T,9个耐药突变rrs1401A>G、rrs1402C>T、rrs1473G>A、rrs1473G>T、rrs1484G>T、eis-37G>T、eis-14C>T、eis-13A>G、eis-10G>A)。使用 E.Z.N.A.TMPlasmid Miniprep Kit(Omega Bio-tek,美国)进行质粒的提取。使用分光光度计进行浓度测定,根据质粒长度进行拷贝数的计算。
1.2.4 H37Rv标准株 用于最低检测限考察的H37Rv标准株灭活菌液由深圳市慢性病防治中心提供,使用 TIANamp Bacteria DNA Kit(TIANGEN BIOTECH,北京)进行基因组DNA提取和纯化。之后使用分光光度计进行浓度测定。
1.3 实验仪器 CFX 96实时定量PCR仪(Bio-Rad,美国);GenePro基因扩增仪(杭州博日科技有限公司,中国);ND-1000紫外-可见分光光度计(美国Thermo Fisher Scientific公司);5451D台式离心机(Eppendorf,德国);CHB-100恒温金属浴(杭州博日科技有限公司,中国)。
1.4 突变检出能力考察 使用TB DNA提取液将定量好的质粒进行稀释,得到浓度为1×104拷贝/μL的模板。同时以灭菌超纯水作为空白对照。
1.5 最低检测限考察 使用TB DNA提取液将定量好的H37Rv基因组DNA进行稀释,依次得到浓度为1×105拷贝/μL、1×104拷贝/μL、1×103拷贝/μL、1×102拷贝/μL、1×101拷贝/μL、1×100拷贝/μL的模板。每管加入5μL作为模板,同时以灭菌超纯水作为空白对照。
1.7 分析特异性考察 以中国食品药品检定研究院结核病疫苗室提供的23株非结核分枝杆菌提取的DNA为模板,考察该试剂盒的分析特异性。同时以灭菌超纯水作为空白对照。
1.8 样本检测 使用241份临床样本进行试剂盒的临床评价。所有检测为突变的样本、疑似不均一耐药的样本以及与药敏结果不符的样本均进行测序验证,测序由华大基因科技服务有限公司完成。
2 结 果
2.1 使用质粒进行突变检出能力的考察 为考察该试剂盒能否将注射类二线药耐药相关突变与野生型进行区分,使用具有不同突变类型的质粒进行考察。结果如表1。
结果显示,各耐药突变与野生型的熔点差异均在3.0。C以上,突变型均能和野生型相区分。部分情况下无法判断具体的突变类型(rrs1473G>A和rrs1473G>T;eis-14C>T、eis-13A>G 和eis-10G>A),但这两种情况下不同突变的发生都导致试验菌株对CAP或KAN耐药,因此不影响对试验菌株耐药性的判断。
2.2 最低检测限考察结果 最低检测限考察的结果显示,不同浓度的模板对应的4个检测通道的Tm值均一而稳定。当野生型模板浓度为5拷贝/反应时,4个检测通道均有相应的熔解峰。结果表明,本体系的野生型最低检出量可以达到5拷贝/反应。
2.3 不同突变比例模板的考察结果 如图1结果显示,随着突变比例的增加,熔解曲线逐渐由野生型峰向突变型峰偏移。在4个检测通道中,突变比例为30%及以上时,熔解曲线的峰形较野生型有明显的差异,可以与野生型峰进行区分,从而判断为不均一耐药样本。
2.4 分析特异性的考察结果 使用23种非结核分枝杆菌进行该试剂盒的分析特异性考察,同时以H37Rv为对照。结果显示,在反应体系A的FAM和HEX通道,除H37Rv有熔解信号之外,部分非结核分枝杆菌有信号;在反应体系B的FAM通道和HEX通道,除H37Rv有野生型熔解峰之外,23株非结核分枝杆菌和空白对照的结果一致,即反应体系B对非结核分枝杆菌的无交叉反应。综合两个反应结果,没有任何一株NTM同时在两个反应中均有检测信号,因此23种常见非结核分枝杆菌对检测结果无交叉反应,说明该试剂对于上述NTM具有100%的分析特异性。
2.5 临床样本检测结果
2.5.1 中国食品药品检定研究院结核病疫苗室的培养样本96份。
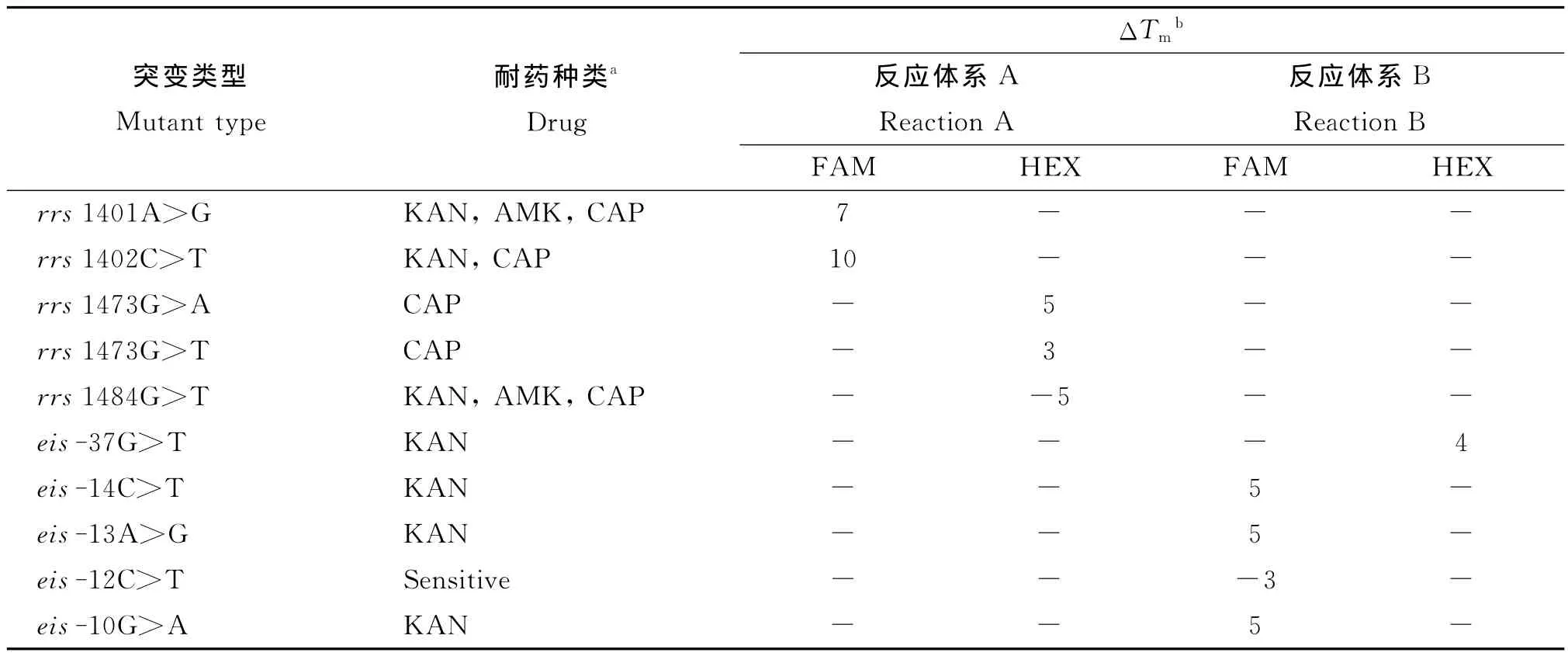
表1 不同突变质粒与野生型的熔点差异Tab.1 ΔTmbetween wild-type and mutant plasmids
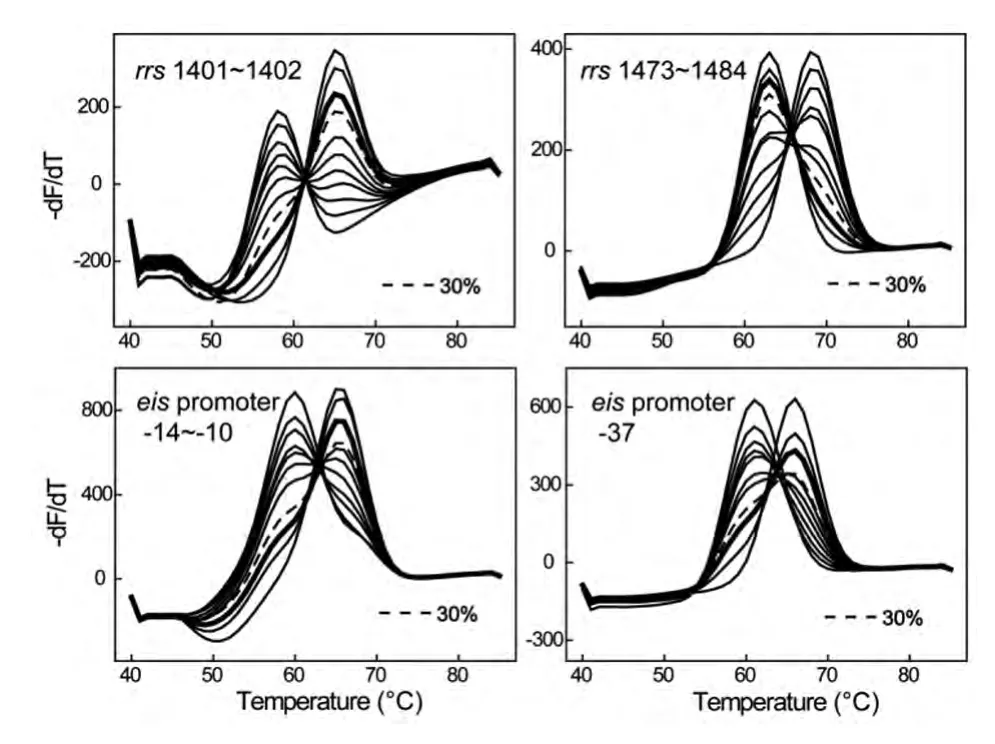
图1 不同突变比例的模板考察的结果Fig.1 Detection of the mixed mutant and wild-type in different ratios
通过将试剂盒的检测结果与药敏结果进行对比(表2),可以发现,对于卡那霉素耐药突变检测,该试剂盒的灵敏度为90.0%,特异性为98.8%,总符合率为97.9%,kappa值为0.89;对于阿米卡星耐药突变检测,该试剂盒的灵敏度为80.0%,特异性为98.8%,总符合率为96.9%,kappa值为0.83;对于卷曲霉素耐药突变检测,该试剂盒的灵敏度为85.7%,特异性为96.6%,总符合率为95.8%,kappa值为0.73。
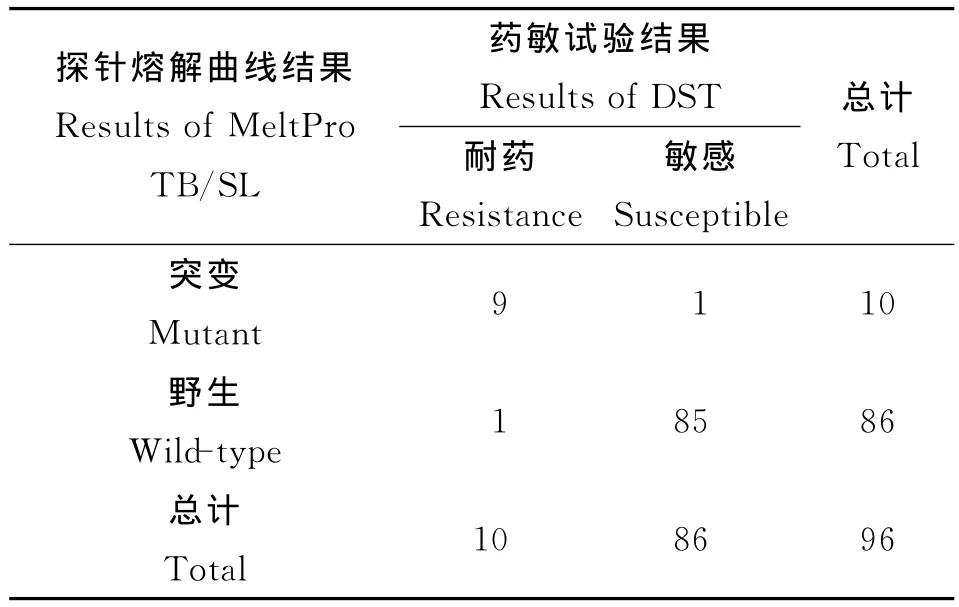
表2 探针熔解曲线结果与药敏结果对比Tab.2 Results comparison between MeltPro TB/SL and phenotypic drug-susceptibility testing(DST)
从以上96份临床样本中共检出10例突变样本,测序结果表明,9例样本发生rrs1 401A→G突变,1例样本发生eis基因启动子区-10G→A突变。比例法药敏试验结果对卡那霉素耐药而MeltPro TB/SL为野生的1例样本,其测序结果也为野生型,与探针熔解曲线结果一致;比例法药敏试验结果对卡那霉素敏感而MeltPro TB/SL为突变的1例样本,其测序结果为rrs1401A→G,与探针熔解曲线结果一致。比例法药敏试验结果对阿米卡星耐药而MeltPro TB/SL为野生的2例样本,其测序结果也为野生型,与探针熔解曲线结果一致;比例法药敏试验结果对阿米卡星敏感而MeltPro TB/SL为突变的1例样本,其测序结果为rrs1 401A→G,与探针熔解曲线结果一致。比例法药敏试验结果对卷曲霉素耐药而MeltPro TB/SL为野生的1例样本,其测序结果也为野生型,与探针熔解曲线结果一致;比例法药敏试验结果对卷曲霉素敏感而MeltPro TB/SL为突变的3例样本,其测序结果为rrs1401A→G,与探针熔解曲线结果一致。总而言之,测序结果与探针熔解曲线法的耐药检测结果完全一致。
2.5.2 山东胸科医院的145份培养样本 使用注射类二线药耐药突变检测试剂盒对145份样本进行检测,并对突变样本进行测序验证。熔解曲线分析为突变的样本共9份,均为反应体系A的FAM通道检测突变,即rrs1 400区域的突变。经测序证实,所有9株突变类型均为rrs1 401A→G突变。另外检出1份不均一耐药样本,在反应体系A的FAM通道检测结果为双峰。经测序证实,该样本同时存在野生型菌株和突变类型为rrs1 401A→G的突变型菌株。
3 讨 论
简便高效、灵敏特异的耐药诊断技术是结核病防控的有利工具,对于耐药结核病的早期检测、合理治疗以及传播控制都有重要的意义。目前针对一线抗结核药物的耐药检测试剂有较多开发和评价[6-11,16-17],而针 对 注 射 类 二 线 药 的 耐 药 检 测 试 剂相对较少,专门针对注射类二线药的耐药检测试剂则近乎空白。商用试剂GenoType MTBDRsl(Hain Lifescience,德国)采用固相线性探针杂交原理,可检测包括氟喹诺酮类、乙胺丁醇以及氨基糖苷类/多肽类的耐药性[2-3]。其中针对注射类二线药的耐药性突变,该试剂仅针对rrs基因设计了2条突变型探针,而已知与注射类二线药耐药相关的常见突变在rrs基因上有1 401、1 402、1 473和14 844个位点,在eis基因启动子区有-10、-14和-37 3个位点,显然,该试剂盒检测的突变数目严重不足。另外,就方法学而言,所采用的固相杂交法需要多步PCR后操作,不仅操作复杂繁琐,时间长,且极易造成PCR产物的污染而出现假阳性结果。
本文考察的结核分枝杆菌注射类二线药耐药突变检测试剂盒(探针熔解曲线法)MeltPro TB/SL是目前唯一专门检测注射类二线药物耐药突变的试剂,覆盖突变位点囊括了rrs基因的4个位点(1401、1402、1473和1484位点)和eis基因启动子区(-10、-14和-37位点)的3个位点上的所有突变类型,设计检测耐药突变类型共9个,大大超过了GenoType MTBDRsl检测数目。在方法学上,MeltPro TB/SL是基于荧光PCR的探针熔解曲线法,属于闭管检测模式,检测过程在实时PCR仪器上运行,无PCR后处理步骤,不仅大大节约了时间(46个样品从核酸提取到报告结果仅需约3h),也减少了PCR产物污染的机会。
从分析性能评价结果可以看出,MeltPro TB/SL可将10种突变类型与野生型明确区分,最低检出量低至5个拷贝的野生型基因组DNA,并且其熔解峰Tm值在较大范围内不受模板浓度影响。使用含有常见耐药突变型的质粒与野生型质粒按不同的比例混合后,当突变比例为30%及以上时,熔解曲线的峰形相较于野生型有明显的差异,可以与野生型区分,这一结果为检测耐药患者中的非均一耐药提供了依据。分析特异性研究结果表明,在23株NTM中,部分NTM在rrs基因有检测信号,这可能与rrs基因在这些NTM中保守度高有关,但所有菌株在eis基因启动子区内均无信号。对于任何一个待测样本而言,其检测结果需两个反应同时检出信号,当其中一个反应无检测信号时,就可以判断该样本非 MTB感染,上述结果证明了 MeltPro TB/SL高特异性。
从临床性能评价结果可以看出,与传统的比例法药敏试验相比,MeltPro TB/SL有较高的临床灵敏度(卡那霉素为90.0%,阿米卡星80.0%,卷曲霉素85.7%),尤其是具有极高的临床特异性(卡那霉素为98.8%,阿米卡星98.8%,卷曲霉素96.6%)。对于那些药敏结果与突变检测结果不一致的样本,测序结果显示其突变信息与MeltPro TB/SL结果一致,进一步证明了该试剂检测突变的可靠性。这些药敏与突变信息不一致的样本,或者存在其它的耐药突变机制,或者其药敏试验的准确性不够,需更多的样本验证。
总之,MeltPro TB/SL覆盖位点广,分析性能优良,对临床样本的检测结果与药敏结果以及测序结果具有较高的一致性,并具有操作简便和检测快速的优点,作为一种新型结核分枝杆菌注射类二线药耐药突变检测的试剂,具有潜在的应用价值,有望为耐药结核病的防控和治疗提供快速高效的筛查手段。
[1]Chinese antituberculosis association professional committee.Rules for the inspection of the laboratory diagnosis of tuberculosis[M].Beijing:China Education Culture Press,2006,38-64.(in Chinese)中国防痨协会基础专业委员会.结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006:38-64.
[2]Ignatyeva O,Kontsevaya I,Kovalyov A,et al.Detection of resistance to second-line antituberculosis drugs by use of the genotype MTBDRslassay:a multicenter evaluation and feasibility study[J].J Clin Microbiol,2012,50(5):1593-1597.DOI:10.1128/JCM.00039-12
[3]Lacoma A,Garcia-Sierra N,Prat C,et al.GenoType MTBDRslfor molecular detection of second-line-drug and ethambutol resistance inMycobacteriumtuberculosisstrains and clinical samples[J].J Clin Microbiol,2012,50(1):30-36.DOI:10.1128/JCM.05274-11
[4]Ajbani K,Grace Lin SY,Rodrigues C,et al.Evaluation of pyrosequencing for detecting extensively drug-resistant tuberculosis(XDR-TB)in clinical isolates from four high-burden countries[J].Antimicrob Agents Chemother,2015,59(1):414-420.DOI:10.1128/AAC.03614-14
[5]Li LG,Li QG,Wang Q,et al.Evaluation of clinical application of PCR-probe melting analysis assay for detection of fluoroquinolone-resistant mutations inMycobacteriumtuberculosisclinical isolates[J].Chin J Clinicians:Electron Ed,2011,05(16):4641-4645.(in Chinese)李国利,李庆阁,王倩,等.PCR-探针熔解分析法检测结核分枝杆菌氟喹诺酮耐药基因突变的临床应用评价[J].中华临床医师杂志:电子版,2011,05(16):4641-4645.
[6]Hu SY,Niu JJ,Quan Sm,et al.Application and evaluation of a probe melting analysis-based assay for detection of Isoniazid-resistant mutations inMycobacteriumtuberculosis[J].Chin J Lab Med,2011,34(10):935-939.(in Chinese)胡思玉,牛建军,权胜卯,等.探针熔解分析法检测结核分枝杆菌异烟肼耐药突变的应用和评价[J].中华检验医学杂志,2011,34(10):935-939.
[7]Zheng RR,Chen XY,Fu JJ,et al.Probe melting analysis for rapid detection of ethambutol-resistant mutations inMycobacteriumtuberculosisclinical isolates[J].Chin J Lab Med,2011,34(2):130-134.(in Chinese)郑蓉蓉,陈晓云,付军,等.探针熔解分析法快速检测结核分枝杆菌乙胺丁醇耐药突变[J].中华检验医学杂志,2011,34(2):130-134.
[8]Zhang X,Zhang T,Niu J,et al.Probe melting analysis for rapid detection of streptomycin-resistant mutations inMycobacterium tuberculosisclinical isolates[J].Chin J Zoonoses,2011,27(1):53-57.(in Chinese)张向东,张婷,牛建军,等.探针熔解分析法快速检测结核分枝杆菌链霉素耐药突变[J].中国人兽共患病学报,2011,27(1):53-57.
[9]Ma YY,Li H,Zhao DY,et al.Detecting the mutation of ropB gene inMycobacteriumtuberculosisisolates from clinical sample by melting analysis based real-time PCR[J].Port Health Ctrl,2011,16(5):21-24.(in Chinese)马艳艳,李辉,赵东阳,等.荧光PCR熔解曲线法检测结核分枝杆菌耐利福平突变研究[J].口岸卫生控制,2011,16(5):21-24.
[10]Niu JJ,Zhang Y,Wen HY,et al.Analyzing the mutations of rpoB gene inMycobacteriumtuberculosisclinical isolates by probe melting analysis assay[J].Chin J Prevent Med,2011,45(3):225-229.(in Chinese)牛建军,张轶,温慧欣,等.应用探针熔解分析法检测结核分枝杆菌rpoB基因突变[J].中华预防医学杂志,2011,45(3):225-229.
[11]Hu S,Li G,Li H,et al.Rapid detection of isoniazid resistance inMycobacteriumtuberculosisisolates by use of real-time-PCR-based melting curve analysis[J].J Clin Microbiol,2014,52(5):1644-1652.DOI:10.1128/JCM.03395-13
[12]Jugheli L,Bzekalava N,de Rijk P,et al.High level of crossresistance between kanamycin,amikacin,and capreomycin amongMycobacteriumtuberculosisisolates from Georgia and a close relation with mutations in the rrs gene[J].Antimicrob A-gents Chemother,2009,53(12):5064-5068.DOI:10.1128/AAC.00851-09
[13]Maus CE,Plikaytis BB,Shinnick TM.Molecular analysis of cross-resistance to capreomycin,kanamycin,amikacin,and viomycin inMycobacteriumtuberculosis[J].Antimicrob Agents Chemother,2005,49(8):3192-3197.DOI:10.1128/AAC.49.8.3192-3197.2005
[14]Zhang Y,Young D.Molecular genetics of drug resistance inMycobacteriumtuberculosis[J].J Antimicrob Chemother,1994,34(3):313-319.DOI:10.1093/jac/34.3.313
[15]Zaunbrecher MA,Sikes RD,Metchock B Jr,et al.Overexpression of the chromosomally encoded aminoglycoside acetyltransferase eis confers kanamycin resistance inMycobacterium tuberculosis[J].Proc Natl Acad Sci U S A,2009,106(47):20004-20009.DOI:10.1073/pnas.0907925106
[16]Blakemore R,Story E,Helb D,et al.Evaluation of the analytical performance of the Xpert MTB/RIF assay[J].J Clin Microbiol,2010,48(7):2495-2501.DOI:10.1128/JCM.00128-10
[17]Hemvani N,Patidar V,Chitnis DS.In-house,simple &economical phage technique for rapid detection of rifampicin,isoniazid,ethambutol,streptomycin &ciprofloxacin drug resistance usingMycobacteriumtuberculosisisolates[J].Indian J Med Res,2012,135(5):783-787.
[18]Tortoli E,Marcelli F.Use of the INNO LiPA Rif.TB for detection ofMycobacteriumtuberculosisDNA directly in clinical specimens and for simultaneous determination of rifampin susceptibility[J].Eur J Clin Microbiol Infect Dis,2007,26(1):51-55.DOI:10.1007/s10096-006-0240-x

