健脾补土方对脑缺血/再灌注损伤大鼠NF-κB和IκBα蛋白表达水平的影响
付小金,刘旺华*,李 花,金朝晖,周小青
(1.湖南中医药大学中医诊断学研究所,湖南 长沙410208;2.湖南中医药大学中医学院,湖南 长沙410208;3.湖南中医药大学第一附属医院,湖南 长沙410007)
脑缺血/再灌注损伤是一个快速级联反应过程,是由能量代谢障碍、兴奋性氨基酸中毒、氧自由基生成增多、细胞内钙超载、炎症反应和细胞凋亡等多种因素参与的病理过程[1],而影响它的主要病理机制是炎症反应和细胞凋亡。 核因子-κB(nuclear factor-κappa B,NF-κB) 信号通路可调控多种炎症因子及凋亡基因的转录,参与炎症级联反应及细胞凋亡等病理过程[2]。 目前,已有大量实验研究表明,通过抑制NF-κB 信号通路, 下调相关因子表达,可减轻脑缺血/再灌注损伤。实验前期研究表明健脾补土方对脑缺血/再灌注损伤神经功能具有保护作用,其机制可能与抑制MMP-2[3]和MMP-9 表达,减少层黏连蛋白降解[4],抑制无菌性炎症的产生,从而维护基底膜的完整性保护血脑屏障有关,但其具体机制还不清楚。 本实验通过研究健脾补土方对大鼠脑缺血后炎症因子的上游因素NF-κB、NF-κB 抑制蛋白α(inhibitor of NF-κB α,IκBα)表达的影响,探讨健脾补土法对脑缺血/再灌注损伤大鼠神经保护作用的机制。
1 材料和方法
1.1 动物
健康清洁级SD 雄性大鼠120 只, 体质量(240±20)g, 由湖南斯莱克景达实验动物有限司提供,动物许可证号:SCXK(湘)2013-0004,动物合格证号:NO43004700006140。
1.2 药物与试剂
健脾补土方以经典四君子汤为基础配伍,组方:人参15 g,白术12 g,茯苓10 g,黄芪15 g,山药12 g,薏苡仁12 g,炙甘草6 g。 药物购自湖南中医药大学第一附属医院。 药液制备: 清水浸泡30 min 后,第1 次加6 倍水煎煮40~60 min,第2次加4 倍水煎煮30 min, 将2 次滤药液混合并水浴浓缩至生药浓度为1 g/mL,灭菌分装,4 ℃冷藏备用。依达拉奉注射液(吉林省博大制药有限公司,规格:10 mL/15 mg)。 10%水合氯醛、 多聚甲醛系天津市科密欧化学试剂有限公司产品,一抗兔抗大鼠NF-κB/p65(10745-1-AP)、兔抗大鼠IκBα(SC-324882)、兔抗大鼠β-actin (600008-1)系Proteintech 公司产品, 其他试剂由上海国药生物公司生产。
1.3 主要仪器
164-5050 电泳仪(美国Bio-rad 公司),DYCZ-24EN 电泳槽(北京六一厂),DYCZ-40A 转膜仪(北京六一厂),BX51 光学显微镜 (日本OLYMPUS 公司),KD-2258 轮转切片机(科迪仪器设备公司)。
1.4 动物分组及给药
将120 只大鼠随机分为6 组,每组20 只,分别为假手术组(蒸馏水,灌胃)、模型组(蒸馏水,灌胃)、依达拉奉组(3.2 mg/kg,腹腔注射)、健脾补土方小剂量组(下称小剂量组,3.69 g/kg,灌胃)、健脾补土方中剂量组(下称中剂量组,7.38 g/kg,灌胃)、健脾补土方大剂量组(下称大剂量组,14.76 g/kg,灌胃),假手术组、模型组给予等体积蒸馏水,剂量根据人临床剂量按动物体表面积换算。 模型成功24 h 后开始给药,每日1 次,每天相同时间连续给药7 d。
1.5 动物模型制备及评价
采用改良Longa 等[5]的线栓法建立大脑中动脉闭塞模型,于缺血2 h 后进行再灌注。 假手术组除不插线外,其余步骤同模型组。 参照经典的Longa 5级4 分法[4],于大鼠完全清醒后,采用双盲法对其神经功能缺损评分。 0 分:无神经功能缺损症状;1 分:不能完全伸展右前肢, 提尾悬吊时右前肢屈曲;2分:爬行时向右转圈,追尾;3 分:爬行时向右倾倒;4分:不能自主行走,意识障碍。 评分为1~3 分者评定为成功模型,可纳入研究对象。 不成功者剔除,补充动物,保证每组动物20 只。
1.6 标本采集及处理
灌注后第7 天,每组随机取大鼠10 只。 用10%水合氯醛腹腔注射麻醉, 固定后打开胸腔暴露心脏,经左心室快速灌注生理盐水200 mL,至流出液变清,再缓慢灌注4%多聚甲醛300 mL,灌注固定30 min 至肝脏变硬白后断头取脑, 置于4%多聚甲醛固定,-4 ℃保存备用。 每组另外10 只大鼠麻醉后迅速断头取脑, 在冰上小心剥离软脑膜,取缺血区大脑皮质组织, 用冰PBS 洗涤后放入冻存管,-80 ℃保存备用。
1.7 指标检测
1.7.1 神经功能评分 参照Longa 5 级4 分法[4],各组动物在手术完全清醒后和灌注后第7 天处死前2 h 进行评分。
1.7.2 HE 染色 脑组织置于4%多聚甲醛固定24 h 后,石蜡包埋,行5 μm 厚的连续冠状切片,HE染色,高倍光学显微下观察神经细胞改变。
1.7.3 Western blot RIPA 提取总蛋白,BCA 法测定蛋白质浓度。 行10% SDS-PAGE 凝胶电泳分离,蛋白上样量50~100 μg。 湿式转膜后脱脂牛奶封闭1 h,滴加入相应的NF-κB/p65(1∶500)、IκBα(1∶200)及内参β-action(1∶4 000)一抗,4 ℃孵育过夜;滴加入辣根过氧化物酶标记的二抗(1∶3 000),室温孵育45~60 min;ECL 显色,X 线底片曝光。 Quantity one专业图像分析软件对条带行灰度扫描分析,以样品条带灰度值/相应内参灰度值表示目的蛋白的表达。
1.8 统计学分析
应用SPSS 22.0 统计软件进行分析, 所有数据均采用“±s”表示。 组间两两比较方差齐者用LSD法检验,方差不齐者用Dunnet,s T3 法检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分分数比较
与假手术比较, 模型组神经功能缺损评分显著增加,差异有显著统计学意义(P<0.01);与模型组比较,依达拉奉组、健脾补土方大、中、小剂量组神经功能缺损评分均明显减少,差异有统计学意义(P<0.05或P<0.01),且依达拉奉组、健脾补土方小、中、大剂量组组间差异无统计学意义(P>0.05)。 见表1。
表1 各组大鼠神经功能缺损评分分数比较 (±s,n=20)

表1 各组大鼠神经功能缺损评分分数比较 (±s,n=20)
注:与假手术组比较△△P<0.01;与模型组比较#P<0.05,##P<0.01。 下表同。
组 别假手术组模型组依达拉奉组小剂量组中剂量组大剂量组剂量(g/kg)— —0.0032 3.69 7.38 14.76神经缺损分数(分)0.000±0.000 2.330±0.580△△1.510±0.330#1.690±0.700#1.530±0.330##1.500±0.700##
2.2 各组大鼠大脑皮质区细胞的形态学观察
假手术组:细胞形态和结构均正常,胞核清晰,核仁大圆而完整,胞质色淡且均匀,胞浆丰富,血管周围未见明显炎症细胞浸润(见封三彩图图1-A)。模型组:呈明显的缺血性损害改变,正常组织结构消失,大量细胞坏死,多数细胞体积缩小,胞核固缩深染,排列紊乱,胞质明显减少,炎性细胞浸润,并可见呈空泡性坏死灶(见封三彩图图1-B)。 小剂量组: 缺血侧脑组织神经细胞损伤较模型组有所减轻,正常的神经元细胞增多,炎症细胞浸润减少,少量的空泡性坏死(见封三彩图图1-D)。 中、大剂量组与依达拉奉组:缺血侧脑组织神经细胞损伤较模型组明显减轻,正常的神经元细胞明显增多,少量炎症细胞浸润,未见明显空泡性坏死(见封三彩图图1-C、E、F)。
2.3 各组大鼠大脑皮质NF-κB/p65 和IκBα 蛋白相对表达量的比较
与假手术组比较,模型组胞核内NF-κB/p65 蛋白显著增多(P<0.01), 胞浆内IκBα 蛋白显著减少(P<0.01);与模型组比较,依达拉奉组和健脾补土方大、中、小剂量组胞核内NF-κB/p65 表达减少(P<0.05 或P<0.01), 胞浆内IκBα 蛋白表达增多 (P<0.05 或P<0.01),依达拉奉组、健脾补土方小、中、大剂量组组间比较差异无统计学意义(P>0.05)。 见表2,图2。
表2 各组大鼠大脑皮质NF-κB/p65、IκBα 蛋白相对表达量的比较 (±s,n=10)
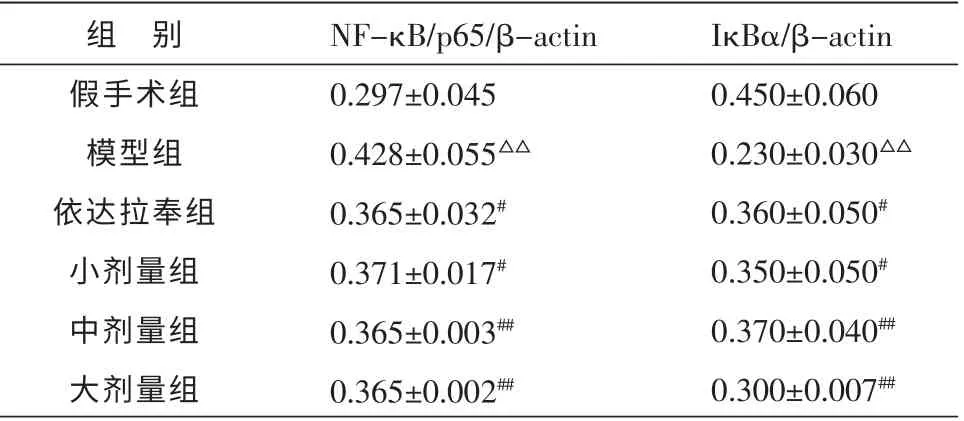
表2 各组大鼠大脑皮质NF-κB/p65、IκBα 蛋白相对表达量的比较 (±s,n=10)
组 别假手术组模型组依达拉奉组小剂量组中剂量组大剂量组NF-κB/p65/β-actin 0.297±0.045 0.428±0.055△△0.365±0.032#0.371±0.017#0.365±0.003##0.365±0.002##IκBα/β-actin 0.450±0.060 0.230±0.030△△0.360±0.050#0.350±0.050#0.370±0.040##0.300±0.007##

图2 各组大鼠大脑皮质NF-κB/p65、IκBα 蛋白表达电泳图
3 讨论
缺血性脑卒中是指各种原因导致的脑部血流供应障碍,脑组织缺血、缺氧性坏死,出现相应神经功能缺损的疾病,是脑血管疾病(CVD)最常见的类型,严重影响人类生存质量,是威胁人类健康最严重的疾病之一。
有研究表明,NF-κB 是应激与炎性反应的中枢调节物[6],被认为是脑缺血后炎症级联反应中最重要的调控因子之一。当细胞处于静息状态下,NF-κB与其抑制性蛋白IκB 结合,以无活性的二聚体滞留于细胞内。脑缺血/再灌注后,释放大量活性氧、氧自由基、兴奋性氨基酸及内毒素,细胞受到这些信号刺激后,IκB 激酶IKKs 磷酸化, 导致IκB 泛素化及降解,NF-κB 与IκB 解离、暴露出Rel 蛋白上的结合位点,NF-κB 被激活,与DNA 特定序列结合,诱导相关基因转录和表达,从而激活炎症因子及细胞因子,导致缺血后炎症反应的发生[7]。 目前,已有大量实验研究表明[8-9],通过提高IκBα 的表达,抑制NF-κB 的表达,从而发挥保护大脑神经元,改善缺血/再灌脑组织损伤的作用。
健脾补土方以人参为君,以白术、茯苓、黄芪为臣,佐以山药、薏苡仁,使以炙甘草,全方具有健脾益气的功效。 实验研究发现黄芪甲苷、 人参皂苷Rg1、Rb1 能抗小鼠脑缺血再灌注后氧化应激损伤和改善能量代谢[10],这些可能是健脾补土方抗脑缺血/再灌注损伤作用的基础之一。
Wester blot 结果显示, 健脾补土方促进脑缺血/再灌注损伤后胞浆内IκBα 蛋白表达,而抑制胞核内NF-κB/p65 的表达, 提示健脾补土方可抑制脑缺血/再灌注损伤大鼠大脑皮质胞核NF-κB/p65 蛋白的核转位和胞浆IκBα 蛋白的降解, 导致NF-κB 信号通路的激活被抑制, 进而抑制各种炎性细胞因子的表达而产生抗炎作用。
以上实验结果综合表明健脾补土方对脑缺血再灌注损伤有保护作用,其具体机制可能是通过抑制NF-κB/p65 蛋白的核转位和胞浆IκBα 蛋白的降解,从而抑制NF-κB 炎性信号通路的激活而抗脑缺血/再灌注损伤。 此外,有实验研究表明NF-κB 信号通路还直接参与促炎细胞因子如肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6),炎症介质如P 选择素等黏附分子表达与调控。 如α-硫辛酸能够降低TNF-α 的表达来抑制NF-κB 的活性,达到保护局灶性脑缺血再灌注后的炎性反应损伤[11]。 滇橄榄提取物可降低IL-1β、IL-6和NF-κB 的表达来抗氧化和抑制炎症反应,保护大鼠脑缺血再灌注损伤[12],也验证了本实验的结论。
[1]Kaushal V,Schlichter LC. Mechanisms of microglia-mediated ne urotoxicity in a new model of of the stroke penumbra [J]. J Neurosci,2008,28(9):2221-2230.
[2]Stephenson D,Y in T,Sm alstig EB,et al. Transcription factor nuclear factor κappa B is activated in neurons after focal cerebral ischemia [J]. Cerebral Blood flow Metab,2000,20(3):592-602.
[3]李 花,刘旺华,周小青,等.健脾补土法对脑缺血再灌注大鼠脑组织MMP-2 的表达及血脑屏障通透性的影响[J].湖南中医杂志,2013,29(2):115-116.
[4]李 花,刘旺华,廖亮英,等.健脾补土法对大鼠脑缺血再灌注后层黏连蛋白降解的影响[J]. 中华老年心脑血管病杂志,2010,12(7):645-647.
[5]Longa EZ, Weinstein PR, Carlson S, Cummins R. Reversible middle cerebral artery occlusion without cranietomy in rats [J]. Stroke,1989,20(1):84-91.
[6]Baker RG, Hayden MS, Ghosh S. NF -κB,inflammation,and metabolic disease [J]. Cell Metab,2011,13(1):11-22.
[7]Huang B,Yang XD,Lang A,et al. Posttranslational modification of NF-κB:another layer of regulation for NF-κB signaling pathway [J]. Cell Signal,2010,22(9):1282-1290.
[8]周 丽,刘艳平,王 芳,等. 丹参酮ⅡA 对I/R 大鼠脑组织NFκB 和IκB 活性的影响[J].中药材,2013,36(7):1136-1139.
[9]董靖德,靳 凌,张 丽,等.厄贝沙坦对大鼠脑缺血再灌注后NF-κB 和IκBα 的 影 响[J].南 京 医 科 大 学 学 报,2012,32(8):1 079-1 082.
[10]黄小平,王 蓓,邱咏园.黄芪甲苷、人参皂苷Rg1、Rb1 和三七皂苷R1 抗小鼠脑缺血再灌注氧化应激损伤和促进能量代谢的配伍研究[J].湖南中医药大学学报,2014,34(7):5-11.
[11]董银华,王洪新,陈泽峰.α-硫辛酸对大鼠脑缺血再灌注损伤炎性机制的影响[J].中风与神经疾病杂志,2014,31(9):799-803.
[12]陈 闯. 滇橄榄提取物对大鼠局灶性脑缺血再灌注损伤的保护作用及机制[J].中国临床药理学与治疗学,2014,19(9):991-994.

