光刺激体外培养的NG2细胞对海马神经元内Ca2+活性和电活动的影响
郭大志,刘怿君,潘树义,何 成,段树民
·神经疾病·
光刺激体外培养的NG2细胞对海马神经元内Ca2+活性和电活动的影响
郭大志,刘怿君,潘树义,何 成,段树民
目的 观察选择性光刺激NG2细胞对海马神经元内Ca2+活性和电活动的影响,并初步探讨可能的作用机制。方法 体外纯化培养新生SD大鼠NG2细胞,通过脂质体转染的方法,在NG2细胞中特异性表达光敏感通道(channelrhodopsin-2,ChR2)蛋白DNA,并与体外培养7 d的海马神经元共培养48 h,采用蓝光(470 nm、5 s、5 mW/cm2)选择性刺激表达ChR2蛋白的NG2细胞,利用Ca2+成像和电生理的方法记录NG2细胞周围海马神经元中的Ca2+浓度变化和电流改变情况,同时比较加入/未加入γ-氨基丁酸A型受体抑制剂情况下神经元的电流变化特点。结果 当蓝光刺激表达ChR2蛋白的NG2细胞后,首先NG2细胞内的Ca2+信号增强,随后其周围海马神经元内的Ca2+升高约20%;Ca2+缓慢下降后再次出现一个Ca2+峰,幅度较第1次小;NG2细胞周围海马神经元的电流频率增加,振幅增大。而当预先在细胞外液中加入50 μmol/L γ-氨基丁酸A受体抑制剂后,海马神经元的电流频率和振幅较未加抑制剂组明显减小(P<0.05)。结论 选择性光刺激表达ChR2蛋白的NG2细胞可使其兴奋,且可能通过释放γ-氨基丁酸来调节神经元活动。
NG2细胞;光敏感通道;神经元;γ-氨基丁酸
NG2细胞是中枢神经系统中一类新型胶质细胞,广泛分布在成年哺乳动物的灰质和白质,占脑内全部胶质细胞的5%~10%,其功能至今未被完全阐明[1]。早期研究发现NG2细胞在体内和体外可分化发育为少突胶质细胞,故又称其为少突胶质细胞前体细胞(oligodendrocyte precursor cells,OPCs)[2]。研究发现,NG2细胞不但可以分化为少突胶质细胞,还可以分化为星形胶质细胞和神经元[3-4]。此外,NG2细胞表达多种受体和离子通道,能够产生类似神经元的“动作电位”及长时程增强(long time potentiation,LTP)[5-6]。因此,NG2细胞在中枢神经系统的发育和整合中发挥重要作用。本研究拟通过在体外纯化培养的大鼠NG2细胞中转染光敏感通道(channelrhodopsin-2,ChR2)蛋白,与大脑海马神经元共培养,利用Ca2+成像和电生理的方法,探讨NG2细胞是否参与神经元活动的调节。
1 材料与方法
1.1 实验动物 新生SD大鼠,由浙江大学动物中心[SCXK(浙)2007-2009]提供。
1.2 实验设备、材料 500Ⅸ激光共聚焦显微成像系统、Fluoview 5.0采集分析软件(日本Olympus公司),恒温振荡器(华利达HI-9211KB,太仓市教课器材厂),激光器和多功能电子定时器(中国科学院神经科学研究所),四维机械微操纵器(SD-MX760,美国Burleigh公司),培养皿(美国Corning公司),多聚赖氨酸(poly-D-lysine,PDL,美国Sigma公司),聚乙二醇辛基苯基醚(上海碧云天生物技术有限公司),血清Opti-MEM培养基(伊格尔最低必需介质培养基改良型,美国Sigma公司),孵育钙荧光染料[Rhod-2,AM,阿拉丁试剂(上海)有限公司],NG2多克隆抗体、血小板源性生长因子(platelet-derived growth factor,PDGF)α单克隆抗体、CD11b、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP,美国Millipore公司),Alexa Fluor 488标志山羊抗兔二抗、Cy3标志山羊抗小鼠二抗(上海碧云天生物技术有限公司)。
1.3 方法
1.3.1 NG2细胞培养 参考文献[7]方法略作修改。取新生SD大鼠脑,取出大脑皮质,0.125%胰蛋白酶,37℃,消化12 min、吹打成单细胞悬液,离心,以1×105/mL种植在预先铺有PDL的75 cm2的培养瓶中。放入37℃、通95%空气和5%CO2的湿润培养箱中,每3 d换培养液。第10天时将培养瓶放置到摇床中200 r/min、37℃摇1 h,去除小胶质细胞。更换新胶质培养基,放入培养箱平衡2 h,再将培养瓶放置到摇床中250 r/min、37℃摇16~18 h,收集培养液到无PDL包被的100 mm的培养皿中,放入培养箱30 min,期间不时轻轻晃动。培养液收集离心后沉淀重悬,接种于PDL处理的玻片上,2 h换成纯化OPCs培养基,贴壁细胞经免疫细胞化学染色鉴定,98%以上为OPCs细胞。
1.3.2 免疫荧光化学 OPCs细胞4%多聚甲醛于室温固定10 min,0.2%的聚乙二醇辛基苯基醚破膜10 min,10%牛血清蛋白封闭1 h,一抗4℃孵育过夜磷酸盐缓冲液(phosphate buffered saline,PBS)洗3遍后,加对应二抗(Alexa Fluor 488标志山羊抗兔二抗或Cy3标志山羊抗小鼠二抗),在室温下避光标志1 h,0.01 mol/L PBS洗3遍后。细胞图像最后于倒置的激光共聚焦显微镜下观察。
1.3.3 脂质体转染 按试剂说明书进行,将脂质体和DNA按2∶1(μL∶μg)比例分别加入150 μL的无血清Opti-MEM培养基,静置5 min后将两者混合,轻轻吹打混匀。放置20 min后加入含Opti-MEM 700 μL的培养皿,于37℃培养箱放置1.5 h,吸去液体后加入大鼠OPCs细胞培养基继续培养。
1.3.4 蓝光刺激 光源为氙灯,通过光纤将激光导出。激光器和多功能电子定时器相连,精确控制激光照射和关闭时间。光强通过功率计测定,470 nm,5 mW/cm2,光斑大小1 cm2。
1.3.5 Ca2+成像 将纯化培养并转染ChR2蛋白的NG2细胞和体外纯培养7 d的海马神经元共培养48 h。在培养箱中孵育钙荧光染料(5 μmol/L)20~30 min,0.01 mol/L PBS洗3遍。通过激光器发射蓝光照射(470 nm、5 mW/cm2),使用激发光谱为543 nm的共聚焦显微镜适时扫描细胞内钙信号的变化(× 60水镜)。为防止荧光强度的淬灭,扫描时激光强度不超过0.5%。
1.3.6 电生理记录 使用Axon 700A放大器采集,Clampex 8.0软件进行记录。电极尖端入水前,轻轻推动注射器在电极内给一个正压。在电压钳模式下用四维机械微操纵器引导充有电极内液的玻璃微电极。待电极尖端靠近细胞后,释放掉正压并顺势用嘴给一个负压,同时慢慢将钳制电压调节到-70 mV。待形成高阻封接(>1 G Ω)之后,给予快速有力的负压使电极尖端下的细胞膜破裂,从而形成全细胞记录模式。在gap-free模式下,比较加入/未加入γ-氨基丁酸(gamma-amino-butyric acid,GABA)A型受体抑制剂情况下,蓝光刺激后表达ChR2蛋白的NG2细胞周围海马神经元的电流变化。
1.4 统计学处理 应用GraphPad Prism 5软件,计量资料用均数±标准差(±s)表示,组间比较采用Student's t检验法,P<0.05为差异有统计学意义。
2 结果
2.1 NG2细胞免疫组化鉴定 NG2细胞纯化培养贴壁生长1~2 d后,NG2抗体阳性细胞数可达到95%以上,细胞胞体直径很小(<10 μm),且呈现比较典型的“双极”或“多极”突起的形态,不表达星形胶质细胞特异标志物GFAP和小胶质细胞特异标志物CD11b(图1)。
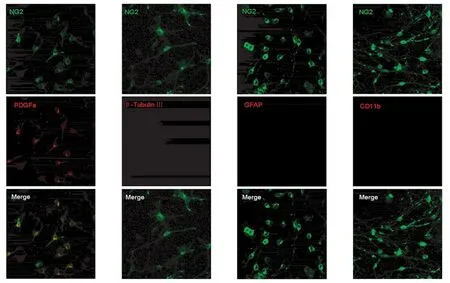
图1 体外纯化培养的大鼠NG2细胞鉴定
2.2 Ca2+活性 光刺激表达ChR2蛋白的NG2细胞可诱导其周围海马神经元的Ca2+活性升高(图2)。当给转染ChR2蛋白的NG2细胞蓝光刺激(5 s、5 mW/cm2)后,首先出现NG2细胞内的Ca2+信号增强,随后其周围海马神经元内的Ca2+升高约20%;Ca2+缓慢下降后再次出现一个Ca2+峰,幅度较第1次小。
2.3 神经元电活动 光刺激表达 ChR2蛋白的NG2细胞可调节神经元的电活动(图3),当给转染ChR2蛋白的NG2细胞蓝光刺激(5 s、5 mW/cm2)后,其周围海马神经元的电流频率增加、振幅增大[蓝光刺激组(234±10.5)pA,蓝光未刺激组(132± 12.8)pA;n=29,P<0.05]。在细胞外液中加入50 μmol/L GABA A受体抑制剂Bicuculin,蓝光刺激转染ChR2蛋白的NG2细胞后,其周围海马神经元的电流频率和振幅明显减小[加抑制剂组(129±11.6) pA,无抑制剂组(234±10.5)pA;n=29,P<0.05]。
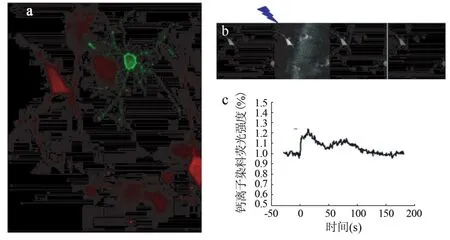
图2 蓝光刺激表达ChR2蛋白的NG2细胞诱导周围海马神经元的Ca2+活性升高
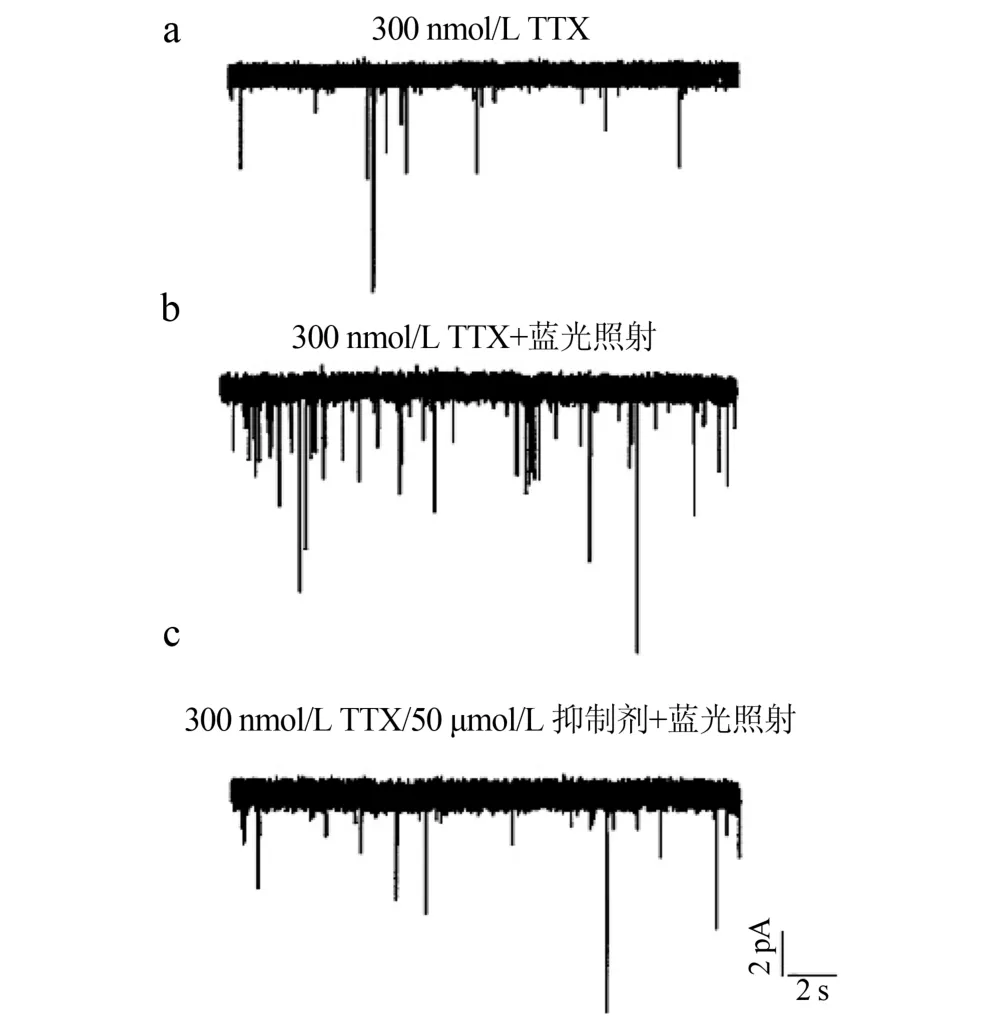
图3 光刺激表达ChR2蛋白的NG2细胞调节神经元的电活动
3 讨论
NG2细胞被发现可分化为少突胶质细胞、Ⅱ型星形胶质细胞,故又叫Ⅱ型星形胶质细胞祖细胞、少突胶质细胞前体细胞或多形性细胞等[8]。在特定脑区,NG2细胞还可以分化为神经元[3]。越来越多的证据表明,NG2细胞在成年中枢神经系统的灰质和白质部位均匀分布,且无论从形态和电生理特性上均有别于星形胶质细胞、少突胶质细胞和小胶质细胞,目前被认为是中枢神经系统中的第4类胶质细胞[9]。迄今为止,NG2细胞的生理功能仍不清楚。电镜研究发现,NG2细胞的胞体在海马区、小脑、皮质等许多脑区与神经元密切相邻,形成“突触样”结构。该结构与神经元突触不同,“突触”后致密带不明显,突触前纽扣较小、囊泡较少[10]。电生理研究发现,成年海马区、胼胝体和小脑等部位的NG2细胞突起与神经元轴突相靠近,接收神经元信号,其Na+从细胞外流入细胞内,产生类似神经元动作电位的Spike[11-14],甚至产生LTP[6]。这些研究提示,NG2细胞在成年脑内除具有前体细胞分化功能外,也可能参与神经网络调节。Tanaka等[15]发现NG2细胞能够释放突触调节物质,如脑源性神经营养因子,更进一步支持上述观点。
ChR2蛋白在藻类中是一种光敏感通道蛋白,含315个氨基酸,构成7次跨膜结构,其中1个全反式视黄醛结合在蛋白核心部位,发挥光感受器的作用。当ChR2蛋白受到470 nm的蓝光刺激后,其全反式视黄醛异构化,导致蛋白结构改变,通道开放(Na+、Ca2+通道),阳离子进入细胞内,从而产生内向电流使细胞兴奋[16]。ChR2蛋白的开放与关闭时间极短,达毫秒级,可用来刺激神经元稳定发放动作电位,近年被广泛用于研究神经元网络、突触可塑性相关功能及疾病的研究[17]。为探讨NG2细胞兴奋后是否影响神经元活动,本研究将转染ChR2蛋白的NG2细胞制成单细胞悬液(转染率25%左右),与体外纯化培养7 d的海马神经元共培养48 h,利用光刺激技术特异性促使NG2细胞兴奋,进行Ca2+成像实验,结果表明蓝光刺激NG2细胞5 s(5 ms的脉冲、10 Hz)足以引起NG2细胞内Ca2+浓度变化,进而诱发神经元内Ca2+浓度升高,提示NG2细胞活性增加后可影响神经元活动。由于Ca2+成像实验过程中没有加河豚毒素,没有阻断神经元的自发动作电位,故不排除第2个Ca2+峰是由神经元兴奋后的高反应性所致。
蓝光刺激表达ChR2蛋白的NG2细胞兴奋所需时间较表达ChR2蛋白的神经元要长,表明两者细胞膜的电特性不同。有研究发现,NG2细胞膜的静息电位与K+平衡电位接近,约-100 mV,Na+通道密度较K+通道低[18]。提示NG2细胞很难像神经元一样产生动作电位,故兴奋性比神经元低。然而,NG2细胞表达Ca2+通透的α-氨基-3羟基-5-甲基-异恶唑丙酸受体(开关时间30~500 ms),正常条件下Ca2+内流较少,但在某些条件下Ca2+内流增加仍能诱导NG2细胞产生 Spike或 LTP[5-6]。另有研究发现,NG2细胞表达代谢型P2Y1受体和离子型P2X7受体,ATP可通过作用于NG2细胞膜的这2种受体产生瞬时和长时程的Ca2+反应[19]。因此,Ca2+在NG2细胞兴奋中发挥重要作用。根据本研究结果,蓝光照射表达ChR2蛋白的NG2细胞,使细胞外的Ca2+通过ChR2蛋白进入细胞内,诱导NG2细胞内的Ca2+库释放,进一步激活NG2细胞膜表面的Ca2+通透性受体,形成“正瀑布”效应。当达到NG2细胞膜去极化的“阈值”时,NG2细胞兴奋发挥作用,最终影响其周围海马神经元的Ca2+活性。这也能够解释为何NG2细胞需要长达5 s的蓝光刺激才能引起神经元活动改变。由于担心蓝光强度过大会导致荧光淬灭或细胞死亡,本研究采用的光刺激强度较低,也可能是NG2细胞兴奋所需时间较长的原因之一。
有研究表明,NG2细胞表达突触蛋白synaptophysin——一种主要的突触囊泡蛋白,提示NG2细胞可能有囊泡释放神经物质的功能[20]。另有研究发现,大脑梨状皮质部位的NG2细胞形似星形的中间神经元,可以分化为GABA能中间神经元,因此不除外NG2细胞具有释放内源性抑制性神经递质GABA的功能[3]。Ca2+成像实验结果提示,NG2细胞兴奋可以影响神经元的细胞活动。那么NG2细胞是否对神经元的电活动有影响?本研究将转染ChR2蛋白的NG2细胞与海马神经元共培养48 h,采用全细胞膜片钳技术,当对表达ChR2蛋白的NG2细胞进行蓝光照射后,其周围海马神经元的电活动明显增加,而预先孵育GABA A型受体抑制剂后,神经元电活动被明显抑制,表明NG2细胞兴奋可能通过向细胞外释放GABA来调解神经网络。目前,还没有确切证据表明NG2细胞能够释放GABA作用于神经元,也不知道NG2细胞是否表达合成GABA所需的酶、运输GABA的囊泡装置以及GABA是如何释放出NG2细胞,未来还需要进一步研究。
本研究发现,选择性光刺激NG2细胞可使其兴奋,且可能通过释放GABA来调节神经元活性,进一步提示NG2细胞不但具有神经前体细胞的功能,还参与神经网络的调控,可能在某些病理生理条件下发挥重要作用,成为未来治疗脱髓鞘相关疾病的靶点。但本研究仅停留在体外细胞培养层面,而体内环境十分复杂,未来需进行脑片实验对不同脑区的NG2细胞发挥的功能进一步阐明。
[1]Wigley R,Hamilton N,Nishiyama A,et al.Morphological and physiological interactions of NG2-glia with astrocytes and neurons[J].J Anat,2007,210(6):661-670.
[2]Levine JM,Stallcup WB.Plasticity of developing cerebellar cells in vitro studied with antibodies against the NG2 antigen[J].J Neurosci,1987,7(9):2721-2731.
[3]Rivers LE,Young KM,Rizzi M,et al.PDGFRA/NG2 glia generate myelinating oligodendrocytes and piriform projection neuronsin adult mice[J].Nat Neurosci,2008,11(12): 1392-1401.
[4]Chen C,Daugherty D,Jiang P,et al.Oligodendrocyte progenitor cells derived from mouse embryonic stem cells give rise totype-1 and type-2 astrocytes in vitro[J].Neurosci Lett,2012,523(2):180-185.
[5]Honsek SD,Walz C,Kafitz KW,et al.Astrocyte calcium signals at Schaffer collateral to CA1 pyramidal cell synapses correlate with the number of activated synapses but not with synaptic strength[J].Hippocampus,2012,22(1):29-42.
[6]Ge WP,Yang XJ,Zhang Z,et al.Long-term potentiation of neuron-glia synapses mediated by Ca2+-permeable AMPA receptors[J].Science,2006,312(5779):1533-1537.
[7]Yang Z,Watanabe M,Nishiyama A.Optimization of oligodendrocyte progenitor cell culture method for enhanced survival[J].J Neurosci Methods,2005,149(1):50-56.
[8]Nishiyama A,Suzuki R,Zhu X.NG2 cells(polydendrocytes)in brain physiology and repair[J].Front Neurosci,2014,8:133.
[9]Peters A.A fourth type of neuroglial cell in the adult central nervous system[J].J Neurocytol,2004,33(3):345-357.
[10]Bergles DE,Roberts JD,Somogyi P,et al.Glutamatergic synapses on oligodendrocyte precursor cells in the hippocampus[J].Nature,2000,405(6783):187-191.
[11]Chittajallu R,Aguirre A,Gallo V.NG2-positive cells in the mouse white and grey matter display distinct physiological properties[J].J Physiol,2004,561(Pt 1):109-122.
[12]Káradóttir R,Cavelier P,Bergersen LH,et al.NMDA receptors are expressed in oligodendrocytes and activated in ischaemia[J].Nature,2005,438(7071):1162-1166.
[13]Ziskin JL,Nishiyama A,Rubio M,et al.Vesicular release of glutamate from unmyelinated axons in white matter[J]. Nat Neurosci,2007,10(3):321-330.
[14]Mangin JM,Kunze A,Chittajallu R,et al.Satellite NG2 progenitor cells share common glutamatergic inputs with associated interneurons in the mouse dentate gyrus[J].J Neurosci,2008,28(30):7610-7623.
[15]Tanaka Y,Tozuka Y,Takata T,et al.Excitatory GABAergic activation of cortical dividing glial cells[J].Cereb Cortex,2009,19(9):2181-2195.
[16]Nagel G,Szellas T,Kateriya S,et al.Channelrhodopsins: directly light-gated cation channels[J].Biochem Soc Trans,2005,33(Pt 4):863-866.
[17]Kato HE,Zhang F,Yizhar O,et al.Crystal structure of the channelrhodopsin light-gated cation channel[J].Nature,2012,482(7385):369-374.
[18]Lin SC,Bergles DE.Physiological characteristics of NG2-expressing glial cells[J].J Neurocytol,2002,31(6/7): 537-549.
[19]Hamilton N,Vayro S,Wigley R,et al.Axons and astrocytes release ATP and glutamate to evoke calcium signals in NG2-glia[J].Glia,2010,58(1):66-79.
[20]Sun W,Dietrich D.Synaptic integration by NG2 cells[J]. Front Cell Neurosci,2013,7:255.
Influence of Ca2+and electrical activity in neurons of hippocampus by stimulating NG2 cells with blue light in vitro
GUO Dazhi1,LIU Yijun2,PAN Shuyi1,HE Cheng3,DUAN Shumin2
(1.Department of Hyperbaric Oxygen,Navy General Hospital,Beijing 100048,China;2.Institute of Neuroscience,Zhejiang University,Hangzhou Zhejiang 310058,China;3.Department of Neurobiology,the Second Military Medical University,Shanghai 200433,China)
Objective It has been investigated that the change of Ca2+and electrical activity in neurons of hippocampus influenced by NG2 cells which expressed channelrhodopsin-2(ChR2) and were stimulated by blue light,and then discussed the probable mechanism.Methods We cultured NG2 cells from the cortex of neonatal rats,and transfected ChR2 DNA to NG2 cells through liposomes,then co-cultured NG2 cells expressed ChR2 protein with hippocampal neurons for 48 hours.By way of calcium imaging and electrophysiological recording,we could observe the change of calcium concentration and current in hippocampal neurons around the NG2 cells expressed ChR2 which were stimulated by blue light(470 nm,5 s,5 mW/cm2).Meanwhile,we compared the change of current in hippocampal neuron pre-adding inhibitor in extracellular fluid with no inhibitor. Results In calcium imaging experiment,we found that there was an elevation of Ca2+concentration in NG2 cells expressed ChR2 as soon as the blue-light stimulus,and then Ca2+concentration in neurons around NG2 cells increased by 20%,following a second Ca2+peak which its amplitude was smaller than the first.In the electrophysiological experiment,we found that it was bigger of the frequency and amplitude of current in neurons around NG2 cells expressed ChR2 which were stimulated by blue light than those with no blue light.However,if we added γ-amino-butyric acid(GABA)A receptor inhibitor(bicuculin,50 μmol/L)in extracellular fluid in advance,the frequency and am-plitude of current in neurons around NG2 cells expressed ChR2 which were stimulated by blue light (5 s,5 mW/cm2)were significantly smaller than those with no inhibitor(P<0.05).Conclusion Selective stimulating NG2 cells expressed ChR2 protein with blue light is able to excite NG2 cells and may regulate neural activity by releasing GABA.
NG2 cells;Channelrhodopsin-2(ChR2);Neuron;Gamma-amino-butyric acid (GABA)
R338.1-332
A
2095-3097(2015)04-0208-05
10.3969/j.issn.2095-3097.2015.04.005
2015-03-24 本文编辑:徐海琴)
国家自然科学基金项目(81401063)
100048北京,海军总医院高压氧科(郭大志,潘树义);310058浙江杭州,浙江大学神经科学研究所(刘怿君,段树民);200433上海,第二军医大学神经生物学教研室(何 成)

