桑沟湾长牡蛎生物沉积物对环境底质影响的同位素证据
任黎华 , 张继红 牛亚丽 张义涛 , 李加琦 , 张明亮
(1. 中国水产科学研究院 黄海水产研究所 农业部海洋渔业资源可持续利用重点实验室, 山东 青岛 266071;2. 昆山市水产技术推广站, 江苏 昆山 215300; 3. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室, 山东 烟台 264006)
近几十年来, 随着水产养殖事业的迅速发展,其所带来的环境影响也逐步受到人们的关注。以渔场对养殖区底质的影响为例, 越来越多的科研人员对渔场养殖产生的有机废物带来的影响进行了相关研究, 如海水鱼类养殖造成的污染的生物影响[1-3],有机物与营养物质的富集[4]对初级生产力以及食物网的影响[5-8], 还有对水质及底质的影响[9-14]。大量的研究证据均表明, 集约化养殖的残饵和粪便等养殖废物, 均对养殖环境造成了影响。
与渔场养殖相比, 贝类养殖同样存在着相似问题。多数的筏式养殖贝类虽然不需要人工投喂饵料,但其高密度养殖大大加速了海水水体中的有机物质向海底输送的速度[15-17]。滤食性贝类耦合了养殖海区水体与海底生态系统的关系[18-19], 大量的生物性沉积物(包括粪便和假粪)会对养殖区底质产生影响。最近的研究主要集中在贻贝、牡蛎等主要养殖种类产生的环境影响[20-34], 其中, 包括沿绳养殖贻贝的生物沉积作用、贻贝生物沉积物的产生和扩散[20-23]、贻贝生物沉积物对周围表层沉积物的影响[11,17,24-26]、贻贝生物沉积物对养殖区底部生物群落的影响[20,27-28]、牡蛎生物沉积作用的年际变化[29]; 牡蛎生物沉积物对泥滩沉积物与生态的影响[30-32]、牡蛎生物沉积物对养殖区沉积物有机物的富集作用[33]以及牡蛎生物沉积物的环境干扰[34]等。在这些研究结果中, 有些表示未检查到贝类生物沉积物的相关影响[26,28], 有些报道认为贝类生物沉积物产生的影响还很小[24,35],多数则认为贝类的生物沉积物对养殖区的生态环境带来的显著的影响。
稳定同位素是近年来水域生态系统研究领域中重要的新兴技术[36], 被认为是检测海岸带生态系统极为有效的工具[37], 在鱼类养殖废物对环境的影响中应用广泛[38-41], 如Ye等[38]利用 δ13C对沉积物有机碳的来源进行了定量研究, 然而对贝类生物沉积物的定量研究, 还未见报道。
桑沟湾是中国北方典型的海水养殖海湾, 在该湾中有大量的筏式养殖水域, 长牡蛎是主要的养殖种类之一。在桑沟湾南岸及湾内部分水域, 这些筏式养殖区多以长牡蛎养殖为主。作者在2013年4月选择了 5个牡蛎养殖场进行养殖区沉积物的同位素分析, 藉此尝试对桑沟湾筏式养殖长牡蛎生物沉积物对环境底质影响进行量化研究。
1 材料和方法
1.1 研究时间与地点
样品采集时间为2013年4月, 采样地点位于中国山东荣成的桑沟湾 (37°01′~37°09′ N, 122°24′~122°35′ E)。桑沟湾是中国北方典型的海水养殖海湾,海湾面积约140 km2, 平均水深7 m, 主要的养殖方式为筏式养殖。在海湾中部与北部, 多为经济贝类与大型海藻的综合养殖区域, 湾外为大型海藻的养殖筏架, 而湾内与南岸完全为牡蛎养殖所占据。在桑沟湾牡蛎养殖区选择了5个牡蛎养殖场, 分别为SG 2、SG 3、 SG 4、SG 5、SG 6 (图 1)。此外, 还选择了湾外没有人工养殖的两个点SG C和SG 1做为对照。SG 7为湾内没有人工养殖的海域, 距离SG 6较为接近, 作为湾内的空白对照点。在样品采集的同时, 通过YSI proplus便携式多参数水质监测仪测定海区温度、盐度、pH等参数指标。采样点水深通过采泥器绞绳上的刻度测定。

图1 桑沟湾中各采样点示意图Fig.1 Map of sampling sites in Sungo Bay, China
1.2 样品采集
实验采集的样品主要包括养殖长牡蛎生物沉积物样品, 各采样点底质沉积物的样品, SG 2 与SG 6点设置沉积物捕集器捕集悬浮颗粒物样品。样品的具体采集方式如下:
1.2.1 长牡蛎生物沉积物样品
从SG 2与SG 6 点取得的养殖长牡蛎, 1 h内运回岸上的实验室, 小心清除其表面的泥沙及附着生物后, 暂养于沙滤过的海水中, 5 h后, 收集长牡蛎生物沉积物样品。
1.2.2 底质沉积物样品
在各采样点使用Van Veen抓斗式采泥器采集表层(0~3 cm)沉积物样品。封存于聚乙烯封口袋后放置于冰盒中, 运回实验室后–20℃冷冻保存备用。
1.2.3 悬浮颗粒物样品
于SG 2和SG 6点养殖筏架上悬挂实验室设计的沉积物捕集器, 捕集器为内径11 cm, 高55 cm的聚乙烯塑料管, 3根管捆为一组, 互为重复。沉积物捕集器放置72 h后取回, 静置2 h后弃去上清液, 收集到的悬浮颗粒物–20℃冷冻保存备用。
1.3 样品处理
所有的样品均需在60℃下烘干48 h以上至恒质量。使用玛瑙研钵研磨成粉末。样品在进行稳定同位素分析前需进行酸化处理, 以每0.5 g样品添加1 N 盐酸5 mL的比例酸化4 h 以上以去除样品中的无机碳。酸化中的样品每小时要摇匀2次, 保证样品与盐酸充分接触, 使反应完全。酸化结束后, 多余的盐酸通过低速离心去除后, 再次烘干至恒质量, 研磨成粉末待用。
稳定碳氮同位素的测定采用 Isoprime稳定同位素比值质谱仪(DELTA V Advantage), 外接设备为Thermo Fisher Scientific, Inc., USA生产元素分析仪(Flash EA1112 HT), 稳定同位素丰度按以下公式计算得出:
δ X(‰) = [(R样品/R标准) –l]×103
其中, X为C或 N, R为13C/12C或15N/14N的相对比率, R标准值为国际标准物质 PDB的碳同位素比值或标准大气氮同位素比值。实验分析结果的相对误差 δ13C 为± <0.1‰, δ15N 为± <0.2‰。有机碳氮含量在同位素分析同时得出。
根据分析所得的稳定碳氮同位素数据, 有机物的来源甄别采用线性混合模型[38,42]:

底质贡献率计算时, 有机物来源确定为 2项时,设 z为 0, 即

其中M代表有机物受体, x、y、z分别代表对M产生有机物影响的来源, f代表各种来源对底质有机物的贡献比例。
2 结果
各采样的点的水质参数指标见表1。水温从SG C到SG 7的升高, 可能与取样点水深及取样的先后顺序有关。其中SG C与SG 1为非养殖区域, 位于桑沟湾湾口外侧, 水深约为20 m, 为湾内养殖区的2倍以上, 可以认为其受湾内养殖的影响较小。
经稳定同位素分析获得各样品的稳定碳氮同位素丰度与元素分析仪分析获得的有机碳氮含量在表2中列出。

表1 各采样点水深与水质参数Tab.1 Depth and water condition of each sampling site

表2 采集样品的稳定碳氮同位素丰度与有机碳氮含量Tab.2 δ13C and δ15N values and organic C and N contents of different kinds of samples
从碳氮稳定同位素的测定结果可以看出, 实验所选取的采样点沉积物稳定碳氮同位素丰度集中于δ13C–22.82‰ ~–21.62‰, δ15N 4.73‰ ~6.21‰。从 SG C与 SG 1 两个对照点到各养殖点的碳氮同位素呈富集趋势。两采样点SG 2与SG 6的牡蛎生物性沉积物的稳定碳氮同位素值相近, 分别为 δ13C:–18.49‰±0.46‰与 –18.76‰±0.16‰; δ15N: 6.53‰±0.09‰与 6.40‰±0.02‰。牡蛎生物性沉积物的碳氮同位素值均高于悬浮颗粒物与采样点的沉积物。
从沉积物的有机碳氮含量来看, SG 4采样点有机碳氮含量均处于最高值, 分别为C: 0.92%±0.12%,N: 0.12%±0.04%。最低值出现在SG 7采样点, 分别为C: 0.14%±0.02%, N: 0.03%±0.00%。而底质沉积物的有机碳氮含量均低于悬浮颗粒物质中的有机碳氮值。牡蛎生物沉积物的有机碳氮含量在SG 2与SG 6点较为接近, 约为悬浮颗粒物有机碳氮含量的3倍。
根据SG 2与SG 6样品稳定同位素的测定结果,分别以SG 1与SG 7的沉积物样品测定值为对照, 通过稳定同位素来源分析图谱, 对 2个采样点的有机物来源进行计算, 获得的分析结果见图2。
从图2中可以看出, SG 2采样点悬浮颗粒物的δ13C、δ15N值处于由对照SG 1点沉积物、SG 2点沉积物与长牡蛎生物性沉积物的 δ13C、δ15N值所组成的三角形内。可以认为他们是SG 2点的悬浮颗粒物有机物来源。通过线性混合模型进行计算, 结果表明:在SG 2点的悬浮物中, 长牡蛎生物性沉积物贡献有机物占9.95%, 对照区沉积物与SG 2区沉积物贡献分别为54.19%和35.86%。

图 2 SG 2与SG 6采样点沉积物中有机物来源稳定碳氮同位素图谱Fig.2 Dual isotope plots for sediments in SG 2 and SG 6
而在SG 6采样点的有机物来源图谱中, 对照点 SG 7沉积物的测定结果显示其不能成为 SG 6点的对照区。且SG 6区海水悬浮颗粒物也偏出SG 6与SG 7点沉积物与该区牡蛎生物性沉积物组成的三角形。
根据线性模型, 以SG 2与SG 6两个采样点的长牡蛎生物性沉积物的稳定碳同位素的平均值为影响源, 以SG C采样点沉积物稳定碳同位素为空白对照,对桑沟湾海区的各采样点养殖长牡蛎生物性沉积物的影响进行估算, 有机物来源对底质有机物的贡献比例计为贡献率, 结果见表3。
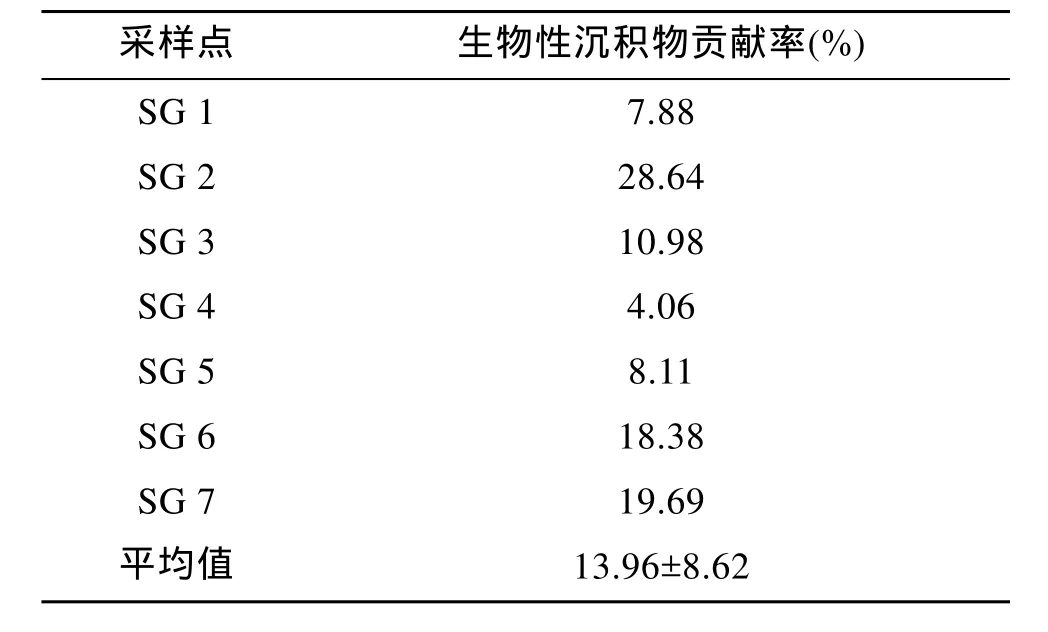
表3 长牡蛎生物性沉积物对各采样点沉积物的贡献率Tab.3 Contribution of biodeposits to sediments of each site
各采样点的沉积物样品中, 养殖长牡蛎的生物性沉积物所占得比例估算的结果为4.06%~28.64%。其中, SG 4点所占的比例最低, 为4.06%。SG 5点与养殖区外的 SG 1点水平相近, 分别为 8.11%与7.88%。最高值28.64%出现在SG 2点。各采样点的数据计算得出的养殖长牡蛎生物性沉积物贡献率为13.96% ± 8.62 %。
3 讨论与结论
作为海岸带系统重要的研究方法之一, 稳定同位素在生态学研究中的应用逐步成熟并日益完善。Vizzini[37]等也通过分析养殖区域生产者与消费者的稳定C、N同位素, 对陆基渔场产生的废弃有机物的扩散情况进行了评估。Ye等[38]对鲑鱼(Salmo salar)养殖场的有机物通过稳定同位素δ13C进行了追踪。在贝类的相关研究中, Jiang[43]等尝试定量了不同养殖区域长牡蛎, 受养殖区鱼类养殖残饵与粪便影响的情况。这些研究均选择了明确的有机物源, 在中国北方的海湾中, 大规模集约化养殖的贝类通过滤食海区的有机物而产生的大量生物性沉积物的影响与此前的研究存在较大的差异。作者针对中国北方典型海湾桑沟湾大规模长牡蛎养殖造成的环境影响进行了初步量化研究。
养殖区的养殖条件是选择养殖种类的最重要限制因子之一。在桑沟湾中, 大量的长牡蛎养殖即是养殖条件限制的结果。渔民在保证收获的前提下, 对养殖区进行合理有效的利用, 在靠近湾内的区域, 水深均低于9 m(表1)。长牡蛎成为普遍的养殖对象。然而, 受养殖年限与外源输入的影响, 各点的长牡蛎养殖生物性沉积物对环境底质的影响也各有差异。以SG 4点为例, 通过δ13C计算得到的生物性沉积物所占得比例仅为最低的 4.06%(表 3)。而从有机C、N的含量来看是所有采样点中的最高值(表 2)。这可能与该区域部分集中的鱼类养殖网箱有关[44]。一方面, 养殖网箱减少了养殖区长牡蛎养殖筏架所占得比例; 另一方面, 鱼类养殖产生的大量残饵和粪便提高了该区的沉积物有机碳氮含量。
通过SG 2与SG 6两个点的有机物来源同位素图谱比较可以发现。SG 2点可以较好的体现出长牡蛎养殖区悬浮颗粒物的有机物组成结构, 与此前的相关研究结果一致[39,43]。而在SG 6点中则未能完成,以SG 7 作为对照点, 其沉积物δ13C和δ15N的值均高于SG 6点, 这说明靠近海岸的SG 7点受到其他因素的影响, 而这个因素有可能同时也影响到SG 6点的悬浮颗粒物。结合长牡蛎生物性沉积物对各采样点沉积物的贡献率的估算结果来看, SG 7点长牡蛎生物性沉积物贡献率为 19.69%, 这可能与此处水深较浅, 水流平缓, 适宜悬浮物沉降有关[7,45-46]。
在大量生物性沉积物沉降速率的研究中, 鱼类粪便与残饵可扩散至400 m[45]; 水深8 m、平均流速5.5 cm/s的贻贝(Mytilus edulis L.)养殖区, 生物沉积物的扩散范围约为 7~24.4 m[21]; 桑沟湾皱纹盘鲍(Haliotis discus hannai)生物性沉积物约为74~134 m[47]。因此, 大范围的有机物扩散给采样点的生物沉积物覆盖提供了可能。所以在设定的采样点内, SG 1与SG 7两个采样点虽然没有长牡蛎的养殖活动, 但是,就近的牡蛎养殖区排出的长牡蛎生物性沉积物, 也对这些区域产生了影响。
实验通过稳定同位素方法量化桑沟湾养殖长牡蛎生物性沉积物对养殖区沉积物贡献结果表明, 在典型的采样点, 该方法能较准确的量化出各有机物来源的贡献比例。以SG C点为对照, 其余7个采样点长牡蛎生物性沉积物有机物贡献在 4.06%~28.64%, 平均贡献率为13.96 %± 8.62 %。
[1] Ackefors H. The impact on the environment by cage farming in open water[J]. Journal of Aquaculture in the Tropics, 1986, 1: 25-33.
[2] Iwama G K. Interactions between aquaculture and the environment[J]. Critical Reviews in Environmental Conservation, 1991, 21(2): 177-216.
[3] Wu R S S. The environmental impact of marine fish culture: towards a sustainable future[J]. Marine Pollution Bulletin, 1995, 31(s4-12): 159-166.
[4] Alabaster J S. Report of the EIFAC workshop on fish farm effluents[M]. Silkeborg Denmark: FAO Rome,1982.
[5] Gundersen K. The distribution and biological transformation of nitrogen in the Baltic Sea[J]. Marine Pollution Bulletin, 1981, 12(6): 199-205.
[6] Handy R D, Poxton M G. Nitrogen pollution in mariculture: toxicity and excretion of nitrogenous compounds by marine fish[J]. Reviews in Fish Biology and Fisheries, 1993, 3(3): 205-241.
[7] Gowen R J, Bradbury N B. The ecological impact of salmon farming in coastal waters: a review[J]. Oceanography and Marine Biology: An Annual Review, 1987,25(2): 563-575.
[8] Pillay T V R. Aquaculture and the environment[J].Aquaculture and the Enviroment, 2003, 21(4): 12-14.
[9] Handerson R J, Forrest D A M, Black K D, et a1. The lipid composition of sealoch sediments underlying salmon cages[J]. Aquaculture, 1997, 158(1): 69-83.
[10] McGhie T K, Crawford C M, Mitchell I M, et al. The degradation of fish-cage waste in sediments during fallowing[J]. Aquaculture, 2000, 187(s3-4): 351-366.
[11] La Rosa T, Mirto S, Favaloro E, et al. Impact on the water column biogeochemistry of a Mediterranean mussel and fish-farm[J]. Water Research, 2002, 36(3):713-721.
[12] Holmer M, Marba N, Duarte C M, et al. Impact of milkfish (Chanos chanos) aquaculture on carbon and nutrient fluxes in the Bolonao area, Philippines[J].Marine Pollution Bulletin, 2002, 44(7): 685-696.
[13] Carroll M L, Cochrane S, Fieler R, et a1. Organic enrichment of sediments from salmon farming in Norway: Environmental factors, management practices and monitoring techniques[J]. Aquaculture, 2003,226(1): 165-180.
[14] Alongi D M, Mckirmon A D, Brinkman R, et a1. The fate of organic matter derived from small—-scale fish cage aquaculture in coastal waters of Sulawesi and Sumatra,Indonesia[J]. Aquaculture, 2009, 295(1-2): 60-75.
[15] Haven D S, Morales-Alamo R. Aspects of biodeposition by oysters and other invertebrate filter feeders[J]. Limnology Oceanography, 1966, 11(4):487-498.
[16] McCall P L. The effects of deposit feeding oligochaetes on particle size and settling velocity of Lake Erie sedi ments[J]. Journal of Sedimentary Petrology, 1979,49(3): 813-818.
[17] Hatcher A, Grant J, Schofield B. Effects of suspended mussel culture (Mytilus spp.) on sedimentation, benthic respiration and sediment nutrient dynamics in a coastal bay[J]. Marine Ecology Progress Series, 1994, 115(3):219-235.
[18] Kautsky N, Evans S. Role of biodeposition by Mytilus edulis in the circulation of matter and nutrients in a Baltic coastal ecosystem[J]. Marine Ecology Progress Series, 1987, 38(3): 201-212.
[19] Dame R F. Bivalve Filter Feeders: in estuarine and coastal ecosystem processes[M]. Berlin: Springer-Heidelberg, NATO ASI series, 1993.
[20] Hartstein N D, Stevens C L. Deposition beneath long-line mussel farms[J]. Aquacultural Engineering,2005, 33(3): 192-213.
[21] Callier M D, Weise A M, McKindsey C W.Sedimentation rates in a suspended mussel farm(Great-Entry Lagoon, Canada): biodeposit production and dispersion[J]. Marine Ecology Progress Series,2006, 322(1): 129-141.
[22] Giles H, Pilditch C A. Effects of diet on sinking rates and erosion thresholds of mussel Perna canaliculus biodeposits[J]. Marine Ecology Progress Series, 2004,282(1): 205-219.
[23] Miller D C, Norkko A, Pilditch C A. Influence of diet on dispersal of horse mussel Atrina Zelandica biodeposits[J]. Marine Ecology Progress Series, 2002,242(242): 153-167.
[24] Baudinet D, Alliot E, Berland B, et al. Incidence of mussel culture on biogeochemical fluxes at the sediment-water interface[J]. Hydrobiologia, 1990,207(1): 187-196.
[25] Chamberlain J, Fernandes T F, Read P, et a1. Impacts of biodeposits from suspended mussel (Mytilus edulis L.)culture on the surrounding sacrificial sediments[J].ICES Journal of Marine Science, 2001, 58(2): 411-416.
[26] Crawford C M, Macleod C K A, Mitchell I M. Effects of shellfish farming on the benthic environment[J].Aquaculture, 2003, 224(1): 117-140.
[27] Mirto S, La Rosa T, Danovaro R, et al. Microbial and meiofaunal response to intensive mussel-farm biodeposition in coastal sediments of the Western Mediterranean[J]. Marine Pollution Bulletin, 2000,40(3): 244-252.
[28] Danovaro R, Gambi C, Luna G M, et a1. Sustainable impact of mussel farming in the Adriatic Sea (M editerranean Sea): evidence from biochemical,microbial and meiofaunal indicators[J]. Marine Pollution Bulletin, 2004, 49(4): 325-333.
[29] Bernard F R. Annual biodeposition and gross energy budget of mature Pacific Oysters, Crassostrea gigas[J].Journal of the Fishery Research Board of Canada,1974, 31(2): 185-190.
[30] Ottman F, Sornin J M. Observations on sediment accumulation as a result of mollusk culture systems in France. In: international symposium on utilization of coastal ecosystem: planning, pollution and productivity[M]. Rio Grande, Brazil: FURG, 1985: 329-337.
[31] Bertin X, Chaumillon E, Sottolichio A, et al. Tidal inlet response to sediment infilling of the associated bay and possible implications of human activities: the Marennes-Oléron Bay and the Maumusson Inlet, France[J].Continental Shelf Research, 2005, 25(9): 1115-1131.
[32] Bouchet V M P, Debenay J P, Sauriau P G, et al. Effects of short-term environmental disturbances on living benthic foraminifera during the Pacific oyster summer mortality in the Marennes-Oléron Bay (France) [J].Marine Environmental Research, 2007, 64(3): 358-383.
[33] Mitchell I M. In situ biodeposition rates of Pacific oysters (Crassostrea gigas) on a marine farm in Southern Tasmania (Australia ) [J]. Aquaculture, 2006,257(s1-4): 194-203.
[34] Bouchet V M P, Sauriau P G. Influence of oyster culture practices and environmental conditions on the ecological status of intertidal mudflats in the Pertuis Charentais (SW France): A multi-index approach[J].Marine Pollution Bulletin, 2008, 56(11): 1989-1912.
[35] Buschmann A H, Lopez D A, Medina A. A review of environmental effects and alternative production strategies of marine aquaculture in Chile[J]. Aquacultural Engineering, 1996, 15(6): 397-421.
[36] 李忠义, 金显仕, 庄志猛, 等. 稳定同位素技术在水域生态系统研究中的应用[J]. 生态学报, 2005, 25(11):3052-3060.
[37] Vizzini S, Mazzola A. Stable isotope evidence for the environmental impact of a land-based fish farm in the western Mediterranean[J]. Marine Pollution Bulletin,2004, 49(1-2): 61-70.
[38] Ye L X, Ritz D A, Fenton G E, et a1. Tracing the influence on sediments of organic waste from a salmon farm using stable isotope analysis[J]. Journal of Experimental Marine Biology and Ecology, 1999,145(2): 161-174.
[39] Yamada Y, Yokoyama H, Ishihi Y, et a1. Historical feeding analysis in fish farming based on carbon and nitrogen stable isotope ratio in sediment[J]. Fish Science, 2003, 69(1): 213-215.
[40] Sará G, Scilipoti D, Mazzola A, et a1. Effects of fish farming waste to sedimentary and particulate organic matter in a southern Mediterranean area(Gulf of Castellammare, Sicily): A multiple stable isotope study[J]. Aquaculture, 2004, 234(s1-4): 199-213.
[41] Yokoyama H, Abo K, Ishihi Y. Quantifying aquaculture-derived organic matter in the sediment in and around a coastal fish farm using stable carbon and nitrogen isotope ratios[J]. Aquaculture, 2006, 254(s1-4):411-425.
[42] Phillips D L. Mixing models in analyses of diet using multiple stable isotopes: a critique[J]. Oecologia, 2001,127(2): 166-170.
[43] Jiang Z J, Wang G H, Fang J G, et al. Growth and food sources of Pacific oyster Crassortrea gigas intergrated culture with Sea bass Lateolabrax japonicus in Ailian Bay[J]. China Aquaculture International, 2013, 22(1):45-52.
[44] 蒋增杰, 方建光, 毛玉泽, 等.海水鱼类网箱养殖水域沉积物有机质的来源甄别[J]. 中国水产科学, 2012.19(2): 348-354.
[45] Silveret W, Cromey C J. Environmental impact of aquaculture[M]. London: Shefield Academic Press, 2001.
[46] Ali A, Thiem Ø, Berntsen J. Numerical modeling of organic waste dispersion from fjord located fish farms[J]. Ocean Dynamics, 2011, 61(7): 977-989.
[47] Zhang J, Ren L, Wu W, et al. Production and sinking rates for bio-deposits of abalone (Haliotis discus hannai Ino)[J]. Aquaculture Research, 2014, 45(12):2041-2047.

