啤酒花多酚提取物体内外抗氧化活性研究
路 欣,杨小兰
(山西大学生命科学学院,山西 太原 030006)
啤酒花多酚提取物体内外抗氧化活性研究
路 欣,杨小兰*
(山西大学生命科学学院,山西 太原 030006)
从酿造废酒花(Humulus lupulus L.)中提取制备一种高纯度(总多酚含量为88.7%)的酒花多酚提取物(hop polyphenol extract,HPE),测定其酚类组成成分与体内外抗氧化活性。结果表明:HPE中55%以上的多酚物质是原花青素,28%以上的多酚物质是黄酮苷类。在体外,HPE能有效清除活性氧自由基,显著抑制Cu2+-VC诱导的DNA氧化断裂损伤。在体内,口服200~800 mg/kg(以体质量计)多酚剂量的HPE可显著抑制因溴代苯诱导的小鼠肝脏超氧化物歧化酶和谷胱甘肽过氧化物酶活性的降低,也可降低溴代苯氧化应激小鼠肝脏的硫代巴比妥酸产物含量。结论:膳食摄入HPE可提供体内外抗氧化损伤的保护作用,酒花多酚的体内外抗氧 化效果均优于同质量浓度的绿茶多酚。
酒花多酚;原花青素;黄酮苷;抗氧化活性;小鼠;DNA;茶多酚
酒花(Humulus lupulus L.)是桑科葎草属雌雄异株的多年生草本植物,酒花作为药用植物有悠久的历史,中国药典记载酒花的乙醇浸膏可用于治疗肺结核病和麻风病等症[1-2],在欧洲,酒花早已用于镇静和治疗失眠等[3]。酒花用于酿造啤酒的历史已有500余年[4],其酿造有效成分主要是苦味酸和酒花油,可给啤酒提供独特的苦味、香气和抑菌能力[5],超临界CO2可实现对这些成分的有效萃取,萃取的酒花浸膏直接用于啤酒酿造。但是酒花中含有4%~14%的多酚[6],由于其为极性物质,大部分不能被超临界CO2萃取出来,本课题组已有的分析研究表明有80%以上的多酚残留在酒花萃余物中[7],这些萃余物被认为是啤酒酿造工业的废料(废酒花),对它的再利用引起了研究者的关注,罗正明[7]和Yamamoto[8-9]等研究了从废酒花中提取多酚的方法。
酒花多酚与绿茶或葡萄多酚一样是很有前途的功能性成分,酒花多酚粗提物有抑菌[10-12]、抗炎[13-17]等作用。Nagasako-Akazome等[4]对一种酒花多酚提取物(总多酚含量79.2%)的安全性进行了评价,结果表明,膳食酒花多酚是安全的。Tagashira等[18]报道了酒花多酚粗提取物(总多酚含量12%~40%)对变形链球菌引起的龋齿的抑制作用优于相同多酚含量的茶多酚。本课题组先前的研究发现酒花多酚粗提物在体外能有效清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基[19],但是,酒花多酚在动物体内的抗氧化效果到目前为止还没有被估测过。评价在化学或生物体外系统的抗氧化活性不能代表真正的体内活性,酒花多酚的抗氧化 活性可能会被在体内的生物利用度和生物转化率所影响。另外,先前的酒花多酚粗提物是一个复杂的混合物体系,含有苦味酸、酒花油和多酚(总多酚含量约20%)等多种成分,酒花多酚的抗氧化贡献还不清楚。因此,本研究从废酒花中提取制备一种高纯度(总多酚含量为88.7%)酒花多酚提取物(hop polyphenol extract,HPE),测定HPE的酚类组成成分,评价HPE在体内外的抗氧化活性,同时与绿茶多酚的抗氧化效果进行对比,以期为酒花多酚的开发应用提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
昆明种小鼠,体质量18~22 g,购自山西医科大学实验动物中心。
废酒花(超临界CO2萃取后的萃余物) 本实验室制备[7]。
绿茶多酚提取物(tea polyphenol extract,TPE,总多酚含量90%) 江西绿康天然产物有限责任公司;原花青素(95%) 天津尖峰天然产物公司;高效液相色谱(high performance liquid chromatography,HPLC)测定的标准品(芦丁(94%)、金丝桃苷(97%)、异槲皮苷(90%)、紫云英苷(97%)、黄腐酚(98%))、Folin-酚试剂、小牛胸腺DNA、琼脂糖、DPPH 美国Sigma公司;超氧阴离子自由基(O2-·)测定试剂盒、硫代巴比妥酸反应物(thiobarbituric acid reactive substance assay,TBARS)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒南京建成生物有限公司;SP850大孔吸附树脂 日本三菱公司。
1.2 方法
1.2.1 HPE的制备
参照罗正明[7]的方法,废酒花用60%乙醇溶液超声波提取,60 ℃条件下提取30 min,重复提取两次,合并提取液,5 000×g离心5 min,真空蒸发乙醇,得到的浓缩液通过SP850大孔吸附树脂层析柱(20 cm×100 cm)进行多酚的分离纯化,先用5 倍柱体积的蒸馏水洗杂质,再用4 倍柱体积的60%乙醇溶液洗脱多酚,接收洗脱液,真空蒸发溶剂,经冷冻干燥得到浅棕色的HPE粉末。
1.2.2 HPE酚类成分的分析
1.2.2.1 总多酚和原花青素含量的测定
总多酚的测定采用Folin-酚法[20],以没食子酸作为标准。原花青素含量的测定采用正丁醇-盐酸法[21],6 mL正丁醇-盐酸溶液(95∶5,V/V)、0.2 mL硫酸铁铵溶液和1 mL HPE或TPE(1 mg/mL)混合,沸水浴加热40 min后,立即置冰水冷浴,然后于546 nm波长处测定吸光度,以原花青素标准品做标准曲线,由标准曲线计算样品中的原花青素含量/(mg/g)。进行3 次样品重复实验。
1.2.2.2 黄酮类物质的HPLC分析
称取2.5 mg HPE或TPE,用甲醇定容至50 mL,经0.45 μm滤膜过滤后,参照文献[22]的方法,测定芦丁、金丝桃苷、紫云英苷和异槲皮苷4 个黄酮苷成分。色谱条件:色谱柱:Symmetry C18(4.6 mm×150 mm,5 μm);流动相:3%乙酸溶液(A)和乙腈(B);流动相梯度洗脱程序:0~10 min,95%~80% A,5%~20% B;10~20 min,80%~65% A,20%~35% B;20~40 min,65% A,35% B;检测波长分别为280、360 nm,进样量10 μL,流速为1 mL/min,色谱柱温为25 ℃。检测器为2487双波长紫外检测器,Breeze软件操作系统。
参照文献[7]的方法测定黄腐酚,色谱条件:色谱柱:Symmetry C18(4.6 mm×150 mm,5 μm);流动相:乙腈(A)和1%冰醋酸溶液(B);洗脱程序:0~20 min,50%~80% A,50%~20% B;20~30 min,80% A,20%~0% B;检测波长370 nm,进样体积20 μL,流速1 mL/min,色谱柱温为25 ℃。用保留时间对样品中的化合物定性,采用外标法定量。
1.2.3 体外抗氧化活性的测定
1.2.3.1 DPPH自由基清除力的测定
DPPH自由基清除力的测定参考Ślusarczyk等[23]的方法,5 mL 2.0×10-4mol/L DPPH乙醇溶液与5 mL不同多酚质量浓度(0~0.05 mg/mL)的HPE样品溶液室温下反应30 min,517 nm波长处测定吸光度,其中每个质量浓度做3 个平行,以TPE和VC为阳性对照。按照公式(1)计算DPPH自由基清除率。
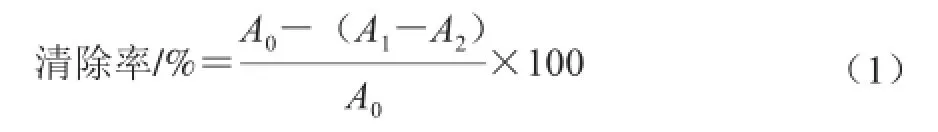
式中:A0为DPPH自由基溶液不加样品液的吸光度;A1为DPPH自由基溶液加样品液的吸光度;A2为样品液在测定波长处的吸光度。
1.2.3.2 羟自由基(•OH)清除力的测定
•OH清除力的测定参考Smirnoff等[24]的方法,10 mL试管中依次加入2 mL不同多酚质量浓度(0~0.2 mg/mL)的HPE样品溶液、0.6 mL 8.0 mmol/L FeSO4溶液、2 mL 3.0 mmol/L水杨酸和0.5 mL 0.02 mol/L H2O2,于37 ℃条件下水浴1 h,于510 nm波长处测定样品吸光度(A1),以蒸馏水代替样品得空白对照吸光度(A0),以蒸馏水代替水杨酸得样品本底吸光度(A2),其中每个质量浓度做3 个平行,以TPE和VC作为阳性对照,按照公式(2)计算•OH清除率。
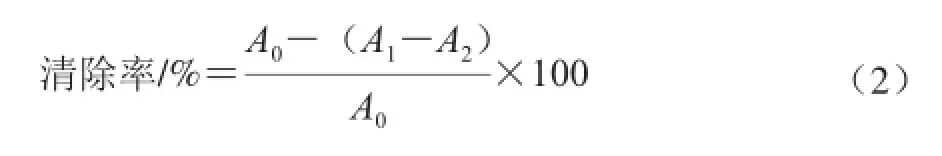
采用试剂盒测定不同多酚质量浓度(0~8 mg/mL)的HPE样品溶液对清除力,参照试剂盒说明书进行。其中每个质量浓度做3 个平行,并以TPE和VC作为对照。
1.2.3.4 凝胶电泳测定DNA氧化断裂
HPE对DNA氧化断裂的影响通过凝胶电泳方法测定,参照文献[25]的方法并略加修改,DNA溶液(0.5 mg/mL)中加或不加HPE(0、0.1、0.2、0.3 mg/mL),培养在含有0.1 mmol/L CuSO4和10 mmol/L VC的Tris缓冲液(10 mmol/L,pH 7.0)中,终反应液体积为1 mL,37 ℃条件下反应1.5 h;另外,DNA再单独培养在Tris缓冲液中反应1.5 h。样品分析采用1%的琼脂糖凝胶,在1×TAE缓冲液(pH 8.5)中进行电泳,电压100 V,室温下电泳30 min后,溴化乙锭染色5 min,凝胶成像系统拍照。
1.2.4 体内抗氧化实验
昆明种小鼠饲养在可控温度和湿度的环境中,自由摄取球状的标准食物和水。适应喂养一周后,小鼠随机分为6 组,每组8 只。正常对照组(NC组)和溴代苯模型对照组(BBC组)小鼠灌胃0.2 mL蒸馏水,茶多酚组(TPE 400组)小鼠灌胃0.2 mL多酚剂量为400 mg/kg(以体质量计,下同)的TPE,3 个酒花多酚组(HPE 200、HPE 400、HPE 800组)小鼠分别灌胃0.2 mL多酚剂量为200、400、800 mg/kg的HPE,每天1 次,30 d后,小鼠饥饿过夜(空腹12 h),给受试样品1 h后,除NC组之外,其余组灌胃0.47 mg/kg的溴代苯(溶于橄榄油),灌胃剂量为0.2 mL/20 g体质量,NC组小鼠只给予相同剂量的橄榄油[10]。20 h后脱臼处死小鼠,迅速取其肝脏,用冰生理盐水制成质量分数10%的组织匀浆液,然后5 000×g离心15 min,上清液用试剂盒测定肝脏中TBARS含量/(nmol/mg pro)及SOD和GSH-Px活力/(U/mg pro)。肝脏蛋白质含量测定用Bradford法,牛血清白蛋白作为标准。
1.3 统计方法
2 结果与分析
2.1 HPE酚类组成成分
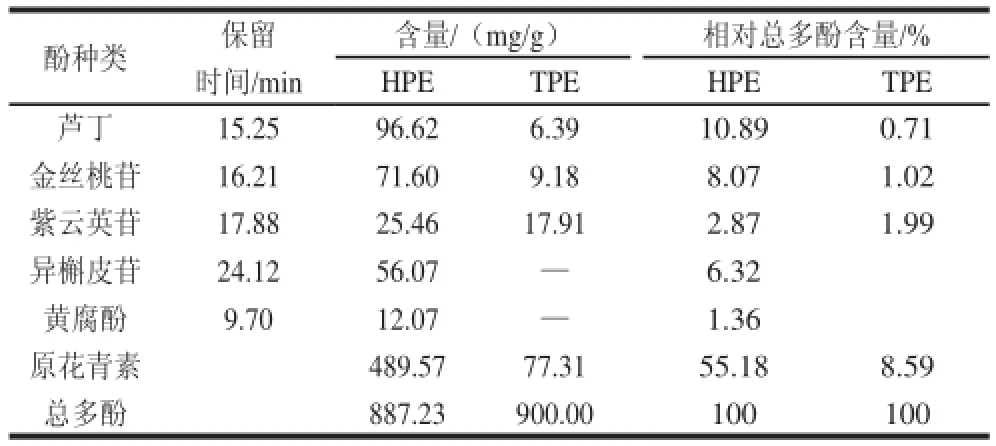
表1 HPE和TPE的酚类组成成分Table 1 Phenolic compositions of HPE and TPE
采用HPLC法鉴定出HPE和TPE中的5 种单酚成分(表1),HPE中含量最高是芦丁(96.62 mg/g),其后依次为金丝桃苷、异槲皮苷、紫云英苷、黄腐酚。HPE的总多酚含量为887.23 mg/g,原花青素含量为489.57 mg/g,占酒花总多酚的55.18%,检出的4 种黄酮苷类物质(芦丁、金丝桃苷、紫云英苷和异槲皮苷)含量总和为249.75 mg/g,占酒花总多酚的28.15%。TPE的总多酚含量为900.00 mg/g,原花青素含量为77.31 mg/g,占绿茶总多酚的8.59%,只检出芦丁、金丝桃苷和紫云英苷3 种黄酮苷类物质,含量总和为33.48 mg/g,占绿茶总多酚的3.72 %。TPE中未检出黄腐酚。
2.2 HPE体外清除自由基的活性
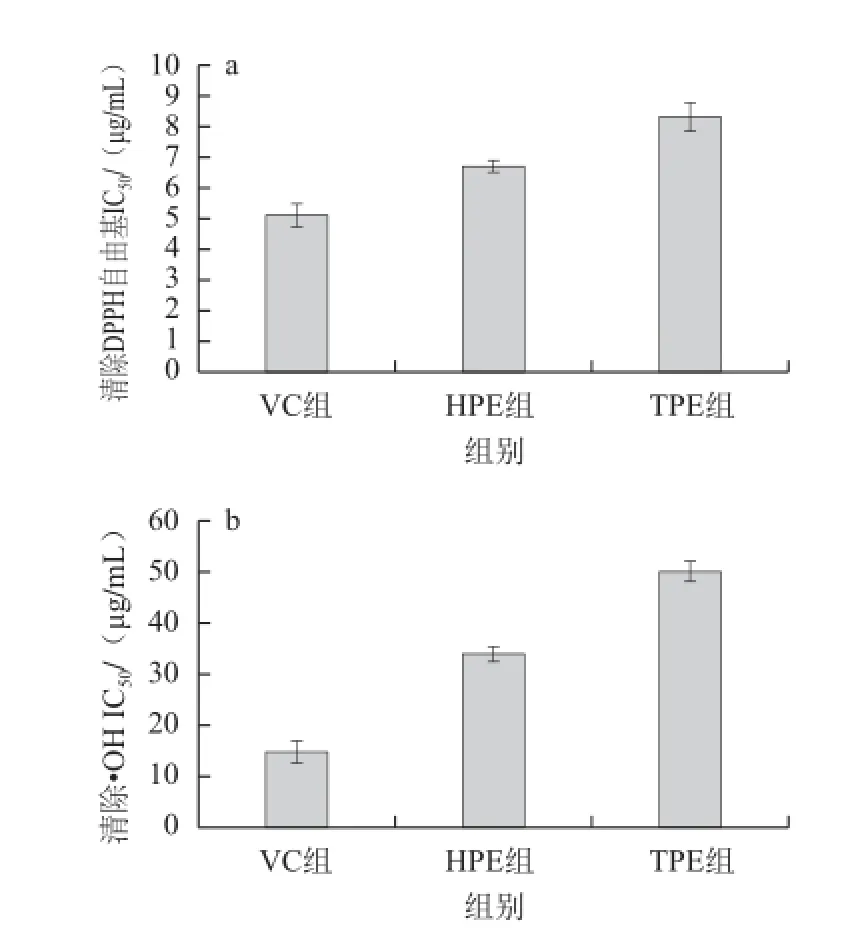
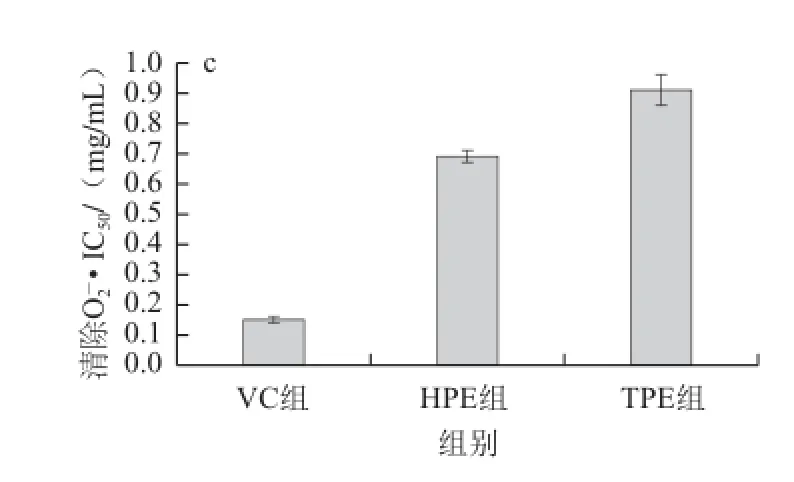
图1 HPE体外清除自由基的能力Fig.1 Free radical scavenging capacity of HPE in vitro
IC50值是对自由基的清除率达50%时所需的样品有效剂量,如图1所示,HPE清除DPPH自由基、•OH和O2-·的IC50值分别为0.006 7、0.034、0.69 mg/mL(以总多酚含量计,下同),均小于TPE清除DPPH自由基、•OH和O2-·的IC50值(分别为0.008 3、0.050、0.91 mg/mL)。
2.3 HPE对DNA氧化损伤的影响
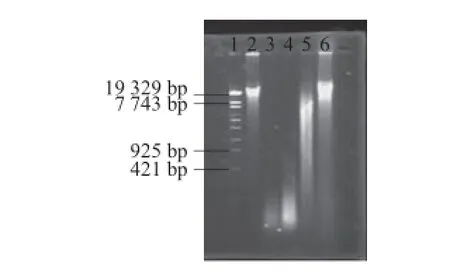
图2 HPE抑制DNA损伤的凝胶电泳图Fig.2 Gel electrophoresis image showing the inhibitory effects of HPE on DNA damage
HPE对Cu2+-VC诱导的DNA氧化断裂的影响如图2所示。未经氧化处理的DNA(泳道2)分子质量主要集中在20 000 bp以上,经Cu2+-VC氧化处理的DNA分子全部断裂成为分子质量小于1 000 bp的片段(泳道3),在DNA的氧化损伤体系中添加不同质量浓度(0.1、0.2、0.3 mg/mL)的HPE后,DNA的氧化断裂程度均有明显减轻,而且随着HPE质量浓度的增大,对DNA保护作用逐渐增强,呈现剂量依赖效应(泳道4~6)。
2.4 HPE的体内抗氧化活性

表2 HPE和TPE对溴代苯氧化应激小鼠肝脏TBARS含量及SOD和GSH-Px活力的影响Table 2 Effects of HPE and TPE on TBARS, SOD, and GSH-Px in mouse livers
如表2所示,与NC组相比,BBC组小鼠肝脏TBARS含量显著增加,SOD和GSH-Px活力均显著降低,表明溴代苯诱导氧化损伤小鼠模型成功。与BBC组比较,3 个酒花多酚剂量组(HPE 200、HPE 400、HPE 800组)小鼠肝脏TBARS含量均显著降低,分别降低了46.1%、61.7%和63.4%,SOD活力分别显著增加了34.7%、40.7%和46.6%,GSH-Px活力显著增加了33.1%、66.5% 和69.8%;与BBC组比较,茶多酚组(TPE 400组)小鼠肝脏TBARS含量显著降低了60.1%,SOD和GSH-Px活力分别显著增加了31.0%和36.0%。与HPE 200组相比,HPE 400组小鼠肝脏TBARS含量显著降低,GSH-Px活力显著升高;与HPE 400组相比,HPE 800组小鼠的肝脏TBARS含量、SOD和GSH-Px活力均没有显著差异;与TPE 400组相比,HPE 400组小鼠肝脏GSH-Px活力显著升高。
3 讨 论
Nagasako-Akazome等[4]研究制备的一种酒花多酚提取物总多酚含量为79.2%,其中48%以上多酚物质是原花青素。与此相近,本研究采用60%乙醇提取废酒花,再通过SP850树脂纯化分离,制备的HPE多酚含量为88.72%,其中55%以上的多酚物质是原花青素。
茶多酚(TPE)是公认的抗氧化剂[26],本研究选取TPE作为阳性对照与HPE的抗氧化活性进行比较。实验结果显示,HPE在体外表现出比TPE更强的对DPPH自由基、•OH和O2-·清除力(图1)。这可能与HPE比TPE含有更多的原花青素和黄酮苷等组分有关(表1)。据报道,茶多酚的主体成分为儿茶素类化合物,约占茶多酚总量的80%,其中以表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)的含量为最高,占茶多酚总量的50%以上[27]。而本研究结果表明HPE的主体成分为原花青素和黄酮苷类物质,其含量分别占酒花多酚总量的55%和28%,远高于TPE中的原花青素含量(8.6%)和黄酮苷类含量(3.7%)。原花青素具有超强的自由基清除力和抗氧化能力[28-29],有研究报道原花青素比儿茶素等具有更强的抗氧化能力[30],在Fe2+诱导的磷脂脂质过氧化反应模型中,原花青素的抗氧化活性(IC50为2.5 μmol/L)比儿茶素(IC50为50 μmol/L)大一个数量级[31]。黄酮的抗氧化活性与结构特征有关,当B环的邻二羟基存在,或具有2,3-双键或4-酮基结构的黄酮有更强的抗氧化活性,例如Wolfe等[32]的研究结果显示,含有2,3-双键和4-酮基结构的芦丁和异槲皮苷在体外的抗氧化能力指数分别是不含有2,3-双键和4-酮基结构的EGCG的3 倍和1.8 倍。HPE中的芦丁(96.62 mg/g)和异槲皮苷(56.07 mg/g)含量远高于TPE中的芦丁(6.39 mg/g)和异槲皮苷(未检出)含量(表1)。HPE中还含有TPE中不具有的黄腐酚(12.07 mg/g),已有研究证实它也是高活性的自由基清除剂[33]。
DNA是生物细胞主要遗传物质,活性氧(reactive oxygen species,ROS)可以破坏DNA的分子结构,导致碱基突变,单、双链断裂,DNA交联以及染色体断裂和重排[19,34]。许多研究表明,用DNA碱基对的裂解作为评价清除ROS的体外抗氧化能力是有效可行的[35],•OH和DNA链的反应使DNA链断裂的现象可以通过电泳实验进行观察。本研究的结果显示,不同剂量的酒花多酚能够抑制DNA的氧化断裂损伤,0.3 mg/mL酒花多酚能够使DNA保持正常。酒花多酚抑制DNA氧化损伤可能是由于其显著的自由基清除活性或消除Cu2+的作用。
溴代苯是一种有毒的化学物,在肝脏中溴代苯可被细胞色素P450单氧酶水解,形成高度肝毒性的代谢产物——环氧化物中间体溴苯-3,4-氧化物[36],它能结合和消耗GSH,使细胞失去对ROS和外源物代谢的抵抗能力,从而导致细胞脂质过氧化损伤[37]。在本研究中观察到溴代苯作用于小鼠后,其肝脏的TBARS含量显著升高(BBC组)(表2),表明溴代苯使小鼠肝脏发生了显著的脂质过氧化。HPE和TPE可有效防止这些变化。3 个酒花多酚剂量组(HPE 200、HPE 400和HPE 800组)和茶多酚组(TPE 400组)小鼠肝脏的TBARS含量均显著低于BBC组,SOD和GSH-Px活力显著高于BBC组。表明HPE和TPE均能有效拮抗溴代苯对肝细胞的脂质过氧化损伤。在本实验条件下,400 mg/kg剂量的酒花多酚组(HPE 400组)显示了最佳效果。与同剂量的茶多酚组(TPE 400组)相比,HPE 400组小鼠肝脏GSH-Px活力显著高于TPE 400组(P<0.05),提示酒花多酚在动物体内的抗氧化活性优于同剂量的茶多酚,这与体外实验的结果相一致。
综上所述,酒花多酚中富含原花青素、黄酮苷和黄腐酚等组分,可提供体内外的氧化损伤保护作用,酒花多酚具有优于茶多酚的抗氧化效果。
[1] 中国人民共和国卫生部药典委员会. 中华人民共和国药典(一部)[M].北京: 人民卫生出版社, 1977: 541-542.
[2] 栗德林, 中国药物大辞典(上册)[M]. 北京: 中国医药科技出版社, 1999: 868.
[3] KLEIN S, RISTER R, RIGGINS C. The Complete German Commission E monographs: therapeutic guide to herbal medicines[M]. Boston: American Botanical Council, 1998: 147.
[4] NAGASAKO-AKAZOME Y, HONMA D, TAGASHIRA M, et al. Safety evaluation of polyphenols extracted from hop bracts[J]. Food and Chemical Toxicology, 2007, 45(8): 1383-1392.
[5] 顾国贤. 酿造酒工艺学[M]. 北京: 中国轻工业出版社, 1996: 22.
[6] MAGALHÃES P J, VIEIRA J S, GONÇALVES L M, et al. Isolation of phenolic compounds from hop extracts using polyvinylpolypyrrolidone: characterization by high-performance liquid chromatography-diode array detection-electrospray tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217(19): 3258-3268.
[7] 罗正明. 酒花多酚的提取纯化及其降脂抗氧化作用的研究[D]. 太原: 山西大学, 2011.
[8] YAMAMOTO H, NAGANO C, TAKEUCHI F, et al. Extraction of polyphenols in hop bract part discharged from beer breweries[J]. Journal of Chemical Engineering of Japan, 2006, 39(9): 956-962.
[9] YAMAMOTO H, KIMAMURA D, NAGANO C, et al. Separation of polyphenols in hop bract part discharged from beer breweries and their separability evaluation using solubility parameters[J]. Kagaku Kogaku Ronbunshu, 2008, 34(3): 331-338.
[10] YAEGAKI K, TANAKA T, SATO T, et al. Hop polyphenols suppress production of water-insoluble glucan by Streptococcus mutans and dental plaque growth in vivo[J]. The Journal of Clinical Dentistry, 2007, 19(2): 74-78.
[11] SHINADA K, TAGASHIRA M, WATANABE H, et al. Hop bract polyphenols reduced three-day dental plaque regrowth[J]. Journal of Dental Research, 2007, 86(9): 848-851.
[12] YAHIRO K, SHIRASAKA D, TAGASHIRA M, et al. Inhibitory effects of polyphenols on gastric injury by Helicobacter pylori VacA toxin[J]. Helicobacter, 2005, 10(3): 231-239.
[13] KOU Y, INABA H, KATO T, et al. Inflammatory responses of gingival epithelial cells stimulated with Porphyromonas gingivalis vesicles are inhibited by hop-associated polyphenols[J]. Journal of Periodontology, 2008, 79(1): 174-180.
[14] INABA H, TAGASHIRA M, KANDA T, et al. Apple-and hoppolyphenols protect periodontal ligament cells stimulated with enamel matrix derivative from Porphyromonas gingivalis[J]. Journal of Periodontology, 2005, 76(12): 2223-2229.
[15] INABA H, TAGASHIRA M, HONMA D, et al. Identifi cation of hop polyphenolic components which inhibit prostaglandin E2 production by gingival epithelial cells stimulated with periodontal pathogen[J]. Biological and Pharmaceutical Bulletin, 2008, 31(3): 527-530.
[16] CHOI O, YAHIRO K, MORINAGA N, et al. Inhibitory effects of various plant polyphenols on the toxicity of staphylococcal α-toxin[J]. Microbial Pathogenesis, 2007, 42(5): 215-224.
[17] BECKER H, GERHAUSER C, BOHR G. Beer in health and disease prevention[M]. London: Elsevier, 2008: 753-757.
[18] TAGASHIRA M, UCHIYAMA K, YOSHIMURA T, et al. Inhibition by hop bract polyphenols of cellular adherence and water-insoluble glucan synthesis of mutans streptococci[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(2): 332-335.
[19] 杨小兰, 田艳花, 师成滨, 等. 啤酒花多酚的提取工艺及抗氧化活性的研究[J]. 食品科学, 2006, 27(10): 297-302.
[20] MEDA A, LAMIEN C E, ROMITO M, et al. Determination of the total phenolic, fl avonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity[J]. Food Chemistry, 2005, 91(3): 517-577.
[21] 中华人民共和国卫生部. 保健食品检验与评价技术规范(2003年版)[M]. 2003: 274-275.
[22] 李永库, 李晓静, 欧小辉. 固相萃取-高效液相色谱法同时测定葡萄酒中没食子酸等8种多酚类化合物[J]. 食品科学, 2008, 29(4): 283-286.
[23] ŚLUSARCZYK S, HAJNOS M, SKALICKA-WOŹNIAK K, et al. Antioxidant activity of polyphenols from Lycopus lucidus Turcz[J]. Food Chemistry, 2009, 113(1): 134-138.
[24] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060.
[25] RIVERO D, PÉREZ-MAGARIÑO S, GONZÁLEZ-SANJOSÉ M L, et al. Inhibition of induced DNA oxidative damage by beers: correlation with the content of polyphenols and melanoidins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(9): 3637-3642.
[26] JAYASEKERA S, MOLAN A L, GARG M, et al. Variation in antioxidant potential and total polyphenol content of fresh and fullyfermented Sri Lankan tea[J]. Food Chemistry, 2011, 125(2): 536-541.
[27] 陈平, 钟建华, 孙东. 脂溶性茶多酚中的主要活性组分及对人卵巢癌HO-8910细胞株的体外抑制活性[J]. 茶叶科学, 2004, 23(2): 115-118.
[28] 高羽, 董志. 原花青素的药理学研究现状[J]. 中国中药杂志, 2009, 34(6): 651-655.
[29] BORS W, MICHEL C, STETTMAIER K. Electron paramagnetic resonance studies of radical species of proanthocyanidins and gallate esters[J]. Archives of Biochemistry and Biophysics, 2000, 374(2): 347-355.
[30] STEVENS J F, MIRANDA C L, WOLTHERS K R, et al. Identifi cation and in vitro biological activities of hop proanthocyanidins: inhibition of nNOS activity and scavenging of reactive nitrogen species[J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3435-3443.
[31] MAFFEI F R, CARINI M, ALDINI G, et al. Free radicals scavenging action and anti-enzyme activities of procyanidines from Vitis vinifera. A mechanism for their capillary protective action[J]. Arzneimittel-Forschung, 1994, 44(5): 592-601.
[32] WOLFE K L, LIU R H. Structure-activity relationships of fl avonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8404-8411.
[33] YAMAGUCHI N, SATOH-YAMAGUCHI K, ONO M. in vitro evaluation of antibacterial, anticollagenase, and antioxidant activities of hop components (Humulus lupulus) addressing acne vulgaris[J]. Phytomedicine, 2009, 16(4): 369-376.
[34] KROFTA K, MIKYŠKA A, HAŠKOVÁ D. Antioxidant characteristics of hops and hop products[J]. Journal of the Institute of Brewing, 2008, 114(2): 160-166.
[35] ZHANG Jian, SHEN Xun. Antioxidant activities of baicalin, green tea polyphenols and alizarin in vitro and in vivo[J]. Journal of Nutritional & Environmental Medicine, 1997, 7(2): 79-90.
[36] DELMANTO R D, de LIMA P L A, SUGUI M M, et al. Antimutagenic effect of Agaricus blazei Murrill mushroom on the genotoxicity induced by cyclophosphamide[J]. Mutation Research/ Genetic Toxicology and Environmental Mutagenesis, 2001, 496(1): 15-21.
[37] 杨小兰, 田艳花, 师成滨, 等. 啤酒花中黄腐酚的生理活性作用的研究进展[J]. 食品科学, 2007, 28(7): 526-530.
in vitro and in vivo Antioxidant Activities of Polyphenols Extracted from Hops (Humulus lupulus L.)
LU Xin, YANG Xiaolan*
(College of Life Science, Shanxi University, Taiyuan 030006, China)
A high-purity hop polyphenol extract (HPE) (containing 88.7% of total phenolics) was prepared from spent hops in the present study. The phenolic compositions of HPE were determined and its in vivo and in vitro antioxidant activities were evaluated by comparison with those of green tea polyphenols. The results showed that the phenolic compositions of HPE included more than 55% proanthocyanidins and more than 28% fl avonoid glycosides. in vitro, HPE effectively scavenged reactive oxygen species and inhibited Cu2+vitamin C-induced oxidative DNA damage. in vivo, orally administered HPE at polyphenol doses of 200 to 800 mg/kg body weight signifi cantly prevented a bromobenzene-induced decrease in hepatic sup eroxide dismutase and glutathione peroxidase activity, and decreased the levels of hepatic thiobarbituric acid reactive substance in bromobenzene-treated mice. HPE at the oral doses of 200 to 800 mg/kg body weight signifi cantly reduced the frequency of bone marrow micronuclei induced by cyclophosphamide. These results suggest that dietary hop polyphenols could provide protection from oxidative mutagenic in vivo and in vitro damage. The in vivo and in vitro antioxidant activities of hop polyphenols were higher than those of green tea polyphenols at the same concentration.
hop polyphenol; proanthocyanidins; fl avonoid glycosides; antioxidant activity; mice; DNA; tea polyphenols
TS201.1
A
1002-6630(2015)01-0013-06
10.7506/spkx1002-6630-201501003
2014-03-10
国家自然科学基金面上项目(31171748);山西省科技攻关项目(20090321097)
路欣(1988—),女,硕士,研究方向为食品生物技术。E-mail:luxin081@126.com
*通信作者:杨小兰(1956—),女,教授,本科,研究方向为食品生物技术。E-mail:13934214833@163.com

