口服精胺促进哺乳仔猪肠道发育机制的初探
廖国周,樊月圆,王桂瑛,苏子峰,王雪峰,毕保良, 潘洪彬,4,赵平,黄丽梅,程志斌,4*
(1.云南农业大学,昆明 650201;2.云南省畜产品加工工程技术研究中心,昆明 650201;3.大理学院农学与生物科学学院,云南大理 671003;4.云南省动物营养与饲料科学重点实验室,昆明 650201)
口服精胺促进哺乳仔猪肠道发育机制的初探
廖国周1,2,樊月圆1,王桂瑛2,苏子峰3,王雪峰2,毕保良1, 潘洪彬1,4,赵平1,黄丽梅1,程志斌1,4*
(1.云南农业大学,昆明650201;2.云南省畜产品加工工程技术研究中心,昆明650201;3.大理学院农学与生物科学学院,云南大理671003;4.云南省动物营养与饲料科学重点实验室,昆明650201)
试验通过血浆皮质醇抑制模型初步探索精胺促进哺乳仔猪肠道发育的机制。选取来自6窝的11日龄哺乳仔猪24头进行试验。试验采用随机区组设计,以窝别为区组,每头仔猪为试验重复,将同窝选取的4头试验仔猪随机分配到4个处理组。处理1组猪只口服生理盐水和注射生理盐水;处理2组口服精胺0.4 mmol·kg-1BW·d-1和注射生理盐水;处理3组口服生理盐水和肌肉注射甲双吡丙酮5 mg·kg-1BW·d-1;处理4组注射甲双吡丙酮5 mg·kg-1BW·d-1和口服精胺0.4 mmol·kg-1BW·d-1。试验结果表明,成功建立血浆皮质醇模型;处理1~4组仔猪空肠黏膜麦芽糖酶比活力分别为118.5、195.3、88.3和144.2 U·g-1蛋白质。处理2组麦芽糖酶比活力显著高于处理1和4组(P<0.05),极显著高于处理3组(P<0.01);处理1和4组麦芽糖酶比活力差异不显著(P>0.05),但显著高于处理3组(P<0.05)。结果表明,口服精胺通过刺激血浆皮质醇的分泌促进了幼龄仔猪肠道发育。
精胺;哺乳仔猪;肠道发育;初探
精胺存在于所有真核细胞和原核细胞中,在哺乳动物细胞的增殖、增生和分化等生物过程中有重要生理作用,尤其是对幼龄哺乳动物的小肠黏膜上皮细胞等快速增殖和分化起到重要作用[1]。大量研究及试验表明,口服精胺具有促进幼龄仔猪肠道发育的作用,在养猪生产中具有巨大的应用潜能[2-8]。然而,精胺促进幼龄仔猪肠道发育的机制尚不明确。本试验设计皮质醇抑制模型,初步探索精胺促进哺乳仔猪肠道发育和成熟的机理。
1 材料与方法
1.1试验动物
试验选取6头“长白×大白”妊娠母猪所产的6窝哺乳仔猪进行试验。仔猪出生后6 h,每头母猪窝产仔数统一为10头。0 d定义为第1头仔猪出生日,仔猪0~10 d维持正常的哺乳。哺乳11 d的早晨7:00~7:30,每窝选取6头,体重最相近、健康状况良好的仔猪共24头(初始体重3.58±0.05 kg)进行试验。
1.2精胺与甲双吡丙酮
精胺为Sigma公司产品,精胺由0.9%生理盐水配制成浓度50 μmol·mL-1的溶液。甲双吡丙酮用生理盐水配制成浓度10 mg·mL-1的溶液。
1.3饲粮组成
母猪的哺乳日粮按NRC(1998)营养推荐量配制玉米-豆粕型粉料,日粮组成和营养水平见附表。
1.4饲养管理
哺乳母猪采用单栏饲喂管理,栏圈面积为1.5× 2.1 m2,采用乳头式饮水器自由饮水,哺乳日粮不限饲,饲喂时间为每天8:00和17:00。产仔舍的温度控制在22±2℃,仔猪保温箱通过加热灯维持温度32±2℃,产仔舍保持24 h光照。专门饲养员管理母猪采食情况,母猪采食后,料槽剩料和抛洒在地面的饲料立即清扫干净,以防止仔猪采食。同时,哺乳全期所有仔猪不提供补料。在3 d的试验期中,试验仔猪和母猪健康状况良好。
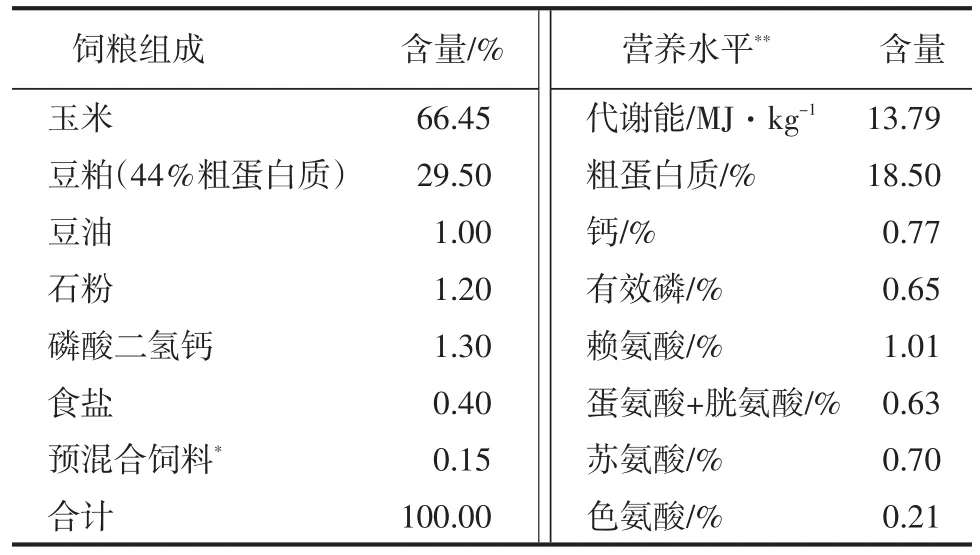
附表哺乳母猪日粮组成及营养水平
1.5试验方法
试验采用随机区组设计,以窝别为区组,将同窝选取的4头试验仔猪随机分配到4个处理组。处理1组口服生理盐水和注射生理盐水;处理2组口服精胺0.4 mmol·kg-1BW·d-1和注射生理盐水;处理3组口服生理盐水和肌肉注射甲双吡丙酮5 mg·kg-1BW·d-1;处理4组注射甲双吡丙酮5 mg·kg-1BW·d-1和口服精胺0.4 mmol·kg-1BW·d-1。根据前期试验结果,试验选取口服精胺0.4 mmol·kg-1BW·d-1[2,4]。
参考Wu等的试验方法,仔猪皮质醇抑制模型的建立方法具体如下,在11~13 d的早晨7:00,试验仔猪肌肉注射甲双吡丙酮5 mg·kg-1BW·d-1,1 次·d-1,持续3 d[7]。13 d早晨7:00,试验操作结束后2 h,所有试验仔猪颈静脉放血致死,采集静脉血样用于分析血浆皮质醇浓度。血样在4℃4 000 rpm离心15 min。采集仔猪空肠20 cm黏膜,分析麦芽糖酶和乳糖酶比活力。
1.6检测方法
血浆皮质醇使用放免法测定,在云南省动物营养与饲料重点实验室完成。二糖酶比活力的测定参考前期报道的方法[2-4]。
1.7统计分析
试验数据采用SPSS 11.0软件进行单因素方差分析,并进行Student-Newman-Keuls多重比较。
2 试验结果
2.1血浆皮质醇浓度
哺乳13 d血浆皮质醇浓度见图1。
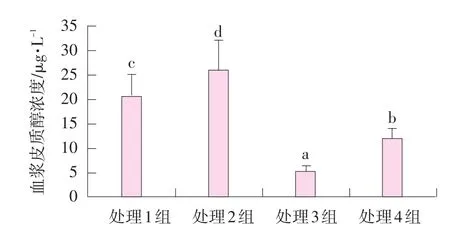
图1 肌肉注射甲双吡丙酮和口服精胺对哺乳仔猪血浆皮质醇浓度的影响
由图1可知,处理1~4组的皮质醇浓度分别为20.5、25.8、5.1、12.1 μg·L-1。注射甲双吡丙酮的处理组3和4仔猪血浆皮质醇浓度极显著低于处理1组(P<0.01);处理2组口服精胺仔猪血浆皮质醇浓度显著高于处理1组(P<0.05);处理4组血浆皮质醇浓度极显著高于处理3组(P<0.01)。
2.2空肠黏膜二糖酶比活力
空肠黏膜麦芽糖酶比活力见图2。
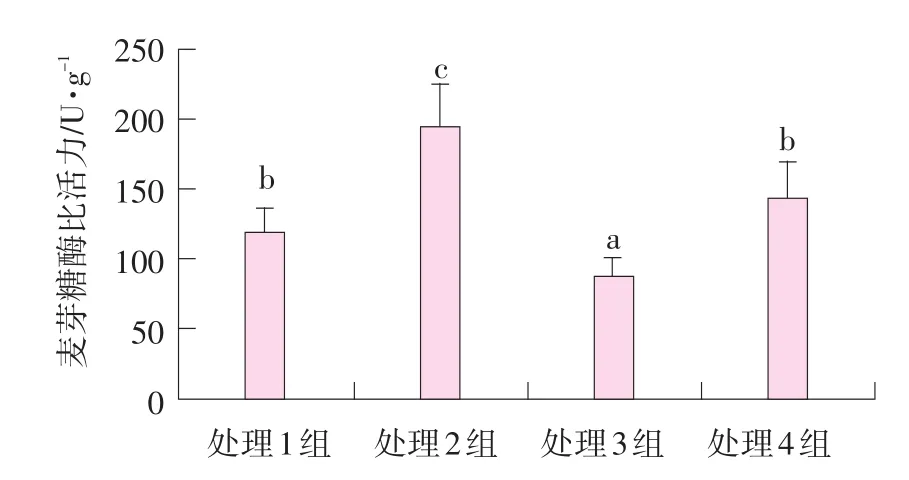
图2 肌肉注射甲双吡丙酮和口服精胺对哺乳仔猪空肠麦芽糖酶比活力的影响
由图2可知,处理1~4组空肠黏膜麦芽糖酶比活力分别为118.5、195.3、88.3、144.2 U·g-1(肠黏膜蛋白)。处理2组仔猪空肠黏膜麦芽糖酶比活力显著高于处理1和4组(P<0.05),极显著高于处理3组(P<0.01);处理1和4组麦芽糖酶比活力显著高于处理组3(P<0.05)。
空肠黏膜乳糖酶比活力见图3。
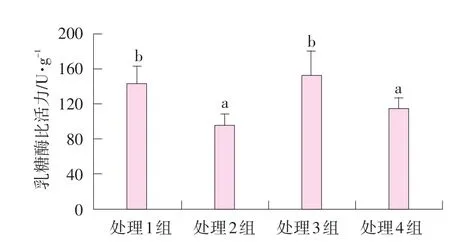
图3 肌肉注射甲双吡丙酮和口服精胺对哺乳仔猪空肠乳糖酶比活力的影响
由图3可知,处理组1~4空肠黏膜乳糖酶比活力分别为143.7、95.8、153.2、115.2 U·g-1(肠黏膜蛋白)。处理1和3组仔猪空肠黏膜乳糖糖酶比活力差异不显著(P>0.05),显著高于处理2和4组(P<0.05),处理2和4组之间差异不显著(P>0.05)。
3 讨论
3.1皮质醇抑制模型的建立
本试验结果表明,注射甲双吡丙酮的处理组3 和4仔猪血浆皮质醇浓度显著低于处理1组(P<0.01),本试验模型与Wu等结果一致[7]。说明本试验成功的建立了皮质醇抑制模型,此模型适合用于研究口服精胺促进哺乳仔猪肠道发育的机制。
处理2组仔猪血浆皮质醇浓度显著高于处理1组(P<0.01),说明口服外源精胺激发了仔猪血浆皮质醇分泌,这与Kaouass等用大鼠试验发现口服精胺提高血浆皮质醇浓度的结果一致,表明精胺可能激发皮质醇,间接促进哺乳仔猪小肠的发育[9]。
同时注射甲双吡丙酮和口服精胺的仔猪(处理4组)血浆皮质醇浓度比处理组3仔猪血浆皮质醇浓度高(P<0.01),但仍然显著低于处理1组(P<0.05)。说明在抑制皮质醇模型下,口服精胺虽然显著提高了仔猪血浆皮质醇浓度,但血浆皮质醇浓度不能恢复到正常哺乳仔猪的水平。
试验结果表明,口服外源精胺有促进哺乳仔猪合成和分泌皮质醇的作用。
3.2口服精胺促进皮质醇对肠道黏膜二糖酶的影响
大量研究表明,小肠黏膜二糖酶比活力是仔猪肠道发育的重要指标之一[2,5]。血浆皮质醇对幼龄大鼠、小鼠和仔猪小肠黏膜麦芽糖酶和蔗糖酶活性有重要的调控作用。处理3组注射皮质醇抑制剂甲双吡丙酮的仔猪空肠黏膜麦芽糖酶比活力显著低于处理1组(P<0.05),说明血浆皮质醇的浓度降低会抑制仔猪空肠黏膜麦芽糖酶比活力。由此可见,血液皮质醇的正常生理浓度对幼龄哺乳动物小肠正常发育是至关重要的。也证明本试验建立的皮质醇抑制模型适合用来研究精胺刺激皮质醇间接促进肠道发育的作用机理。
处理4组仔猪同时口服精胺和注射甲双吡丙酮,空肠黏膜麦芽糖酶比活力极显著高于处理3组(P<0.01),与处理组1差异不显著(P>0.05)。结果表明,在抑制血浆皮质醇模型下,口服精胺使皮质醇抑制仔猪的空肠黏膜麦芽糖酶比活力恢复到正常哺乳仔猪水平,这表明精胺作用空肠上皮细胞,提高麦芽糖酶比活力的直接作用机制。然而,处理4组空肠黏膜麦芽糖酶比活力与处理3组相比显著提高(P<0.05),但仍未达到处理2组麦芽糖酶比活力水平。同样口服精胺,处理4与2组相比,降低的空肠黏膜麦芽糖酶比活力是因为在皮质醇抑制模型下降低了血浆皮质醇浓度,使口服精胺不能完全逆转低水平血浆皮质醇导致的麦芽糖酶比活力降低。由此可见,从黏膜麦芽糖酶比活力数据说明,精胺对小肠发育和成熟的促进效果是通过激发血浆皮质醇分泌实现的。
此外,图3表明,在抑制血浆皮质醇模型下,处理1组(正常皮质醇浓度)和处理3组(抑制皮质醇浓度)空肠乳糖酶比活力差异不显著(P>0.05)。这一结果表明,血浆皮质醇对乳糖酶无调控作用。这与Martin等、Arsenault等、Chapple等的试验结果一致,发现血浆皮质醇浓度不影响乳糖酶比活力[10-12]。Morisset和Henning认为,无论是猪还是大鼠,黏膜乳糖酶酶蛋白合成和乳糖酶比活力表达的调控机制与麦芽糖酶不同,血浆皮质醇只能影响麦芽糖酶和蔗糖酶比活力,对黏膜乳糖酶比活力无显著影响(P<0.05)[13-14]。小鼠小肠细胞体外培养试验也证实了这一点[11]。
4 结论
本试验通过皮质醇抑制模型证明口服外源精胺刺激了血浆皮质醇分泌,促进了幼龄仔猪肠道发育,作用体现在小肠麦芽糖酶活性的提高上。
[1]Sabater-Molina M,Larqué E,Torrella F,et al.Effects of dietary polyamines at physiologic doses in early-weaned piglets[J].Nutri⁃tion,2009,25(9):940-946.
[2]姜自琴,廖国周,樊月圆,等.精胺对哺乳仔猪小肠黏膜二糖酶比活力的影响[J].饲料博览,2014(9):1-5.
[3]程志斌,廖启顺,苏子峰.猪乳中多胺浓度的研究进展[J].饲料博览,2010(5):8-11.
[4]程志斌,姜自琴,廖国周,等.口服精胺对哺乳仔猪小肠组织发育的影响[J].饲料工业,2014,35(18):34-37.
[5]何余湧,邹伟,刘晓兰,等.妊娠后期母猪和仔猪补饲外源精胺对初生和28日龄仔猪肠道形态结构及二糖酶活性的影响[J].动物营养学报,2012,24(8):1 429-1 437.
[6]何余湧,邹伟,王仁华,等.饲料中添加精胺对哺乳仔猪血液生化指标及胃肠道发育的影响研究[J].饲料工业,2012,33(9): 14-16.
[7]Wu G,Flynn N E,Knabe D A.Enhanced intestinal synthesis of polyamines from proline in cortisol-treated piglets[J].American Journal of Physiology-Endocrinology and Metabolism,2000,42 (2):395-402.
[8]王猛侯永清丁斌鹰,等.精胺对断奶仔猪肠组织形态的影响[J].动物营养学报,2007,19(4):366-371.
[9]Kaouass M,Sulon J,Deloyer P,et al.Spermine-induced preco⁃cious intestinal maturation in suckling rats:possible involvement of glucocorticoids[J].Journal of Endocrinology,1994,141(2):279-283.
[10]Martin G R,Henning S J.Relative importance of corticosterone and thyroxine in the postnatal development of sucrase and malt⁃ase in rat small intestine[J].Endocrinology,1982,111(3):912-918.
[11]Arsenault P,Ménard D.Comparative study of the effect of hydro⁃cortisone and thyroxine on suckling mouse small intestine in or⁃gan culture[J].Comparative Biochemistry and Physiology Part A: Physiology,1984,77(4):721-725.
[12]Chapple R P,Cuaron J A,Easter R A.Effect of glucocorticoids and limiting nursing on the carbohydrate digestive capacity and growth rate of piglets[J].Journal of Animal Science,1989,67 (11):2 956-2 973.
[13]Morisset J.Regulation of growth and development of the gastroin⁃testinal tract[J].Journal of Dairy Science,1993,76(7):2 080-2 093.
[14]Henning S J.Postnatal development:coordination of feeding,di⁃gestion,and metabolism[J].American Journal of Physiology-Gas⁃trointestinal and Liver Physiology,1981,241(3):199-214.
Primary Studies of Orally Administered Spermine on the Intestinal Development in Suckling Piglets
LIAO Guozhou1,2,FAN Yueyuan1,WANG Guiying2,SU Zifeng3,WANG Xuefeng2, BI Baoliang1,PAN Hongbin1,4,ZHAO Ping1,HUANG Limei1,CHENG Zhibin1,4*
(1.Yunnan Agricultural University,Kunming 650201,China; 2.Livestock Product Processing Engineering and Technology Research Center of Yunnan Province,Kunming 650201,China; 3.Department of Agriculture and Biological Science of Dali College,Dali 671003,Yunnan China; 4.Key Laboratory of Animal Nutrition and Feed Science of Yunnan Province,Kunming 650201,China)
The plasma cortisol inhibition model was established to primary studies of orally administered spermine on the intestinal development in suckling piglets.For three consecutive days,24 suckling piglets at 11 days of age were randomly assigned within litter to four groups with six animals each group and-1BW·d-1spermine and intramuscular injection of physiological saline), group 3(orally administered physiological saline and intramuscular injection of 5 mg·kg-1BW·d-1metyrapone),or group 4(orally administered 0.4 mmol·kg-1BW·d-1spermine and-1BW·d-1metyrapone).The data of plasma cortisol concentration showed that the cortisol inhibition model was suc⁃cessful in this study.The jejunum maltase specific activities of pigs were 118.5,195.3,88.3,144.2 U·g-1protein. The maltase specific activities of group 1 and 4 were identical,and were higher than that of group 3(P<0.01),and were lower than that of group 2(P<0.05).Collectively,the results showed that orally administered spermine induced young piglet intestinal maturation by stimulating the release of cortisol in plasma.
the intramuscular injection of 5 mg·kg
following treatments,group 1(orally administered physiological saline and intramuscular injection of physiological saline), group 2(orally administered 0.4 mmol·kg
spermine;suckling piglets;intestinal development;primary studies
S828;S852.21
A
1001-0084(2015)12-0001-04
2015-10-23
国家自然科学基金(31201830);云南省应用基础研究计划项目(2011FB054)
廖国周(1978-),男,广东江门人,博士,副教授,研究方向为动物营养与畜产品科学。
副教授,E-mail:179783349@163.com。

