屎肠球菌冷冻干燥保护剂的组成优化
索江华, 杨 森, 乔宏兴
(1.河南牧业经济学院生物工程系,河南郑州 450046;2.河南农业大学生命科学学院,河南郑州 450046)
屎肠球菌是乳酸菌类益生菌的一种,能调整单胃动物肠道菌群,抑制肠道内致病菌的过度繁殖。其作为微生态制剂可单独使用或与其他益生菌复配,用于调节动物肠道菌群,提高免疫力及改善生长性能(容庭等,2008;文静等,2001)。
乳酸菌冻干发酵剂是将乳酸菌和冻干保护剂一起进行真空冷冻干燥得到的具有体积小、含菌量高、活力强、用量少、污染低、便丁运输、保藏,使用方便等优点的制剂。为了提高微生物真空冷冻干燥后细胞的成活率及稳定性,常在冷冻时加入各种保护剂,保护剂包括蛋白质类、多糖类、小分子糖类、醇类和维生素类,其中被广泛认可的保护剂主要成分包括脱脂乳、蔗糖、海藻糖等。保护剂具有两个作用,一是作为支持物和受体在复水过程中为干物质提供一定的骨架结构;二是冷冻干燥过程中保护活细胞。冻干保护剂可以有效地减少环境对菌体细胞的伤害,所以对其冷冻干燥保护剂的筛选和研究具有重要意义。
1 材料与方法
1.1 材料
1.1.1 菌种 屎肠球菌 (Enterococcus Faecium),购于中国工业微生物菌种保藏中心,菌种编号CICC 21067。
1.1.2 试剂与仪器 甘油,购自上海国药集团,分析纯;脱脂奶粉(完达山);蔗糖,购自上海国药集团,分析纯;无菌水,自制。培养箱、pH计、离心机、光学显微镜、超净工作台、-80℃冰箱 (DW-86L388A)、真空冷冻干燥机(北京博医康实验仪器 FD-1B-50)。
1.1.3 培养基 MRS培养基:蛋白胨10 g,牛肉膏 10 g,酵母膏 5 g,葡萄糖 20 g,吐温- 801 mL,乙酸钠 5 g,柠檬酸铵2 g,磷酸氢二钾2 g,无水磷酸镁0.2 g,硫酸锰0.05 g,琼脂20 g,蒸馏水定容至1000 mL。
1.2 方法
1.2.1 菌种活化和扩培 取屎肠球菌冻存管1支,在MRS平板上划线,37℃培养36~48 h,挑取单菌落接种于5 mL液体MRS培养基中,37℃静置培养24 h后,菌种以5%的接种量接种于MRS液体培养基中37℃下培养18~22 h,镜检无杂菌后,等量分装9 mL于无菌离心管中,4000 r/min离心15 min,弃上清液收集菌体。革兰氏染色,显微镜下观察细菌。
1.2.2 单因素试验及正交试验设计 将灭菌后的甘油、脱脂乳、蔗糖分别按照表1的配比组合溶于100 mL蒸馏水中备用。
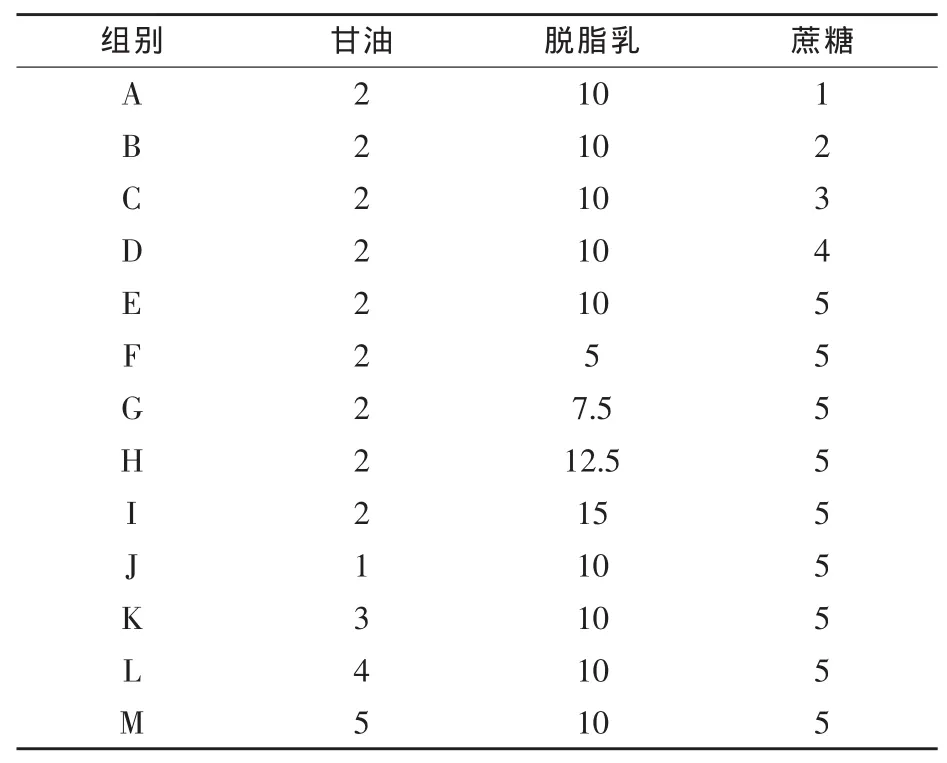
表1 单因素试验设计配比组合试验表%
基于单因素试验结果,选取甘油、脱脂乳、蔗糖水平分别为:甘油1%、1.5%、2%,脱脂乳8%、10%、12%,蔗糖 3%、4%、5%,进行三因素三水平正交试验,因素与水平见表2。

表2 正交试验因素与水平
1.2.3 预冻及真空冷冻干燥 将离心所得菌泥样品用灭菌后的保护剂溶液2 mL冲洗到无菌培养皿中,放在-80℃条件下预冻2 h,待样品完全冻结后迅速转移到冷冻干燥机中,根据真空冷冻干燥机说明书和样品量冷冻干燥24 h,即可收获成品。
1.2.4 活菌计数及存活率计算 平板混菌计数法:样品溶解于无菌水中混匀,以10倍梯度进行稀释,取适合的稀释度0.1 mL涂布在MRS培养基上,每个梯度涂布三个样本,37℃培养48 h后,计数菌落数,以菌落平均数计为该样品的单位活菌数。设冷冻干燥前菌泥活菌数为N1(cfu/mL);冷冻干燥后菌粉活菌数N2(cfu/mL)。
细胞冷冻存活率/%=(N2/N1)×100。
2 结果与分析
屎肠球菌在MRS上生长48 h的菌落形态及革兰氏染色结果表明:屎肠球菌在显微镜下形态均一,主要成二联球状,或多连球状,革兰氏染色呈阳性;在MRS培养基上划线培养48 h之后,菌落光滑,呈乳白色突起,具有明显的乳酸菌特征。
2.1 单因素试验 单因素试验最终确定取10-9梯度计数,三个样本取平均值结果如下:A 30,B 41,C 36,D 194,E 145,F 132,G 300,H 39,I 174,J 459,K 98,L 35,M 178。 由此可知,单因素试验中活菌数保留最高的组合是J:甘油1%、脱脂乳10%、蔗糖4%或 5%(图1)。
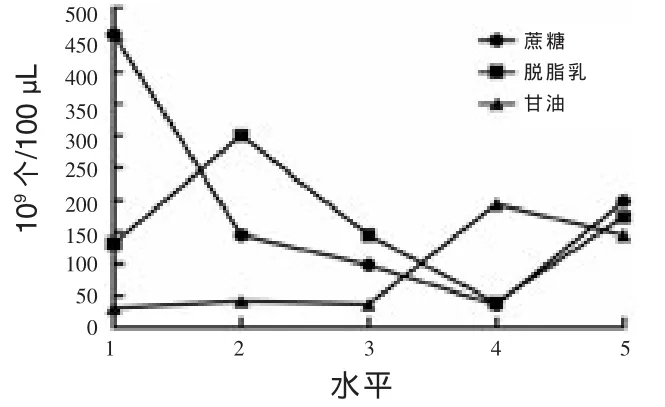
图1 单因素试验数据分析
2.2 正交试验 由表3可知,影响屎肠球菌冻干后存活率的因素主次顺序为C蔗糖>A甘油>B脱脂乳,即蔗糖的效果最明显极差可达到22.534,甘油次之,脱脂乳最小。通过优化冻干保护剂的正交试验结果,可以得到屎肠球菌的最佳冻干保护剂配方为:甘油1.5 mL/100 mL,脱脂乳12 g/100 mL、蔗糖5 g/100 mL。屎肠球菌在使用此保护剂的情况下冻干存活率可以达到93.2%。
表4结果表明,三个因素对菌体存活率影响均不显著,究其原因可能是本试验误差略大且误差自由度小,而且试验因素间存在交互作用,会夸大试验误差,有可能掩盖考察因素的显著性。经正交试验得到的最佳组合为6号试验组的冻干菌体存活率会更高。
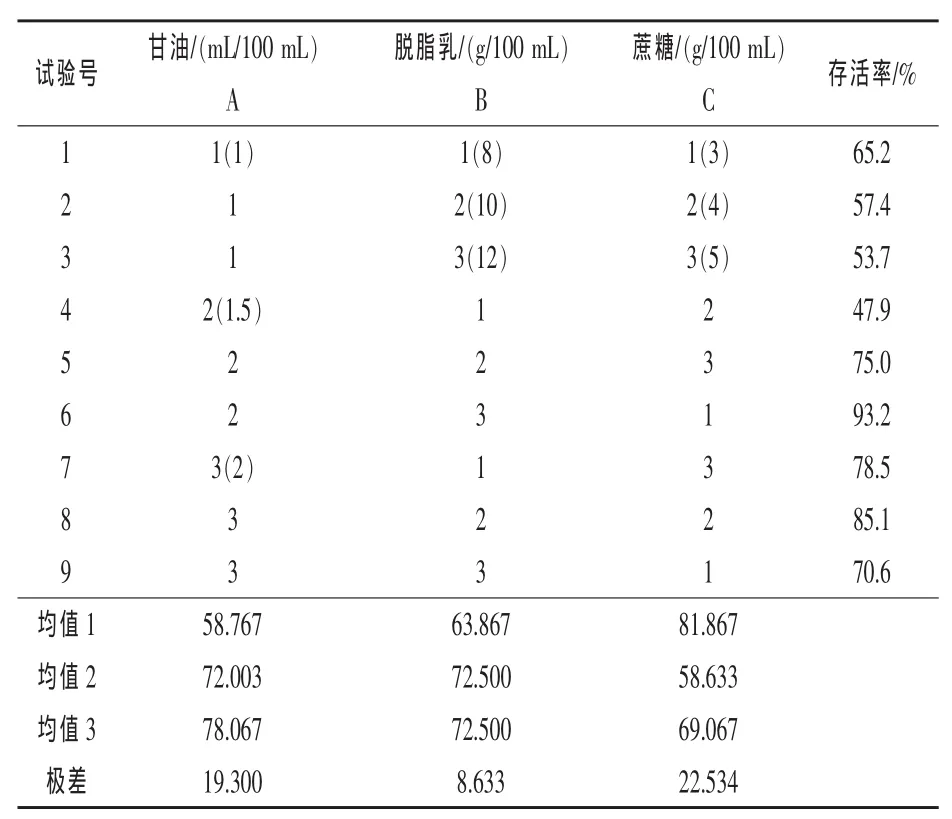
表3 屎肠球菌保护剂的筛选

表4 正交试验数据分析
3 讨论与结论
3.1 乳酸菌细胞的冻干损伤 本研究中,乳酸菌活菌数减少的主要原因是冷冻和干燥过程引起的,许多研究者认为在快速降温时产生细胞损伤的主要原因是细胞内外冰晶生长产生的机械力量引起的溶质损伤(Bumsoo和 John,2004)。溶质损伤又称“溶液损伤”,是由于水的冻结使细胞间隙内的液体逐渐浓缩,从而使电解质的浓度显著增加。由于细胞内外渗透压的存在导致细胞脱水,细胞内的蛋白质对高浓度的电解质极为敏感,蛋白质发生变性,进而丧失其功能,因此增加了细胞死亡的可能性。通常细胞膜中的磷脂的极性端在一定程度上是以水合形式存在的,而且每个磷脂的极性端与其他磷脂分子的极性端被水分子隔开。当磷脂干燥脱水时,极性端的密度增加,糖链间的范德华引力增强,平时处于液晶态的脂膜变成凝胶态,相的变化使复水时细胞膜的通透性增加,胞内一些可溶性物质发生渗漏,从而导致细胞死亡(陈声明和吕琴,1996)。细胞代谢调节作用损伤是当细胞内某一关键酶失活,会造成细胞代谢受阻,积累了影响正常生理功能的某种产物,从而整个细胞代谢紊乱,导致细胞死亡。
3.2 保护剂的保护机理 甘油具有良好的渗透性,它能渗透到细胞内部,以羟基和胞内大分子形成氢键,部分取代由水分子形成的氢键,使生物体中的蛋白质、碳水化合物、脂肪和其他大分子物质在缺水条件下仍可保持其原有结构,维持生物体活力。关于糖类保护作用机理主要有两大学说:“水替代假说”和“玻璃态假说”,总之生物活性物质保护剂要有较高的玻璃态温度,或有一定的羟基来替代水,使蛋白质保持较低的主相变温度,即有效保持活性。但目前这两种假说还不能完全解释现有的试验现象,所以其保护机理仍需深入研究。脱脂奶粉、可溶性淀粉等高分子保护剂溶于水,溶液可呈过冷状态,即在冰点以下的相同温度该溶液中的溶质浓度较小,蛋白质盐析变性也较少。另外,它们能减少细胞暴露于氧气和介质中的面积,同时在菌体表面形成保护层,减少由于细胞壁损坏引起的胞内物质泄漏,从而起到保护作用。
不同的保护剂在冻干过程中发挥着不同的作用,一般认为,低分子化合物(如低聚糖、氨基酸等)在冻干过程中直接发挥作用,而高分子化合物(如蛋白质、多糖等)则可促进低分子化合物的保护作用。根据有关文献(孙盈等,2011;朱东升等,2010;陈卫等,2008),确定甘油、脱脂乳、多糖三种保护剂的最佳配比分别在2%、10%、1%,而本试验通过单因素试验确定三种冻干保护剂最佳配比为甘油1%、脱脂乳10%、蔗糖5%。挑选部分有代表性的水平组合进行正交试验,利用正交试验最终得出屎肠球菌真空冷冻干燥保护剂的优化组合为甘油2 mL/100 mL、脱脂乳12 g/100 mL、蔗糖3 g/100 mL,冻干后菌体存活率超过93.2%。
[1]陈声明,吕琴.微生物冷冻干燥的抗性机理[J].微生物学通报,1996,23(4):236~238.
[2]陈卫,陆英,田丰伟,等.干酪乳杆菌LC-15冻干发酵剂制备条件研究[J].中国乳品工业,2008,36(7):9~13.
[3]容庭,何前,陈庄,等.屎肠球菌及其在仔猪生产上的研究现状[J].饲料工业,2008,29(22):55~57.
[4]孙盈,黄金海,李莹,等.耐热型复合乳酸菌冻干保护剂的研究[J].中国乳品工业,2011,39(4):12~15.
[5]文静,孙建安,周绪霞,等.屎肠球菌对仔猪生长性能、免疫和抗氧化功能的影响[J].浙江农业学报,2011,23(1):70~73.
[6]朱东升,马鎏鎏,李青青,等.嗜酸乳杆菌冷冻干燥过程中保护剂的筛选及液氮预冻[J].食品科学,2010,31(1):198~200。
[7]Bumsoo H,John C.Bischof.Direct cell injuryassociated with eutectic crystllization during freezing[J].Cryobiology,2004,48:8~21.

