罗伊氏乳杆菌体外抑菌和免疫调节性能的研究
池海波,李烨
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
0 引言
乳杆菌类乳酸菌是益生菌的重要类群,能通过生物拮抗和免疫调节作用抑制病原菌在机体内定植、繁殖以及致病能力。罗伊氏乳杆菌(Lactobacillus reuteri)天然存在于人体和动物体肠道内,具有抑制病原菌、调节机体肠道微生物菌群的平衡、增强机体免疫力等生理活性和保健功能[1],是国际上公认的新型益生乳酸菌,具有很高的理论研究和应用价值。
为了深入探究罗伊氏乳杆菌的抑菌和免疫调节性能,本文以L.reuteri ATCC53608为研究对象,3株分离自发酵乳制品的益生乳酸杆菌为比对,研究并比较了罗伊氏乳杆菌不同培养的上清液对单增李斯特菌、金黄色葡萄球菌、阪崎克罗诺杆菌、大肠杆菌4种指示菌的体外抑菌性能,以小鼠巨噬细胞系RAW264.7为细胞模型,研究罗伊氏乳杆菌对脂多糖诱导的免疫反应的调节性能,为罗伊氏乳杆菌益生性能的的开发和应用提供理论依据。
1 实验
1.1 材料
1.1.1 供试菌株和细胞
罗伊氏乳杆菌ATCC53608(Lactobacillus reuteri ATCC53608)、嗜酸乳杆菌 237(Lactobacillus acidophilus 237)、嗜酸乳杆菌234(Lactobacillus acidophilus 234)、植物乳杆菌 233(Lactobacillus plantarum 233)、大肠杆菌(Escherichia coli W3110)、金黄色葡萄球菌ATCC25923(Staphylococcus aureus ATCC25923)、阪崎克罗诺杆菌BAA-894(Cronobacter sakazakii BAA-894)、单增李斯特菌CMCC54005(Listeria monocytogenes CMCC54005)均为本实验室保存,其中嗜酸乳杆菌237、嗜酸乳杆菌234、植物乳杆菌233分离自发酵乳制品,小鼠巨噬细胞系RAW264.7购自中国科学院细胞库。
1.1.2 培养基
罗伊氏乳杆菌、嗜酸乳杆菌、植物乳杆菌的培养基为MRS,大肠杆菌、金黄色葡萄球菌、阪崎克罗诺杆菌、单增李斯特菌培养基为LB,小鼠巨噬细胞系RAW264.7培养液为DMEM(Gibco BRL,USA),并添加10%胎牛血清(Hyclone Logan,UT,USA)、青霉素(100 U/mL)和链霉素(100 μg/mL)。
1.1.3 实验器材
牛津杯内径(6.0±0.1)mm,外径(7.8±0.1)mm,高(10.0±0.1)mm ;Delta 320 pH 计,GHP-9080隔水式恒温培养箱,MLS-3750高温灭菌锅,THZ-C-1全温振荡器,ST-16R台式高速冷冻离心机,Elx800酶标仪。
1.2 方法
1.2.1 乳酸菌MRS培养的无菌上清液的制备和处理
将4种乳酸杆菌分别以体积分数为1%的接种量转接于MRS液体培养基中,37℃静置培养24 h后10 000 r/min离心10 min,收集上清,过滤除菌后测上清液pH,将上清液分为3组,一组为上清原液,第二组上清液进行加热煮沸15 min处理,第三组上清液用浓度为4 mol/L的NaOH溶液调pH值至7.0,各组上清液4℃贮存备用。
1.2.2 罗伊氏乳杆菌甘油发酵的无菌上清液的制备和处理
将罗伊氏乳杆菌以体积分数为1%的接种量转接于MRS液体培养基中,37℃静置培养24 h,10 000 r/min下离心10 min,上清过滤备用并收集菌体,用0.05 mol/L的磷酸钾缓冲液(pH=7.2)洗涤菌体两次,洗涤后的菌体用磷酸钾缓冲液制成菌悬液(菌体浓度1.0×108mL-1),再加入等体积的浓度为0.4 mol/L的甘油,37℃静置培养2~6 h。分别在培养2 h和6 h时离心收集上清,过滤除菌后,一部分上清液4℃贮存备用,另一部分上清液进行加热煮沸15 min处理后4℃贮存备用。
1.2.3 指示菌菌悬液的制备
将4种指示菌分别转接于LB培养液,37℃振荡培养18 h,用无菌生理盐水将菌液浓度稀释至OD600=1.0,待涂布用。
1.2.4 抑菌试验
采用牛津杯法[2]。将制备好的指示菌菌悬液100 μL均匀涂布于LB平板,待平板表面自然干燥后,立即将灭菌牛津杯放置在平板上,取200 μL待测液加入牛津杯中,37℃培养18 h,每个样品做3个平行,测量抑菌圈直径(mm),拍照。
1.2.5 细胞免疫反应实验
小鼠巨噬细胞系RAW264.7用DMEM高糖培养液培养,并添加体积分数为10%热灭活(56℃,30 min)胎牛血清、青霉素(100 U/mL)、链霉素(100 μg/mL),于CO2培养箱中,37℃培养[3]。采用0.25%胰酶消化细胞,细胞计数后,将200 μL细胞悬液接种至96孔细胞培养板,每孔1.0×105个细胞,培养12 h后更换新鲜培养液,同时加入终质量浓度1 mg/L LPS(E.coli,sigma-Aldrich)和不同终浓度(5×106,5×107,5×108mL-1)的罗伊氏乳杆菌菌液,24 h后取细胞培养上清液离心,去除残余细胞,采用ELISA试剂盒(eBioscience,USA)测定细胞上清液中白细胞介素-6(IL-6)浓度。
2 结果与讨论
2.1 无菌上清液的抑菌作用
已经报道罗伊氏乳杆菌具有广谱的抑菌性能[4],罗伊氏乳杆菌拮抗病原菌的机制之一是能厌氧代谢甘油产非蛋白类的广谱抗菌物质——罗伊氏菌素(Reuterin)[5],Reuterin化学本质是在甘油脱水酶和辅酶维生素B12的作用下[6],甘油脱水代谢的产物3-羟基丙醛(3-HPA)的单体、3-羟基丙醛的水合物和3-羟基丙醛的环化二聚体的混合体系[7-8]。
本研究着重考察了在无添加甘油、用MRS培养的条件下和在甘油中发酵的条件下,罗伊氏乳杆菌ATCC53608对大肠杆菌、单增李斯特菌、金黄色葡萄球菌、阪崎克罗诺杆菌4种指示菌的抑制性能以及其抑菌活性物质的产生和作用特性。
乳酸杆菌用MRS培养的无菌上清液对4种指示菌的抑菌作用如图1所示。

图1 4种乳酸杆菌MRS培养的无菌上清原液对指示菌的抑菌作用
由图1可以看出,对罗伊氏乳杆菌MRS培养的无菌上清液最敏感的指示菌是大肠杆菌,最不敏感的是金黄色葡萄球菌。与其它乳酸菌比较,罗伊氏乳杆菌MRS培养的无菌上清原液对4种指示菌的抑制效果,相似于嗜酸乳杆菌234及嗜酸乳杆菌237,但次于植物乳杆菌233。
2.2 pH值对上清液抑菌作用的影响
本研究中测得的4种乳酸菌的上清原液的pH值分别是:植物乳杆菌233为2.5,嗜酸乳杆菌234为3,嗜酸乳杆菌237为3.5,罗伊氏乳杆菌为3.5,将上清原液的pH值调至7.0后,4种乳酸菌在4种指示菌的平板上均没有了抑菌现象,图2显示了上清原液的pH调至中性后对金黄色葡萄球菌的作用结果。该实验结果说明在MRS培养的乳酸杆菌上清液中,酸是主要的抑菌成分。
图2中,(a)为上清原液对金黄色葡萄球菌的抑菌圈;(b)为pH值调至7.0的上清原液对金黄色葡萄球菌的抑菌圈;233为植物乳杆菌;234为嗜酸乳杆菌;237为嗜酸乳杆菌;LR为罗伊氏乳杆菌ATCC53608。

图2 pH值对4种乳酸杆菌MRS培养的上清液抑菌作用的影响
2.3 加热处理对上清液抑菌作用的影响
对部分罗伊氏乳杆菌MRS培养的上清原液进行了加热煮沸处理,比较加热处理前后上清原液对致病菌的抑菌作用。

表1 罗伊氏乳杆菌MRS培养上清加热煮沸处理前后的抑菌圈直径 mm
由表1可以看出,加热后抑菌圈的直径下降并不明显,说明罗伊氏乳杆菌MRS培养的上清液中的抑菌组分有较好的热稳定性,排除大分子蛋白质作为抑菌物质的可能。
2.4 罗伊氏乳杆菌在甘油中发酵的上清液的抑菌作用
罗伊氏乳杆菌的益生功能与代谢甘油产罗伊氏菌素密切有关,基于罗伊氏菌素合成代谢的途径,采用两次发酵处理法考察了罗伊氏乳杆菌ATCC53608产生罗伊氏菌素及其抑菌的性能。首先用MRS培养基培养菌体,离心并过滤获得一次发酵上清液,菌体洗涤后添加甘油静置培养2~6 h,离心并过滤获得二次发酵上清液,分别考察了二次发酵2 h和6 h后的抑菌性能,同时也考察了对甘油二次发酵的上清液进行加热煮沸处理后的抑菌性能变化,结果如图3所示。
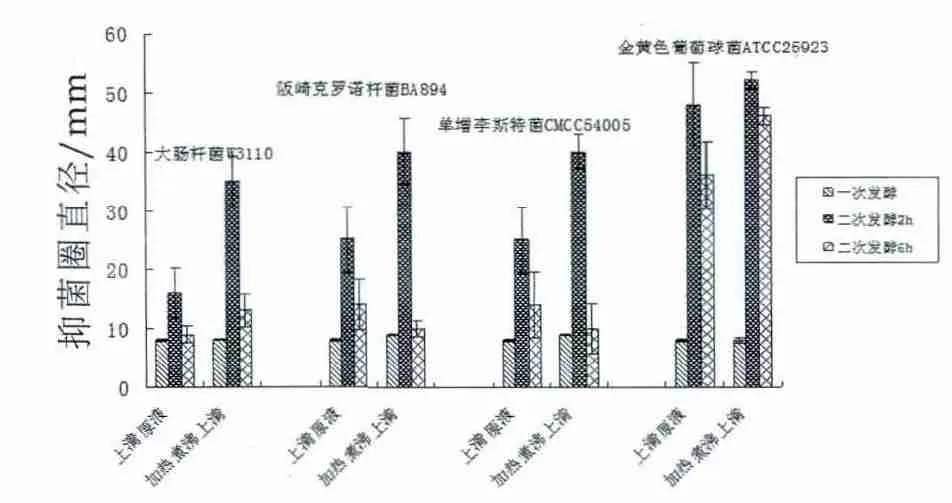
图3 罗伊氏乳杆菌在甘油中发酵的上清液的抑菌作用
由图3可以得出,罗伊氏乳杆菌添加甘油二次发酵的上清液,无论是原液还是加热煮沸处理液,对4种指示菌的的抑菌性能较一次发酵上清液都有明显提高,特别对革兰氏阳性指示菌金黄色葡萄球菌,二次发酵2 h的上清原液抑菌圈直径提高40 mm。比较加热处理前、后的抑菌性变化,可见添加甘油二次发酵液经过加热煮沸处理后,对4种指示菌抑菌圈直径比二次发酵原液都有明显增加。其机制有待于进一步研究,推测可能与罗伊氏菌素是一个以3-羟基丙醛单体为转换中心的复杂的动态混合体系、其成分包括3-羟基丙醛、3-羟基丙醛水合物及3-羟基丙醛的二聚体有关,经过加热处理,其本身的混合体系成分或比例发生了改变,导致其抑菌性增强。本实验结果还显示了二次发酵2 h的上清液抑菌能力好于6 h的发酵上清液,即甘油发酵液随着发酵时间的延长,其抑菌性能下降,推测可能也是与混合体系成分发生了改变有关。
2.5 罗伊氏乳杆菌对LPS诱导的细胞免疫反应的影响
乳酸菌对非特异性免疫的调节主要是通过影响单核巨噬细胞的免疫功能而实现,国内外的研究表明,乳酸菌可抑制细胞分泌炎性细胞因子[9-10]。革兰氏阴性细菌外膜成分脂多糖(LPS)又称内毒素,是非特异性免疫刺激剂,其类脂A(lipid A)结构能被免疫细胞(单核巨噬细胞、中性粒细胞和树突状细胞)表面的病原体识别受体TLR4(Toll-like receptor 4)识别,激活胞内信号转导途径,引发TNF-α,IL-1,IL-6等炎性细胞因子的释放,过量的细胞因子会导致毒性效应[11-12]。
本研究以LPS(1 μg/mL)作为免疫诱导剂,以巨噬细胞RAW264.7为细胞模型,考察了罗伊氏乳杆菌的免疫调节作用。在LPS刺激巨噬细胞RAW264.7的免疫反应体系中同时加入罗伊氏乳杆菌菌液,诱导24 h后检测细胞培养上清液中IL-6质量浓度,结果如图4所示。
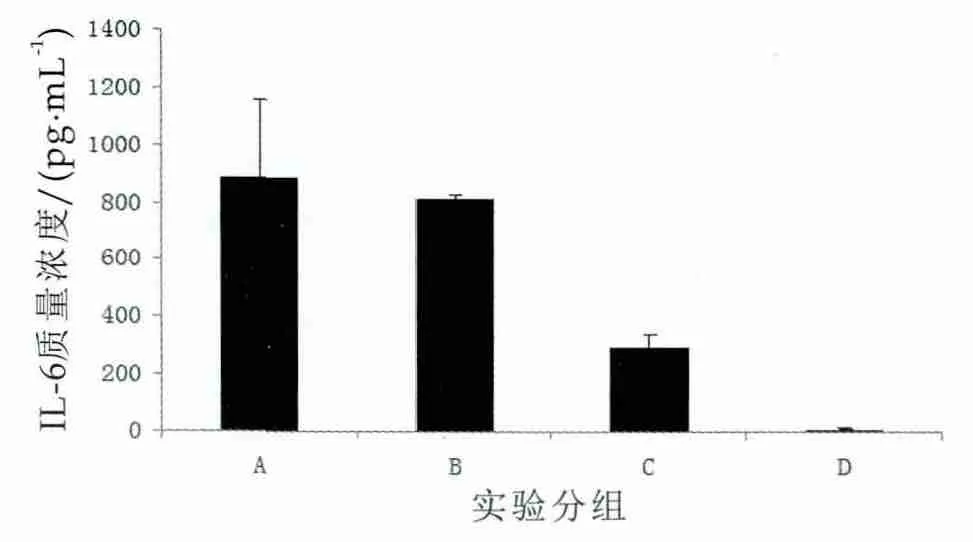
图4 罗伊氏乳杆菌对LPS诱导RAW264.7细胞合成IL-6的影响
图4中,A为质量浓度1 μg/mL的LPS诱导;B为质量浓度1 μg/mL的LPS诱导,罗伊氏乳杆菌初始菌浓为106mL-1;C为质量浓度1 μg/mL 的LPS诱导,罗伊氏乳杆菌初始菌浓为107mL-1;D为质量浓度1 μg/mL的LPS诱导,罗伊氏乳杆菌初始菌浓为108mL-1。
由图4可以看出,与对照组相比,与罗伊氏乳杆菌ATCC53608共孵育时,RAW264.7细胞的IL-6合成量明显下降(IL-6量最低降为8 pg/mL),且随着共培养体系中罗伊氏乳杆菌ATCC53608数量增多IL-6合成量下降越明显,可见罗伊氏乳杆菌ATCC53608对LPS刺激的免疫反应有较强的调节能力。
3 结论
利用甘油发酵是罗伊氏乳杆菌在体外呈现较强抑菌性能的重要条件,单增李斯特菌、金黄色葡萄球菌、阪崎克罗诺杆菌、大肠杆菌4种指示菌中,金黄色葡萄球菌对其抑菌成分最敏感,加热处理甘油发酵上清液能够增强抑菌效果,罗伊氏乳杆菌对LPS刺激的免疫反应具有调节作用。由于罗伊氏菌素抑菌作用机制以及乳酸菌抑制炎性细胞因子的分子机理目前还没有被阐明,所以本研究发现的一些实验现象有待于今后深入探析。
[1]CASAS I A,DOBROGOSZ W J.Validation of the probiotic concept:Lactobacillus reuteri confers broadspectrum protection against disease in humans and animals[J].Microbial Ecology in Health and Disease,2000,12:257-285.
[2]刘冬梅,李理,杨晓泉,等.用牛津杯法测定益生菌的抑菌活力[J].食品研究与开发,2006,27(3):110-111.
[3]HAN Y,LI Y,CHEN J,et al.Construction of monophosphoryl lipid A producing Escherichia coli mutants and comparison of immuno-stimulatory activities of their lipopolysaccharides[J].Marine Drugs,2013,11,363-376.
[4]张丁丁,葛克山,任发政,等.益生菌抑菌功能研究进展[J].乳品加工,2008,12:40-42.
[5]TALARICO T L,CASAS I A,CHUNG T C,et al.Production and isolation of reuterin,a growth inhibitor produced by Lactobacillus reuteri[J].Antimicrobial Agents and Chemother,1988,32(12),1854-1858.
[6]TALARICO T L,DOBROGOSZ W J.Purification and characterization of glycerol dehydratase from Lactobacillus reuteri[J].Applied Environmental Microbiology,1990,56:1195-1197.
[7]TALARICO T L,DOBROGOSZ W J.Chemical characterization of an antimicrobial substance produced by Lactobacillus reuteri[J].Antimicrobial Agents and Chemotherapy,1989,33(5):674-679.
[8]VOLLENWEIDER S,GRASSI G,KONIG I,PUHAN Z.Purification and structural characterization of 3-hydroxypropionaldehyde and its derivatives[J].Journal of Agricultural and Food Chemistry,2003,51(11):3287-3293.
[9]CHON H,CHOI B,JEONG G,et al.Suppression of proinflammatory cytokine production by specific metabolites of Lactobacillus plantarum 10hk2 via inhibiting NF-kappa B and p38 MAPK expressions[J].ComparativeImmunologyMicrobiologyand Infectious Diseases,2010,33(6):41-49.
[10]ZHANG L,LLN,CAICEDO R,et al.Alive and dead Lactobacillus rhamnosus GG decrease tumor necrosis factor-α-induced interleukin-8 production in caco-2 cells[J].Journal of Nutrition,2005,135(7):1752-1756.
[11]LU Y C,YEH W C,OHASHI P S.LPS/TLR4 signal transduction pathway[J].Cytokine,2008,42(2):145-151.
[12]GAEKWAD J,ZHANG Y,ZHANG W,et al.Differential induction of innate immune responses by synthetic lipid A derivatives[J].Journal of Biological Chemistry,2010,285(38):29375-29386.

