花生种皮原花青素结构的初步鉴定
姬 娜 张 磊 熊 柳 孙庆杰
(青岛农业大学食品科学与工程学院,青岛 266109)
花生种皮原花青素结构的初步鉴定
姬 娜 张 磊 熊 柳 孙庆杰
(青岛农业大学食品科学与工程学院,青岛 266109)
本研究以脱脂花生种皮为原料,利用乙醇溶剂法进行粗提,得到花生种皮原花青素的粗提物。通过选用AB-8型大孔吸附树脂纯化花生种皮原花青素的粗提物得到3个级分,分别为20%乙醇纯化物(PSPP1)、30%乙醇纯化物(PSPP2)和50%乙醇纯化物(PSPP3)。通过高效液相色谱-电喷雾质谱(HPLC/ESI-MS)分析可知,PSPP1检测出2种单体、5种二聚体、7种三聚体和2种四聚体;PSPP2检测出1种单体、4种二聚物、12种三聚物和5种四聚物;PSPP3检测出1种单体、4种二聚物、7种三聚物和2种四聚物。该研究结果表明花生种皮组分中原花青素的组成较为复杂。通过质谱及碎片信息分析,可得出花生种皮原花青素的连接键类型主要包括 A型键[(C4-C8),(C2-O7),(C4-C6),(C2-O7)]和 B型键[(C4-C8)或(C4-C6)]。
花生种皮 原花青素 HPLC-MS
原花青素是自然界中普遍存在的聚多酚类混合物,具有较强的抗氧化、清除自由基能力,保护和稳定维生素C,有助于维生素C的吸收[1],是一种新型天然抗氧化剂,具有安全、无毒等优点[2],广泛应用于癌症、动脉硬化、肿瘤、毛细管疾病[3]等疾病的预防和治疗,通常将二~四聚体称为低聚体,将五聚体以上的称为高聚体[4-5]。由于原花青素的保健功能与其临床实验的安全性,使原花青素在食品工业上得到非常广泛的应用。作为抗氧化性食品添加剂,原花青素可作为食品增补剂、营养强化剂和天然抗氧化剂,还可以作为天然防腐剂来替代合成防腐剂,同时可以广泛加入到各种普通食品如奶酪、蛋糕及酒和饮料中,作为健康食品的原花青素胶囊已成为美国天然植物十大畅销品种之一[6]。目前,从自然界中分离鉴定的原花青素化合物共有200余种,主要集中在葡萄籽、葡萄皮、沙棘、莲等植物中。樊金玲[7]对沙棘籽原花青素化合物进行了分离纯化和结构鉴定,徐丽嫚[8]等对高粱外种皮中原花青素的组分进行了鉴定,而对花生种皮原花青素的结构研究较少,Appeldoorn等[9]主要对花生红皮中的A-型二聚体进行了研究。花生是我国重要的油料作物与经济作物,花生种皮作为花生加工的副产物,含有丰富的功能活性成分原花青素,具有较高的综合利用价值。本研究采用大孔树脂分离原花青素,用不同乙醇浓度洗脱得到了极性不同的原花青素,用HPLC-MS对纯化的花生种皮原花青素组分和原花青素的结构单元进行分析和鉴定,为花生种皮中原花色素的综合利用和工业化生产提供借鉴。
1 材料与仪器
1.1 材料与试剂
脱脂花生种皮:青岛东生集团股份有限公司;儿茶素、表儿茶素:Sigma公司。
1.2 试验仪器
6430型三重四极杆液质谱联用系统:美国安捷伦公司;Agilent ZORBAX Eclipse plus C18(2.1 mm×150 mm,1.8μm)色谱柱:美国安捷伦公司。
2 试验方法
2.1 样品的制备
称取一定量60目的脱脂花生种皮,加入60%乙醇浓度溶液浸提,于水浴锅中加热回流提取2 h后,冷却至室温,在3 000 r/min下离心20 min,同法提取2次,合并提取液,50℃下进行真空浓缩后冷冻干燥,得到花生种皮原花青素粗提物,备用。称取预处理过的 AB-8型大孔树脂(交换容量不少于4.2 g/mol,含水量50%~60%,规格 HG-2-885-7 630 g),将浓度为2.5 mg/mL的原花青素提取液以流速0.5 mL/min流速通过树脂柱至吸附饱和,水洗至洗脱液无色,分别用20%、30%、50%乙醇溶液分步洗脱,然后将所得到的分级洗脱级分分别为20%花生种皮原花青素乙醇纯化物(PSPP1)、30%花生种皮原花青素乙醇纯化物(PSPP2)、50%花生种皮原花青素乙醇纯化物(PSPP3)真空浓缩,冷冻干燥后,备用。
2.2 各洗脱级分的高效液相色谱—质谱联检分析
将洗脱级分10 mg分别溶于10 mL纯水中,经0.45μm滤膜过滤后进行HPLC-MS分析。
色谱条件:流动相:A-水,B-100%乙腈。按以下梯度进行洗脱:0~20 min,0~40%B;20~25 min,40%~41%B;25~35 min,41%B。柱温:35℃,流速:1 mL/min,进样量:20μL,检测波长:280 nm。
质谱条件:ESI(-);扫描范围(m/z):100~1 500;雾化气温度:350℃;雾化气流速:9.0 L/min;雾化气压:30.0 psi;毛细管电压:4 kV;锥孔电压:-40.0 V;毛细管出口电压:-135 V。
3 结果与分析
3.1 20%乙醇洗脱级分的HPLC-MS分析
AB-8型大孔树脂纯化的级分包括20%花生种皮原花青素乙醇纯化物(PSPP1)、30%花生种皮原花青素乙醇纯化物(PSPP2)、50%花生种皮原花青素乙醇纯化物(PSPP3)。
PSPP1中原花青素成分的保留时间和质谱数据如表1所示,通过查阅国内外资料[10-12],鉴定出了16种物质。原花青素单体主要由(+)-儿茶素和(-)-表儿茶素组成,其相对分子质量为290,广泛存在于葡萄籽、花生、山楂等多种植物中。原花青素单体还包括(-)-表儿茶素没食子酸单酯、表没食子酸儿茶素,其相对分子质量为442和306,这些单体相应的准分子离子[M-H]-m/z分别为:289,289,441,305。各单体通过C4-C6或C4-C8键相连,形成二聚体、三聚体、四聚体等。该试验通过负离子模式检测花生种皮原花青素单体和多聚体,由于花生种皮提取液中成分复杂,干扰较大,并且原花青素是通过黄酮类物质中的黄烷醇聚合而成,原花青素的各聚合体之间极性相近。因此,本试验采用的液质条件只能较好地分离原花青素单体和二聚体、三聚体、四聚体等几种。在PSPP1中检测出的单体包括:在保留时间7.85 min检测出负离子m/z289(表1),经标准品对照,确定为(-)-表儿茶素准分子离子;在保留时间为14.45 min时,检测出负离子m/z441,没有显著的离子碎片出现,推测为(-)-表儿茶素没食子酸单酯。

表1 PSPP1中原花青素成分的保留时间和质谱数据
对单体来说,二聚体的分离比较困难,其对应的质谱数据也较复杂,除推断出准分子离子外,还提供了一系列碎片离子信息。从表 1中m/z577和m/z575的质谱数据可以得出,二聚体有5种,保留时间分别为 3.95、5.04、7.35、8.46和 10.74 min,其中保留时间为7.35 min的为B型二聚体,m/z577推断为B型二聚体[13],其余都为A型二聚体。A型二聚体和B型二聚体的分子结构如图1所示[10],质谱数据中未得出m/z729和m/z881的没食子酸二聚体单酯和没食子酸二聚体二酯的质谱信息,说明花生种皮中不存在没食子酸二聚体单酯和没食子酸二聚体二酯。
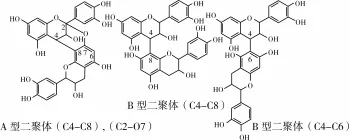
图1 不同类型的原花青素二聚体
原花青素聚合体的碎裂方式主要包括黄烷醇间连接键的断裂(QM)、逆狄尔斯-阿德尔(RAD)反应和杂环裂解(HRF)反应。HRF反应为二聚体失去1个m/z126的中性分子。RAD反应是黄烷醇C-环上发生断裂,失去1个相对分子质量为152的中性的结构(C8H8O3)。经RAD重排产生的碎片离子为m/z425,形成的碎片还可能失去一分子H2O,形成碎片离子为m/z407,m/z577的ESI质谱图中的m/z407证明了这一点。黄烷醇间断裂(QM)有2种可能,一种是失去仅以C4键与其他单元相连顶部单元T-unit(TOP)中性碎片,形成m/z为[m/z288-H]的离子;另一种可能是失去以C6或C8键与其他单元相连的底部单元 B-unit(BASE),形成m/z为[m/z290-H]的碎片片断,m/z577二级质谱图中的m/z289为二聚体失去T-unit(TOP)形成的碎片。如图1所示。
二聚体中连接键的确定通过核磁共振(NMR)能够较好鉴定,但是这些二聚体可能因结构(连接键或立体形状)的不同而出现在不同的保留时间,所以能够被色谱所分开,与Appeldoorn等[9]研究从花生红皮中分离A-型二聚体,色谱图的分离出现了4个峰,其中包括1个A-型二聚体,1个B型二聚体的结果一致。经与刘亮[13]结果进行比对,可以得出m/z577为B型二聚体。断裂方式如图2所示。

图2 原花青素二聚体的断裂途径[13]
m/z575断裂方式可能包括:m/z289+285(QM),m/z423+407(RDA)和m/z449(HRF)。如质谱数据中的显示的碎片:除了m/z574.9外,m/z285.0为二聚体失去B-unit(BASE)形成的碎片,m/z407.2为二聚体发生RDA反应形成的碎片,m/z449为二聚体失去m/z为126的中性分子后形成的碎片,说明m/z575为二聚体,其断裂方式包括的3种断裂形式,且由 Appeldoorn等[9]知m/z575是 A型二聚体。m/z573是一种未被鉴定的二聚体,其可能的断裂方式如图3所示,可能包括:m/z289+285(QM),m/z421+409(RDA)和m/z447(HRF)。m/z573质谱图的主要离子碎片为m/z285和m/z447。说明断裂方式包括QM和HRF反应,其断裂方式如图3所示[10]。

图3 m/z573的二聚体选择性离子质谱图
4种A型二聚体的准分子离子为m/z575,根据文献[13]所知,其为B型二聚体的同分异构体,其连接键包括(C4-C8,C2-O7)或(C4-C6,C2-O7),推测其应该为[表儿茶素-(C4-C8),(C2-O7)-儿茶素]或[表儿茶素 -(C4-C6),(C2-O7)-儿茶素]。
从三聚体质谱数据可知,在保留时间为4.81、8.85、9.36、9.86、10.09、10.93、11.18、13.32 min时,推断它们为三聚体,其m/z为865。从其三聚体的ESI负离子质谱数据分析:m/z865.2为其准分子离子峰,其断裂可能之一是失去1个T-unit形成m/z577二聚体负离子碎片。色谱数据中未发现m/z1 017,说明其不存在酯型聚合体。根据文献[14]可知其是一种只有B型键连接的三聚体,分子结构为原花青素三聚体(C1)[(E)C-B-(E)C-B-(E)C],由质谱数据可以得出,它的分子离子和质谱碎片主要有m/z287.2、m/z575.1、m/z713.1、m/z695,这些级分可能在黄烷醇C-环上发生RAD反应,失去1个相对分子质量为152的中性结构(C8H8O3)。经RAD重排产生的碎片离子,形成的离子级分还可以进一步失去一分子H2O,这样就会出现m/z425、m/z408碎片。研究发现[14],三聚体原花青素的RAD,只产生m/z713,而没有发现m/z425、m/z408碎片与质谱数据的结果一致。其可能是内部黄烷醇键以苯醌-亚甲基方式裂解,产生m/z287([Mtop-3H]-,次甲基苯醌)和m/z289([Mbase-H]-,黄烷-3-醇单体)碎片,后者比前者离子碎片多,而m/z865三聚体原花青素只检测到m/z575([Mtop-middle-3H]-)和m/z287,未检测到m/z289。
从PSPP1的色谱数据可以得出另外2个三聚体m/z为 863和 861,保留时间在 8.85、9.36、9.86、10.09、10.93、11.18 min时的m/z为 863,其二级质谱图包括m/z289、m/z411.1、m/z575、m/z693.1等准分子离子,其为一种A型键连接的三聚体。在保留时间13.32 min出现1个m/z861的选择性离子峰,其二级质谱碎片包括m/z709。可推测这些级分是在黄烷醇C-环上发生RAD反应,失去1个相对分子质量为152的中性的结构(C8H8O3),形成m/z709的离子碎片。
原花青素的四聚体结构更为复杂,组成方式较多,只能进行初步的推断,在保留时间9.17 min和12.57 min所出现的2个峰的质谱数据,分别是m/z1 151和m/z1 149,根据 Appledoorn等[9]推断其为原花青素的四聚体,当m/z1 151时,其二级质谱离子碎片为m/z411、574.9、862.8、999.3。未见检测到m/z861和573,因此不能确定其准确的连接结构。当m/z1 149时,其二级质谱离子碎片主要为m/z575。
3.2 30%乙醇洗脱级分的HPLC-MS分析
PSPP2中原花青素成分的保留时间和质谱数据如表2所示,PSPP2共鉴定出1个单体、4个二聚物、12个三聚物、5个四聚物。除PSPP1的质谱数据所推断的准分子离子:m/z289、m/z575、m/z577、m/z861、m/z863、m/z865、m/z149、m/z1 151外,在保留时间14.06min时出现了1个新的准分子离子峰为m/z859,其 ESI的质谱图碎片包括:m/z447和m/z735,m/z447可能为m/z573的二聚体离子经过HRF反应失去1个m/z126的中性分子形成的,但是其不遵循RDA反应,其可能是A型原花青素三聚体,连接键为[(E)C→A→(E)C→B→山奈酚或毛地黄黄酮]。
3.3 50%乙醇洗脱级分的HPLC-MS分析
PSPP3中原花青素成分的保留时间和质谱数据如表3所示,PSPP3中共鉴定出1个单体、4个二聚物、7个三聚物、2个四聚物。
除PSPP1和PSPP1的质谱数据所推断的准分子离子:m/z289、m/z575、m/z577、m/z859、m/z861、m/z863、m/z865、m/z1 149、m/z1 151外,在保留时间14.08 min时出现了1个新的准分子离子峰为m/z573,推断其为原花青素二聚体,其ESI的质谱图碎片包括:m/z447和m/z285,m/z447是m/z573的二聚体离子经过HRF反应失去1个m/z126的中性分子形成的,m/z285.0为二聚体失去 B-unit(BASE)形成的碎片。质谱数据中未发现m/z421的碎片,说明其未发生RDA反应。
对于花生种皮原花青素来说,原花青素的低聚体和高聚体有着各种可能的分裂方式,所以对于分裂方式的研究有着重要的意义。花生种皮中的原花青素和葡萄籽中原花青素有着大体相同的成分,本研究对于高聚体的(DP>4)研究,受现实条件的限制,未进行深入研究,高聚体的鉴定是原花青素鉴定的先进和前沿领域,同时聚合度的增加,裂解的方式也千变万化,产生的离子碎片信息也更复杂。

表2 PSPP2中原花青素成分的保留时间和质谱数据
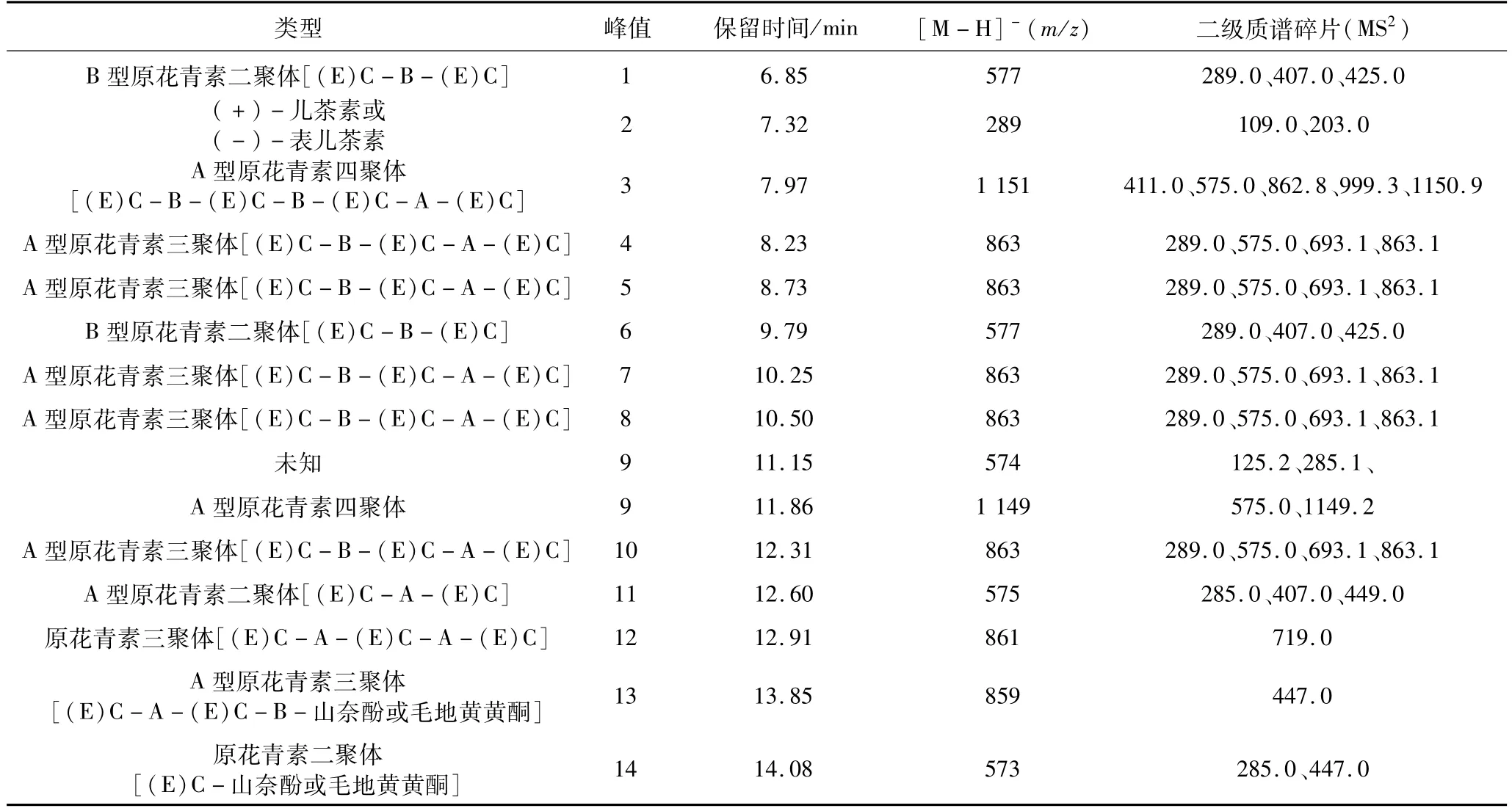
表3 PSPP3中原花青素成分的保留时间和质谱数据
4 结论
本试验采用的HPLC-MS分析鉴定花生种皮不同聚合度的原花青素的基本组成,花生种皮原花青素的组成与葡萄籽显著不同,不存在没食子酸单酯及其聚合体,并且其为非酯性原花青素。原花青素具有极性差异,因此用不同乙醇浓度可以鉴定出原花青素的不同成分。PSPP1中共鉴定出2个单体、5个二聚物、7个三聚物、2个四聚物;PSPP2中共鉴定出1个单体、4个二聚物、12个三聚物、5个四聚物;PSPP3中共鉴定出1个单体、4个二聚物、7个三聚物、2个四聚物。包括2种单体、3种二聚体、4种三聚体、2种四聚体,连接键类型包括A型键[(C4-C8),(C2-O7)或(C4-C6),(C2-O7)],B型键[(C4-C8)或(C4-C6)]。
[1]剧红梅,曲梓怡,王召令,等.原花青素的抗氧化作用[J].中国组织工程研究与临床康复,2007,11(16):3155-3157
[2]高羽,董志.原花青素的药理学研究现状[J].中国中药杂志,2009,34(6):651-655
[3]赵巍,王军,段长青,等.喷雾干燥法制备微胶囊化山葡萄籽油粉末油脂[J].中国粮油学报,2009,24(12):78-85
[4]张寒俊,王海波,习羽.改进香草醛法测定葡萄提取物种的原花青素[J].中国酿造,2010,29(8):147-149
[5]温钢,李立群,隋新.葡萄籽中低聚原花青素的提取研究[J].中国酿造,2010,29(1):111-112
[6]朱靖蓉.葡萄籽原花青素的分离提纯及抗氧化性研究[D].乌鲁木齐:新疆农业大学,2007
[7]樊金玲.沙棘籽原花色素的研究[D].无锡:江南大学,2006:55-61
[8]徐丽嫚,黄曼,涂世,等.高粱原花青素的ESI-MS分析及其低聚体的RP-HPLC-MS/MS法分离鉴定[J].食品科学,2011,32(20):221-225
[9]Appeldoorn M M,Vincken JP,Sanders M,et al.Combined normal-phase and reversed-phase liquid chromatography/ESI-MS as a tool to determine the molecular diversity of A-type procyanidins in peanut skins[J].Journal of Agricultural and Food Chemistry,2009,57(14):6007-6013
[10]Paul J Sarnoski.Separation and characterisation of proanthocyanidins in Virginia type peanut skins by LC-MSn[J].Food Chemistry,2012,131:927-939
[11]Jerneja Jakopic.HPLC-MSidentification of phenols in hazelnut(Corylus avellana L.)kernels[J].Food Chemistry,2011,124:1100-1106
[12]Maaike M Appeldoorn.Efficient isolation of major procyanidin A-type dimers from peanut skins and B-type dimers from grape seeds[J].Food Chemistry,2009(117):713-720
[13]刘亮.荔枝果皮多酚氧化酶内源底物的确定及其促褐变机制[D].武汉:华中农业大学,2008:15-39
[14]Monagas M,Garrido I,Lebron-Aguilar R,et al.Almond(Prunus dulcis(Mill.)D.A.Webb)skins as a potential source of bioactive polyphenols[J].Journal of Agricultural and Food Chemistry,2007,55(21):8498-8507.
Preliminary Structure Identification of the Procyanidins in Peanut Skin
Ji Na Zhang Lei Xiong Liu Sun Qingjie
(College of Food Science&Engineering,Qingdao Agricultural University,Qingdao 266109)
Procyanidins were extracted from the defatted peanut skin using ethyl alcohol as solvent.Eluent with 20%ethanol(PSPP1),30%ethanol(PSPP2)and 50%ethanol(PSPP3)of the procyanidin purified by AB-8 resin were analyzed with high-performance liquid chromatography-electrospray ionization-mass spectrometry(HPLC/ESI-MS).The results of HPLC/ESI-MS showed that PSPP1 consisted of two monomers,five dimers,seven trimers and two tetramers,PSPP2 consisted of one monomers,four dimers,twelve trimers and five tetramers and PSPP3 consisted of one monomers,four dimers,seven trimers and two tetramers.This meant that the composition of the purified procyanidins were very complex.The connection linkages of the polymer mainly were A type[(C4-C8),(C2-O7)or(C4-C6),(C2-O7)]and B type[(C4-C8)or(C4-C6)].
peanut skin,procyanidin,HPLC-MS
TS239
A
1003-0174(2015)04-0119-06
山东省科技发展计划(2012GNC11306)
2013-12-09
姬娜,女,1987年出生,硕士,食品工程
孙庆杰,男,1970年出生,教授,粮食、油脂与蛋白质工程

