发酵酒糟对舍饲牦牛生产性能、养分表观消化率、瘤胃发酵和血清生化指标的影响
陈光吉 彭忠利* 宋善丹 王斌星 郭春华 张正帆柏 雪 王 永 钟金城 蹇尚林 朱友军
(1.西南民族大学生命科学与技术学院,成都610041;2.四川省阿坝州畜牧工作站,马尔康 624000;3.四川省小金县农业畜牧与水务局,小金624200)
发酵酒糟是一种为缓解“人畜争粮”矛盾,提高酿酒工业副产物利用效率和社会效益而生产的新型饲料。目前,发酵酒糟已在畜禽饲粮中得到广泛应用,和鲜酒糟相比,发酵酒糟由于发酵作用降低了粗纤维含量,改善了氨基酸含量和组成,且具有较高的纤维素酶活性而取得良好的效果[1-4]。因此有必要全面深入评价发酵酒糟的应用价值,为广泛应用这种新型饲料资源提供参考。牦牛(Bos gunnens)是高原地区古老而原始的牛种,全世界约90%的牦牛生活在我国青藏高原及毗邻的6个省区(西藏、青海、四川、甘肃、新疆、云南)。作为高原居民的主要奶源和肉源,牦牛为该地区的经济发展做出了巨大贡献[5]。然而,由于历史、自然条件等多方面的原因,牦牛的生产还基本依赖于天然草地和传统的饲养管理模式,长期以来处于“夏壮、秋肥、冬瘦、春死”的恶性循环之中,研究显示牦牛在冷季损失的体重约为暖季末体重的25%[6]。传统饲养模式下,牦牛8~12年才出栏,不仅经济效益不明显,且过度放牧直接导致草地大面积退化从而破坏生态环境[7]。因此,有必要探寻新的牦牛饲养策略,提高牦牛产品生产效率以适应当前的市场需求和生态环境保护的要求,也对高原牧区群众的增收和实现牦牛产业化发展具有重要意义。在饲草严重短缺的冷季,学者们通常采用补饲的方法来减少牦牛体重损失,提高越冬能力[8-11]。然而,冷季补饲的方法并未最大化地提高牦牛的生产效率,根本上弥补冷季牦牛产品的供应空缺,也未彻底变革牦牛在遗传育种、繁殖、动物医学和营养等方面系统化研究较为困难的现状,因此,舍饲的饲养模式可能是解决上述问题的最佳途径。此外,在饲粮短缺的高原地区,开发新型的饲料资源可有效降低牦牛产业发展成本,而未见将发酵酒糟这种新型饲料资源应用于牦牛,观察其消化特性、瘤胃发酵特性和血清代谢特点来系统评价发酵酒糟的营养价值的报道。本试验旨在研究发酵酒糟对舍饲牦牛生产性能、养分表观消化率、瘤胃发酵和血清生化指标的影响,全面评价发酵酒糟在舍饲牦牛饲粮中的应用价值,为合理利用这种新型饲料资源提供参考。
1 材料与方法
1.1 试验地点
试验在四川省阿坝藏族羌族自治州小金县(N30°35′,E102°01′)进 行。 该 地 区 海 拔 约2 500m,冬季寒冷而干燥,属高原大陆型气候。年平均气温和降水量分别为12.2℃和613.9 mm,本试验在该地区最寒冷的12—2月进行,用高低温度计(河北武强县精达仪器仪表厂)测得试验期牦牛圈舍内温度为-3~14℃。
1.2 发酵酒糟
本试验所用发酵酒糟是以白酒糟、玉米和麦麸为固态发酵基质,在温度为(33.0±0.5)℃,水分为(45±2)%的条件下,接种产朊假丝酵母(Candida utilis)、黑曲霉(Aspergillus niger)、米曲霉(Aspergillusoryzae)和枯草芽孢杆菌(Bacillus subtilis)4种有益菌发酵72h而成,接种活菌数分别为3.4×107、1.8×109、2.2×109和3.6×107CFU/g。其营养水平[实测值,干物质(DM)基础]为:90.03%DM、34.42%粗蛋白质(CP)、11.66%粗灰分(ash)、28.98%酸性洗涤纤维(ADF)、35.72%中性洗涤纤维(NDF)、0.36%钙(Ca)和0.92%磷(P),并含有39.04U/g的纤维素酶活性。
1.3 试验动物与设计
采用完全随机试验设计,选取20只(208.30±3.31)kg年龄为3周岁的麦洼公牦牛,按照体重相近原则随机分为2组(A和B组),每组10个重复,每个重复1头牦牛,按组分别饲喂2种饲粮。本试验在四川省阿坝藏族羌族自治州小金圣源牦牛养殖专业合作社进行。
1.4 试验饲粮
A组饲粮参照我国《肉牛饲养标准》(NY/T 815—2004)[12]中 体 重 200kg、日 增 重 (DG)为500g的营养需要设计,B组饲粮添加9.25%的发酵酒糟(精料中比例为25%),设计与A组等氮的饲粮。粗料为玉米秸秆,2组饲粮均按照40∶60的DM精粗比人工配制成全混合日粮,并一次性备齐试验所需的足够量的饲粮,打包后妥善放置备用。饲粮组成及营养水平见表1。
1.5 饲养管理
牦牛进场前,将圈舍消毒处理,进场后立即用伊维菌素注射液进行肌注驱虫。然后称重分组后对每头牦牛分栏栓系饲养,每头牦牛所占地面空间约 1.2m2。每 日 饲喂 2 次 饲 粮(08:00 和16:00),自由采食,自由饮水,预饲期15d后进入60d的试验期。
1.6 样品采集及检测指标
1.6.1 生产性能和养分表观消化率
试验开始和结束时于晨饲前测定每头牦牛体重,根据始重、末重计算DG。记录每天每头牦牛的饲喂量和剩料量,每2周采集饲料样品,混合后测定养分含量,计算各组干物质采食量(DMI)。料重比由DMI/DG计算而来。
养分表观消化率:每组随机选取6头牦牛在试验期第50、51和52天采用内源指示剂收粪法[13][用酸不溶性灰分(AIA)作为指示剂]进行消化试验,每天每头牦牛收粪100g,按每100g粪样中加入10mL的10%硫酸固氮,将同一头牦牛3d的粪样等量混合后取150g,-20℃保存待测。同时,消化试验期间每天采集2组饲粮各1kg,将同一个组3d的饲粮混合后用于养分分析。饲粮各养分表观消化率按照下面公式计算:
某养分表观消化率=100×[1-(饲料中AIA含量/粪中AIA含量)×(粪中某养分含量/饲料中某养分含量)]。
饲料样和粪样中 DM、总能(GE)、CP、EE、ash、Ca和P含量的测定和有机物(OM)含量计算参照张丽英[14]的方法,ADF和 NDF含量参照Van Soest等[15]方法测定。除DM外,其余指标均换算为DM基础。
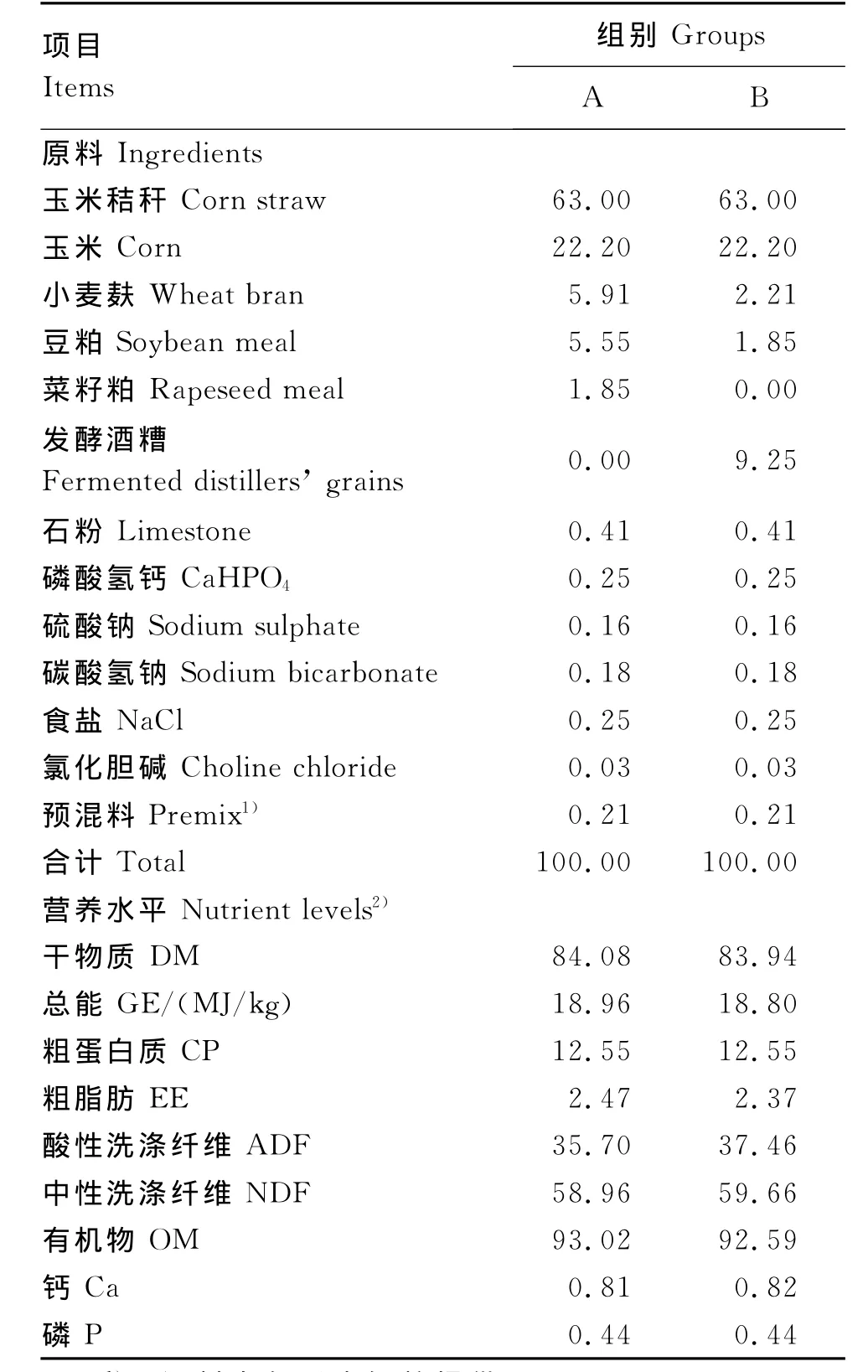
表1 饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of diets(DM basis) %
1.6.2 血清指标
试验期第60天,对每头牦牛空腹颈静脉采血10mL(肝素钠抗凝管收集),然后在3 500×g,4℃条件下离心15min收集血清样品后立即-20℃保存,用全自动生化分析仪(上海特康科技有限公司,TC6010L)测定血清尿素氮(UN)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、甘油三酯(TG)、胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量和谷丙转氨酶(ALT)、谷草转氨酶(AST)活性。
1.6.3 瘤胃发酵参数和瘤胃液纤维素酶活性
试验结束后第1天(每组试验处理不变),每组随机选取6头牦牛于晨饲后2h同时屠宰(按照当地回族清真教义进行),用4层纱布过滤瘤胃内容物后取瘤胃液60mL,立即用PHB-5型便携式pH计(杭州天威工贸有限公司)测定瘤胃液pH,然后在3 500×g,4℃条件下离心15min后取上清,然后用比色法测定氨态氮(NH3-N)含量[16]、用气象色谱内标法测定挥发性脂肪酸含量(日本岛津,CMG-QP2010)[17]和 纤 维 素 酶 活 性 (DNS法)[18](DR/5000分光光度计购自上海安谱科学仪器有限公司)。纤维素酶活性指瘤胃液中总纤维素酶活性,定义为在(40±0.2)℃、pH为6.0条件下,在1min内水解纤维类物底物,产生相当于1μg的还原糖的酶量,为1个酶活力单位。
1.7 数据处理
试验数据采用Excel 2010初步处理后,调用SPSS 18.0统计软件中独立样本t检验(Independent-Samples t Test)过程来完成2个非配对样本平均值的差异显著性检验,并使用Levene检验程序(Levene’s Test)做方差齐次性检验。以P<0.05作为差异显著的判断标准,以0.05≤P<0.10作为升高或降低的趋势的判断标准。
2 结 果
2.1 生产性能
由表2可见,2组初重差异不显著(P=0.566),但B组的DMI和DG显著高于A组(P<0.05),料重比则显著降低(P=0.040)。
2.2 养分表观消化率
由表3可见,B组的GE、OM、ADF和NDF表观消化率显著高于A组(P<0.05),而两者CP表观消化率差异不显著(P=0.471)。
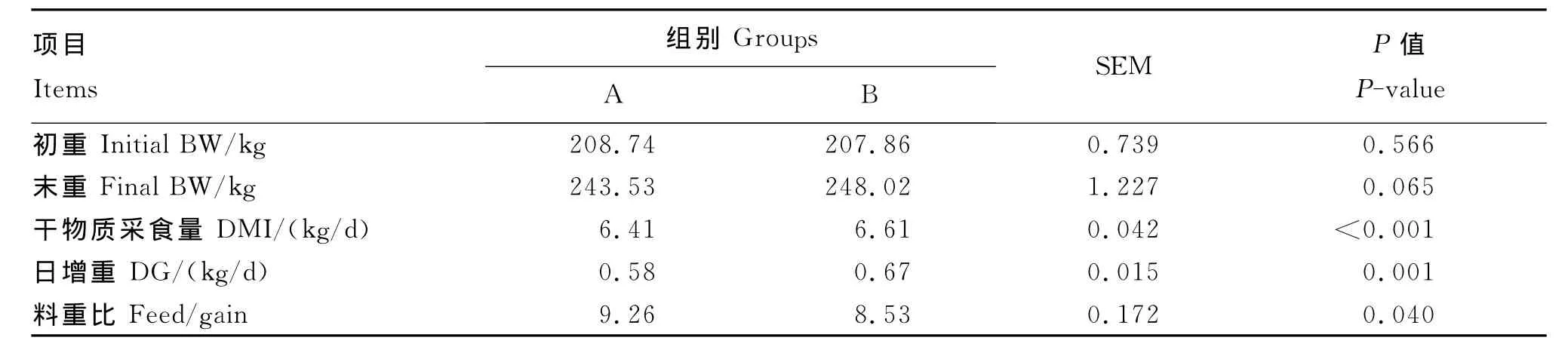
表2 发酵酒糟对舍饲牦牛生产性能的影响Table 2 Effects of fermented distillers’grains on performance in house-fed yaks
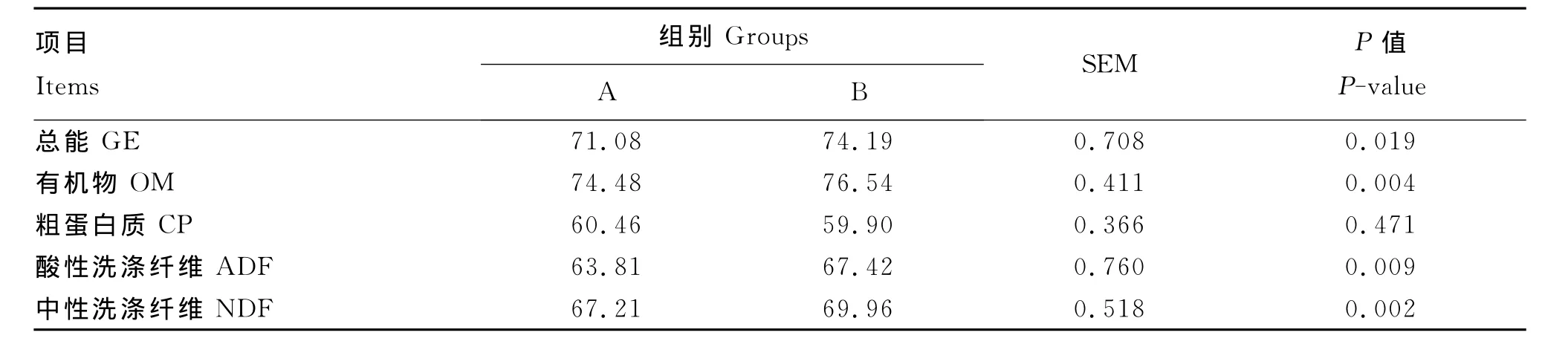
表3 发酵酒糟对舍饲牦牛养分表观消化率的影响Table 3 Effects of fermented distillers’grains on apparent digestibility of nutrients in house-fed yaks %
2.3 瘤胃发酵参数和瘤胃液纤维素酶活性
由表4可见,2组瘤胃液pH差异不显著(P>0.05)。相比A组,B组显著提高了瘤胃NH3-N、总挥发性脂肪酸、乙酸和丙酸含量及纤维素酶活性(P<0.05),但乙酸/丙酸差异不显著(P>0.05)。

表4 发酵酒糟对舍饲牦牛瘤胃发酵参数和瘤胃液纤维素酶活性的影响Table 4 Effects of fermented distillers’grains on ruminal fermentation parameters and cellulase activity of rumen fluid in house-fed yaks
2.4 血清生化指标
由表5可见,B组比A组显著提高了血清中TP和 HDL的含量(P<0.05),而两者血清中ALT、AST活性和 ALB、UN、CHO、TG和 LDL含量差异不显著(P>0.05),但B组有提高血清中GLO含量的趋势(P=0.097)。

表5 发酵酒糟对舍饲牦牛血清生化指标的影响Table 5 Effects of fermented distillers’grains on serum biochemical indices in house-fed yaks
3 讨 论
3.1 发酵酒糟对舍饲牦牛生产性能的影响
采食量是影响动物生产性能的极为重要的方面,而影响采食量的因素较多,包括动物自身喜好、饲粮的适口性、环境条件和饲喂技术等,其中饲粮的适口性影响较大[19]。研究表明,可饲物质经过有益微生物发酵后可形成营养丰富、有益活菌含量高、适口性好的生物饲料,能有效地促进动物采食量和营养物质的吸收利用,从而提高生产性能[20]。贺鸣等[21]研究表明高粱发酵酒糟应用到肉牛饲粮中,DMI和DG比对照组分别提高了0.37%和13.3%。同样,陶忠海等[22]用发酵酒糟生物料+1.5%精料(按体重计算)组成的饲粮饲喂肉牛发现,其DMI和DG分别比对照组提高了10.86%和24.09%,料重比降低了10.67%。而金曙光等[23]将发酵酒糟应用在单胃动物和家禽上的研究也得出相似的结果。本试验的结果表明,发酵酒糟显著提高了牦牛的DMI和增重,这与上述报道一致。原因可能是发酵酒糟的特殊气味改善了适口性从而提高了牦牛的DMI;另外,发酵酒糟中所含有的有益活菌及其代谢产物改善了牦牛瘤胃生物菌群结构,提高了碳水化合物和氨等养分的利用率,加快了体内代谢,从而提高了机体对营养物质的连续性需要;再者,发酵酒糟中的微生物在生长繁殖过程中产生多种生物活性物质如小肽、有机酸和促生长因子等参与机体代谢,产生附加的生物学效应,从而提高动物的生长效率[24-25]。
3.2 发酵酒糟对舍饲牦牛养分表观消化率和瘤胃发酵的影响
有关发酵酒糟对动物养分表观消化率的影响的报道较少,但已有较多关于将饲料原料通过微生物发酵后产生的生物饲料应用于畜禽能提高养分表观消化率的报道,可为本试验结果提供参考。吴小燕等[26]将由酱糟喷浆玉米纤维和糖浆等食品工业副产物,添加乳酸菌、枯草芽孢杆菌和酵母菌等有益微生物发酵而成的微生物发酵饲料应用到奶牛饲粮中,结果表明,微生物发酵饲料能显著提高奶牛纤维类物质的表观消化率。彭忠利等[27]用上述相同的微生物发酵饲料在川中黑山羊的研究中得出了相似的结果。在国外的研究中,也有关于在反刍动物饲粮中添加有益活菌制剂能改变瘤胃发酵模式、增进养分外流速度、提高饲料利用率的报道[28-29]。本试验发现,发酵酒糟提高了牦牛对GE、OM、ADF和NDF的表观消化率,与上述报道相似。原因可能是发酵酒糟本身含有的纤维素酶直接提高了牦牛瘤胃中的外源纤维素酶活性从而提高了瘤胃对纤维物质的分解能力,而本试验发现发酵酒糟显著提高了牦牛瘤胃液纤维素酶活性,这验证了上述结论;另外,除了瘤胃内外源酶活性得以提高外,发酵酒糟还可能通过改善瘤胃微生物菌群结构,让纤维类分解菌成为优势菌群,从而提高了内源酶活性,这得到陈光吉等[30]报道的微生物发酵饲料能提高肉牛瘤胃内黄色瘤胃球菌和白色瘤胃球菌2种主要纤维分解菌的数量的结果的证实。
反刍动物瘤胃液pH作为瘤胃生理状况的反映指标,对瘤胃微生物降解养分特别是碳水化合物起重要作用。本试验中,2组瘤胃液pH在6.42~6.49之间,差异不显著,属于瘤胃发酵的正常值范围(6~7)[31]。说明发酵酒糟添加到饲粮中对牦牛瘤胃健康没有产生不良影响。对于瘤胃液NH3-N含量,作为饲粮含氮物质在瘤胃发酵后的终产物,也是瘤胃微生物合成菌体蛋白的主要氮源,它依赖于动物饲粮的摄入量和组成结构,本试验中,发酵酒糟显著提高了牦牛瘤胃液NH3-N含量,原因可能是DMI的提高增加了牦牛含氮物质的摄入量,而本试验所采用的粗料仅为品质较低的玉米秸秆,其慢速发酵和不可利用的碳水化合物含量较高,从而导致含氮物质在瘤胃中的发酵速度超过了碳水化合物的分解速度,导致瘤胃能氮平衡并不在理想状态,从而促使NH3-N含量升高,并未被瘤胃微生物很快的利用[32]。同样,本试验中,随着DMI的提高,发酵酒糟组瘤胃总挥发性脂肪酸、乙酸和丙酸含量显著升高,为宿主提供了更多的能量,这也就从能量供应量的角度解释了发酵酒糟组日增重较高的原因。但2组乙酸/丙酸及丁酸、异丁酸、戊酸和异戊酸含量差异不显著,表明,发酵酒糟并未改变牦牛瘤胃的发酵类型。
3.3 发酵酒糟对舍饲牦牛血清生化指标的影响
动物血清中的UN含量可以准确的反映动物体内蛋白质代谢和氨基酸之间的平衡状况:较低的血清UN含量表明氨基酸平衡好,机体蛋白质合成率较高[33]。本试验发现,2组牦牛血清中UN含量差异不显著,表明发酵酒糟作为牦牛饲粮主要蛋白质源饲料对动物机体氨基酸平衡状况没有不良影响。这与桑静超[34]在猪上的研究结果一致。血清TP、ALB的含量与机体蛋白质的吸收和代谢状况有关,而血清GLO含量与机体的体液免疫有关。本试验结果表明,发酵酒糟组显著提高了血清TP含量,且有提高血清GLO含量的趋势,说明发酵酒糟提高了牦牛体组成蛋白质的合成作用,同时增强了机体的体液免疫力。这与前人报道基本一致[35-36]。原因可能是部分过瘤胃发酵酒糟所含有的益生菌在肠道定植并激活肠道黏膜的免疫功能,促进小肠淋巴组织集合B细胞增生,增强宿主黏膜的免疫反应,诱导淋巴组织集合的浆细胞产生大量的分泌型免疫球蛋白,进而增强了免疫功能[37]。血清中HDL起着将肝外组织的CHO运送到肝脏的运载工具的作用,因而可以防止游离CHO在肝外组织细胞上的沉积[38]。相反,LDL可携带CHO便积存在动脉壁上。本试验结果表明,发酵酒糟显著提高了血清中HDL含量,而LDL含量变化不显著,这可以解释为何血清中CHO含量没有随着DMI的提高而升高,同时,2组血清TG含量相近,可见,发酵酒糟对牦牛机体脂质代谢有积极的影响,其机理需要进一步研究。同时,2组血清中ALT和AST活性差异不显著,说明发酵酒糟对肝脏和心脏功能没有负面影响。
4 结 论
饲粮中添加9.25%的发酵酒糟:
① 显著提高了牦牛DMI和日增重,降低料重比。
② 显著提高了牦牛对饲粮GE、OM、ADF和NDF的表观消化率。
③ 显著提高了瘤胃液NH3-N、总挥发性脂肪酸、乙酸和丙酸含量及纤维素酶活性,但未影响瘤胃液pH和发酵类型。
④ 显著提高了血清中TP和HDL的含量,有提高血清中GLO含量的趋势。
[1] HIPPEN A R,SCHINGOETNE D J,LINKE P L,et al.Saccharomyces cerevisiae fermentation product in dairy cow diets containing dried distillers grains plus solubles[J].Journal of Dairy Science,2010,93(6):2661-2669.
[2] 刘翠娥.酒糟生物饲料的研制及其育肥出口肉牛的效果研究[D].硕士学位论文.贵阳:贵州大学,2008.
[3] 郭素环,周碧君,文明,等.白酒糟发酵菌种组合的筛选[J].饲料工业,2012,33(15):17-21.
[4] 陈颖,刘君地,朴香淑,等.白酒糟发酵粉对生长猪消化能、代谢能和氨基酸标准回肠消化率的评定[J].饲料工业,2013,34(9):47-52.
[5] LONG R J,D1MG L M,SHANG Z H,et al.The yak grazing system on the Qinghai-Tibetan plateau and its status[J].The Rangeland Journal,2008,30(2):241-246.
[6] LONG R J,ZHANG D G,WANG X,et al.Effect of strategic feed supplementation on productive and reproductive performance in yak cows[J].Preventive Veterinary Medicine,1999,38(2/3):195-206.
[7] 邓由飞,孟庆翔,王淮,等.牦牛生长性能的研究进展[C]//第七届中国牛业发展大会论文集.北京:中国畜牧业协会,2012:350-353.
[8] LONG R J,DONG S K,WEI X H,et al.The effect of supplementary feeds on the bodyweight of yaks in cold season[J].Livestock Production Science,2005,93(3):197-204.
[9] 冯宇哲,刘书杰,王万邦,等.高寒地区放牧牦牛补饲尿素糖蜜营养舔块效果研究[J].中国草食动物,2008,28(3):40-42.
[10] 王威,张建勋,康坤,等.冷季补饲精料对牦牛繁殖性能和生长性能的影响[J].中国畜牧杂志,2013,49(7):78-80.
[11] 梁正满,高永刚,汪磊,等.高寒牧区冷季补饲青贮玉米秸秆对天祝白牦牛体重变化的影响[J].中国牛业科学,2014,40(1):30-32.
[12] 中国农业科学院畜牧研究所,中国农业大学.NY/T 815—2004肉牛饲养标准[S].北京:中国农业出版社,2004.
[13] 杨胜.家畜饲养实验指导[M].北京:中国农业出版社,1982:62-63.
[14] 张丽英.饲料分析及质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[15] VAN SOEST P J,SNIFFEN C J,MERTENS D R,et al.A net protein system for cattle:the rumen submodel for nitrogen[C]//OWENS F N.Protein requirements for cattle:proceedings of an international symposium.Stillwater:Oklahoma State University,1981:265.
[16] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6/7):37.
[17] ISAC M D,GARCÍA M A,AGUILERA J F,et al.A comparative study of nutrient digestibility,kinetics of digestion and passage and rumen fermentation pattern in goats and sheep offered medium quality forages at the maintenance level of feeding[J].Archiv für Tierernaehrung,1994,46(1):37-50.
[18] 汪水平,王文娟.瘤胃纤维降解相关酶活性的测定[J].中国饲料,2006(11):31-32
[19] 杨凤.动物营养学[M].2版.北京:中国农业出版社,2010.
[20] 李维炯,倪永珍,黄宏坤,等.微生态制剂在生态畜牧业中应用效果[J].中国农业大学学报,2003,8(增刊):85-92.
[21] 贺鸣,李胜利.发酵酒糟对肉牛和奶牛生产性能的影响[J].中国饲料,2004(5):24-27.
[22] 陶忠海,方园,方福平,等.酒糟发酵生物料饲喂育肥牛的生长性能及经济效益[J].贵州农业科学,2014,42(3):105-108.
[23] 金曙光,侯先志,赵志恭,等.玉米秸秆加鸡粪、酒糟发酵制作黄贮的研究[J].内蒙古农牧学院学报,1998,19(2):30-36.
[24] 张永根,曲晨,欧建辉.乐能小肽在奶牛饲养中的应用研究[J].中国乳业,2005(2):28-30.
[25] 杜冰,刘贤荣,江守信,等.益生素的应用研究进展[J].中国畜牧兽医,2002,29(5):23-25.
[26] 吴小燕,郭春华,王之盛,等.微生物发酵饲料对泌乳奶牛生产性能和饲粮养分表观消化率的影响[J].动物营养学报,2014,26(8):2296-2302.
[27] 彭忠利,郭春华,柏雪,等.微生物发酵饲料对山羊生产性能的影响[J].贵州农业科 学,2013,41(6):134-137.
[28] SONG M K,SOHN H J.Effect of feeding yeast diets on lactating performance of dairy cows[J].Korean Journal of Animal Science,1997,39(2):184-190.
[29] KREHBIEL C R,RUST S R,ZHANG G,et al.Bacterial direct-fed microbials in ruminant diets:performance response and mode of action[J].Journal of Animal Science,2003,81(14Suppl.2):E120-E132.
[30] 陈光吉,严锦绣,郭春华,等.微生物发酵饲料对肉牛瘤胃液pH值和微生物数量的影响[J].黑龙江畜牧兽医,2015(7):104-107.
[31] NOCEK J E.Bovine acidosis:implications on laminitis[J].Journal of Dairy Science,1997,80(5):1005-1028.
[32] RUSSELL J B,O’CONNOR J D,FOX D G,et al.A net carbohydrate and protein system for evaluating cattle diets:Ⅰ.Ruminal fermentation[J].Journal of Animal Science,1992,70(11):3551-3561.
[33] 严念东,李绍章,魏金涛,等.益生菌发酵饲料对生长育肥猪生长性能及部分血液生化指标的影响[J].饲料工业,2010,31(3):30-32.
[34] 桑静超.混菌固态发酵饲料对生长猪生产性能、血清生化指标及粪中微生物菌群的影响[D].硕士学位论文.郑州:河南农业大学,2014.
[35] 余淼,严锦绣,彭忠利,等.微生物发酵饲料对肉牛免疫机能的影响[J].中国畜牧兽 医,2013,40(4):114-117.
[36] 胡新旭,周映华,刘惠知,等.无抗发酵饲料对断奶仔猪生长性能、肠道菌群、血液生化指标和免疫性能的影响[J].动物营养学报,2013,25(12):2989-2997.
[37] 张腾飞.无抗生素发酵饲料对猪免疫功能的影响[J].中国畜牧兽医文摘,2011,27(5):180.
[38] 庄庆祺.高密度脂蛋白[J].生理科学进展,1982,13(1):81-83.

