红菇色素超声波提取及其稳定性和抗氧化性研究*
庞庭才,胡上英,甘红
1(钦州学院食品工程学院,广西钦州,535099)2(钦州学院电子与信息工程学院,广西钦州,535099)
红菇(Russula)属真菌属担子菌亚门、层菌纲、红菇目、红菇科。国际上已报道的红菇属真菌有 300多种,我国有记载的90余种,其中多数可食用且具有药用功能[1]。长期以来被作为一种名贵的药食兼用真菌,具有补血壮体、延缓衰老、养血养颜、防癌抗癌、降低胆固醇等多种保健功效[2-4]。红菇色素是一种水溶性红色色素,它既是某些红菇种的特征之一,也是红菇分类鉴定的重要依据。已有研究表明,正红菇的色素由红紫色素和黄色素2个组分组成,其中红紫色素的结构特点含有较高比例的—OH和双键[5]。Froede等[6]从淡黄红菇(R.flavida)中发现一种新型的三萜醌甲基色素。当前对天然色素的提取方法主要有:溶剂浸提法、酶提取法、超临界流体萃取法、超声波提取法、微波提取法。超声波提取技术作为一种新兴的应用技术,近年来已被广泛应用于某些天然成分的提取[7],与传统的溶剂提取法相比,具有操作简便快捷、速度快、提取率高等明显的优点[8]。目前,利用超声波辅助提取红菇色素及其稳定性和抗氧化性研究尚未见报道。本文以野生红菇为原料,采用超声波辅助提取红菇色素,通过单因素试验和正交试验优选最佳工艺参数,并对红菇色素在不同温度、光照、食品添加剂以及常见金属离子等存在下的稳定性以及对羟自由基、超氧阴离子自由基和DPPH自由基的清除能力进行了研究。
1 材料与方法
1.1 材料与仪器
红菇,购于钦州市浦北县;无水乙醇、浓 HCl、NaOH等,均为分析纯。
JY98-IIIDN超声波破碎仪,宁波新芝生物科技股份有限公司;HH-4数显恒温水浴锅,金坛市科析仪器有限公司;EL204电子天平,梅特勒-托利多(上海)有限公司;ERZ-A5110A鼓风干燥箱,上海智诚分析仪器制造有限公司;UV-3200紫外可见分光光度计,上海美谱达仪器有限公司;H1850台式离心机,湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 操作要点
1.2.1.1 原料预处理
将红菇清理后,置于80℃烘干,粉碎并过100目筛,于干燥处保存备用。
1.2.1.2 最大吸收波长的选择
称取1.0 g红菇粉置于50 mL烧杯中,加入20 mL pH值为3的体积分数75%乙醇浸没,超声提取30 min,抽滤后取5 mL滤液定容至50 mL容量瓶中,在190~600 nm内进行扫描,确定红菇色素最大吸收波长。
1.2.2 红菇色素最佳提取工艺条件的确定
1.2.2.1 料液比的测定
在乙醇体积分数45%、超声波功率300 W、提取时间30 min的条件下,考察不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g∶mL),对红菇色素提取率的影响。
1.2.2.2 超声波时间的选择
在料液比1∶20(g∶mL)、乙醇体积分数45%、超声波功率300 W的条件下,考察不同超声波时间(20、30、40、50、60 min),对红菇色素提取率的影响。
1.2.2.3 乙醇浓度的选择
在料液比1∶20(g∶mL)、超声波功率300W、提取时间30min的条件下,考察不同体积分数(35%、45%、55%、65%、75%)乙醇溶液,对红菇色素提取率的影响。
1.2.2.4 超声波功率的选择
在料液比1∶20(g∶mL)、乙醇体积分数45%、提取时间30 min的条件下,考察不同超声波功率(350、400、450、500、550 W),对红菇色素提取率的影响。
1.2.3 正交试验设计
根据单因素试验结果,选择一定料液比、超声时间、乙醇浓度、超声功率作为试验因素,采用L16(45)正交表进行实验设计,确定红菇超声提取的最佳工艺条件。正交试验因素与水平设计见表1。

表1 正交试验因素与水平Table 1 Factors and levels of the orthogonal experiment
1.2.4 提取率的计算
在最佳提取条件下,分别多次提取一定量的红菇,直到提取液的吸光度值为基本为零,可认为已经把红菇色素全部提出。收集各次提取液,并测定第一次体积(V1)和吸光度(A1),然后合并各次提取液,测出其总体积(V总)和总吸光度(A总)[9]。
提取率的计算公式为:
提取率 /%=[V1×A1/(V总×A总)]×100(1)
1.2.5 红菇色素的稳定性研究
1.2.5.1 温度对色素稳定性的影响
取等量的红菇色素稀释液5 mL,分别在30、40、60、80、100℃下采用冷凝回流法,水浴20 min后冷却至室温,在波长201 nm处测其吸光度。
1.2.5.2 光照对色素稳定性的影响
取等量的红菇色素稀释液5 mL,分别置于黑暗、自然光照射条件下静置5 d,每天在波长201 nm处测定吸光度。
1.2.5.3 两种食品添加剂对色素稳定性的影响
取等量的色素稀释液5 mL,分别加入质量分数为1%、5%、10%、20%、30%的葡萄糖、柠檬酸各2 mL,静置1 h,在波长201 nm处测定吸光度。
1.2.5.4 金属离子对色素稳定性的影响
取等量的色素稀释液5 mL,分别加入不同浓度的金属离子 Na2+、K+、Cu2+、Mg2+、Zn2+、Ca2+溶液,金属离子的浓度为 0.001、0.005、0.010、0.050、0.100 mol/L,静置1 h,在波长201 nm处测其吸光度。
1.2.6 红菇色素的抗氧化性研究
1.2.6.1 清除羟自由基(·OH)活性测定
在15 mL的具塞试管中分别加入1 mL 6 mmol/L FeSO4溶液,1 mL 6 mmol/L的水杨酸-乙醇溶液,再分别加入 1 mL 不同浓度(0.1、0.15、0.20、0.25、0.30 mg/mL)红菇色素溶液,最后加入1 mL H2O2启动反应,37℃水浴反应30 min后,8 000 r/min离心5 min,取上清液在510 nm处测定吸光度,以蒸馏水代替H2O2作为对照组,以蒸馏水代替样品作为空白[10]。
·OH清除率/%=[A0-(Ai-Ai0)/A0]×100
式中:Ai,为样品组;Ai0,以蒸馏水代替H2O2的对照组;A0,以蒸馏代替样品的空白。
1.2.6.2 清除超氧阴离子自由基(O2-·)活性的测定
取4.5 mL Tris-HCl缓冲液,加入不同浓度(0.02、0.04、0.06、0.07、0.10 mg/mL)的红菇色素溶液2 mL在25℃恒温水浴中放置20 min后,加入0.3 mL的25℃预热的邻苯三酚溶液,振荡器混匀,在25℃水浴中反应4 min,加入6 mol/L HCl终止反应,在325 nm测吸光度,以蒸馏水作为对照,计算样品对O2-·的清除率[11]。
O2-·清除率/%=V对照-V样品/V对照×100
式中:V样品,加入样品后邻苯三酚自氧化速率;V对照,加入蒸馏水后邻苯三酚自氧化速率。
1.2.6.3 清除二苯代苦味酰基自由基(DPPH·)活性的测定
量取 2 mL 不同浓度(0.02、0.04、0.06、0.08、0.10 mg/mL)的红菇色素溶液,分别加入2 mL的DPPH溶液,避光反应30 min后在517 nm处测定吸光度,以2 mL的样品溶液加入2 mL的无水乙醇作对比,以2 mL的DPPH溶液加入2 mL蒸馏水中作为空白,计算对DPPH自由基的清除率[12]。

式中:Ai,DPPH溶液+样品溶液的吸光度值;Ai0,样品溶液+无水乙醇的吸光度值;A0,DPPH溶液+蒸馏水。
2 结果与分析
2.1 最大吸收波长的确定

图1 红菇色素的紫外可见光光谱图Fig.1 Absorption spectrum of the pigment from Russula
以红菇色素吸收的波长为横坐标,以不同波长下的吸光度为纵坐标,在不同波长下的吸光度如图1所示,可知红菇色素最大吸收波长为201 nm。
2.2 红菇色素最佳提取工艺条件的确定
2.2.1 料液比的确定
由图2可知,料液比为1∶10时,红菇色素提取率为45.05%,随着液料比的增大,料液比1∶30时提取率达到最大值(61.45%),之后随着料液比增至1∶50时,提取率反而有所降低(58.05%)。这是因为化学位差(浓度差)是该过程的推动力[13]。一方面,随溶剂用量的增加,红菇粉末与溶剂的接触界面增大,从而提高了传质的效率,使得红菇色素提取完全;另一方面,溶剂的量过大时将红菇内多糖等其他物质也浸提出来,从而影响了红菇色素的提取。因此,从节约成本等方面考虑,选取的料液比为1∶30(g∶mL)。
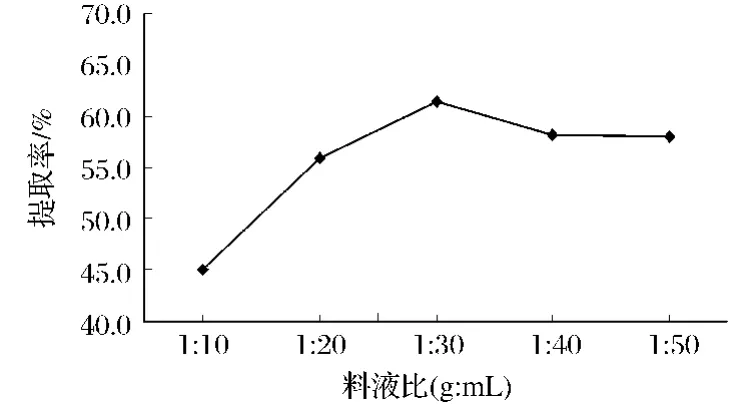
图2 料液比对红菇色素提取效果的影响Fig.2 Effect of the liquid-solid ratio on the absorption
2.2.2 超声时间的确定
由图3可知,超声时间为20 min时,红菇色素提取率为48.33%,随着超声时间的延长至50 min,提取率达到最大值(64.46%),之后随着超声时间继续增加,提取率反而出现明显的下降趋势。这可能是因为红菇色素在50 min之前基本都溶出,随着时间的延长,色素的积累越来越多,但超过50 min,超声波的空化作用和长时间的高温破坏了色素的结构,使吸光度减小[14]。因此,选择超声提取时间为50 min。

图3 超声时间对红菇色素提取效果的影响Fig.3 Effect of ultrasonic application time on the absorption
2.2.3 乙醇浓度的确定
从图4可知,乙醇体积分数35%时,红菇色素提取率为55.86%,随着乙醇浓度的增加,乙醇体积分数45%时提取率达到最大值(61.06%),之后随着乙醇浓度继续增大,红菇色素提取率则逐渐下降,当乙醇体积分数75%时,提取率最低达到50.89%。这是因为色素是有一定极性的化合物,根据相似相溶原理,当提取剂的极性与此色素的极性更加接近时,吸光度就最大[15];反之则逐渐减小。因此,乙醇体积分数选择为45%。
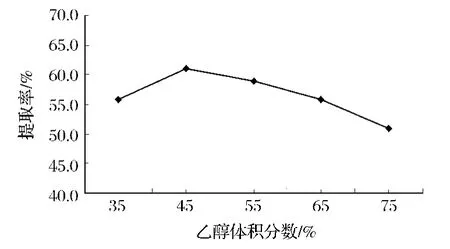
图4 乙醇浓度对红菇色素提取效果的影响Fig.4 Effect of ethanol concentration on the absorption
2.2.4 超声功率的确定
由图5可知,超声功率在350~450 W时,随着超声功率的增大,红菇色素提取率从54.03%增至63.91%(最大值);当超声功率为450 W之后,提取率则呈明显下降趋势。这是由于超声功率过高,超声波对红菇的组织结构产生了破坏作用,使色素的构象发生改变;同时由于超声功率过高,超声波的热效应导致提取溶液温度升高,造成色素不稳定而部分分解[16],使红菇色素浸提液的提取率降低。因此,超声功率选择为450 W。
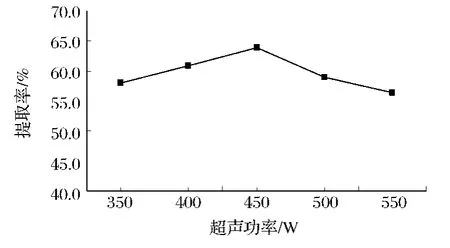
图5 超声功率对红菇色素提取效果影响Fig.5 Effect of ultrasonic application power on the absorption
2.3 正交试验结果与分析
根据单因素试验结果,选择料液比、乙醇浓度、超声功率和超声时间4个因素,进行L16(45)正交试验设计,以确定最佳工艺条件。
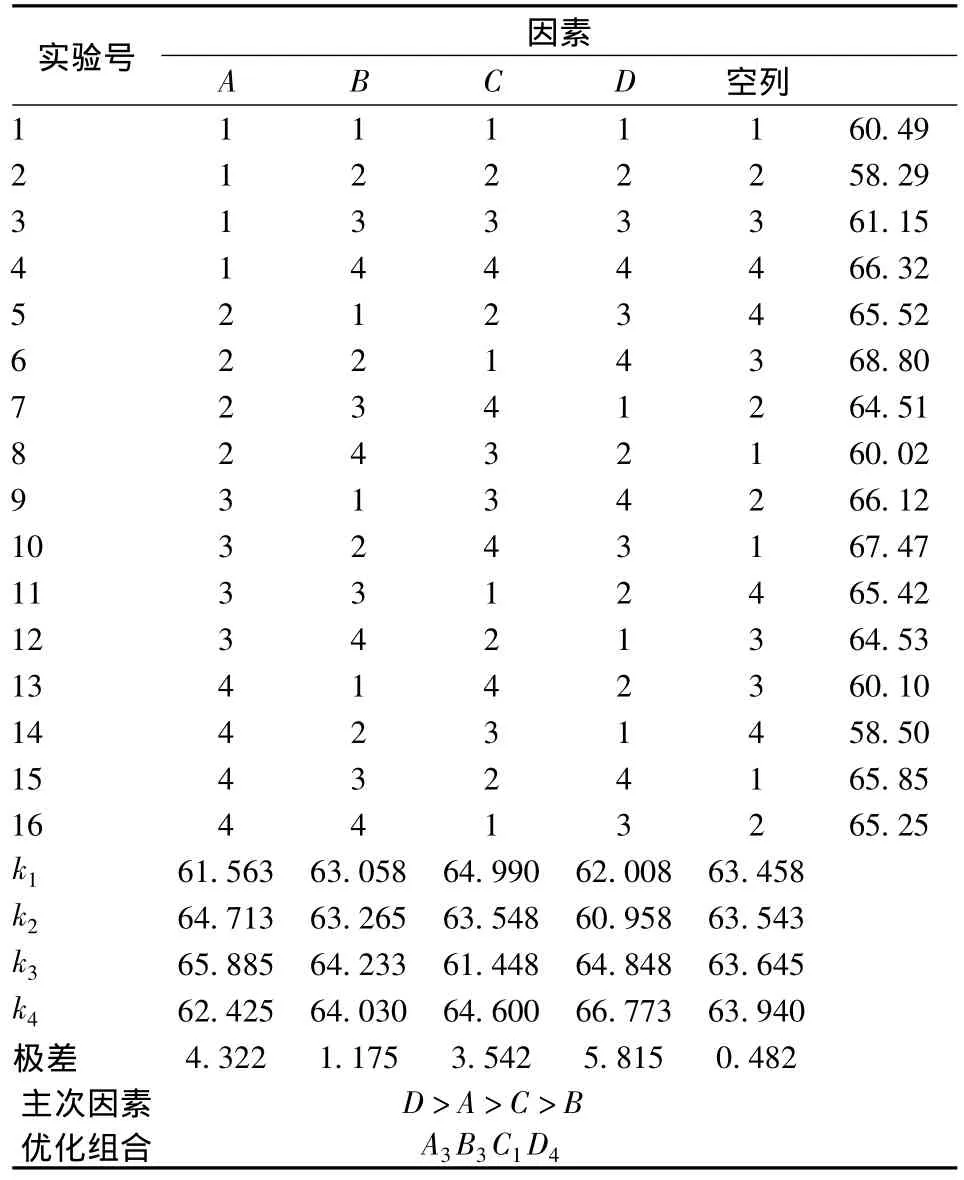
表2 正交试验结果与分析Table 2 Results and analysis of orthogonal test
由表2可知,各因素对实验结果影响的主次顺序为:超声功率(D)>料液比(A)>乙醇浓度(C)>超声时间(B),最佳工艺参数为A3B3C1D4,即料液比1∶40(g∶mL),超声时间60 min,乙醇体积分数45%,超声功率550 W。在此条件下进行最优方案的验证实验,得到红菇色素提取率为69.35%。

表3 方差分析表Table3 Analysis of various
为各因素对红菇色素提取效果的影响进行方差分析,由表3知,料液比(A)、乙醇浓度(C)、超声功率(D)对超声波辅助提取红菇色素的影响达到了显著的水平(P<0.05),表明料液比、乙醇浓度、超声功率是影响红菇色素提取的最主要影响因素;超声时间(B)对红菇色素提取效果的影响不显著(P>0.05)。
2.4 红菇色素的稳定性研究
2.4.1 温度对红菇色素稳定性的影响
由图6可知,30~60℃时,吸光度随着温度的升高从0.683增至0.793;60~100℃时,吸光度从0.793急剧降至0.479,可以明显看出高温对色素有显著的破坏作用。这因为在某一温度范围内,随着温度的升高,有利于分子的运动和色素在各相中的传质,从而使更多的色素溶解,但当温度超过60℃时,较高的温度会导致色素的分解,不利于更多的色素溶于提取剂[17]。因此,红菇色素应该在较低温度下保存和使用。

图6 温度对红菇色素稳定性的影响Fig.6 Effect of temperature on stability of Russula pigments
2.4.2 光照对红菇色素稳定性的影响
由图7可知,在黑暗、自然光条件下,放置5 d的红菇色素吸光度均有所下降,但在黑暗条件下1~5 d的红菇色素溶液的吸光度从0.528下降至0.460,整体下降幅度较小,其颜色也几乎没有变化;而在自然光照射条件下,该色素溶液的吸光度在2 d内迅速下降至0.316,颜色褪色较为明显,之后下降趋势稳定。由此可见,该色素应该在避免光照条件下进行生产、保存和使用。

图7 光照对红菇色素稳定性的影响Fig.7 Effect of light on stability of Russula pigments
2.4.3 食品添加剂对色素稳定性的影响
由图8可知,食品添加剂葡萄糖对红菇色素吸光度的影响比较小,而随着柠檬酸浓度的增加,吸光度逐渐降低,原因是柠檬酸对色素具有减色作用且随着浓度的增加而逐渐增强。因此,表明在不同浓度葡萄糖条件下,红菇色素仍可以稳定存在;而当柠檬酸浓度超过5%时,红菇色素的稳定性较差。
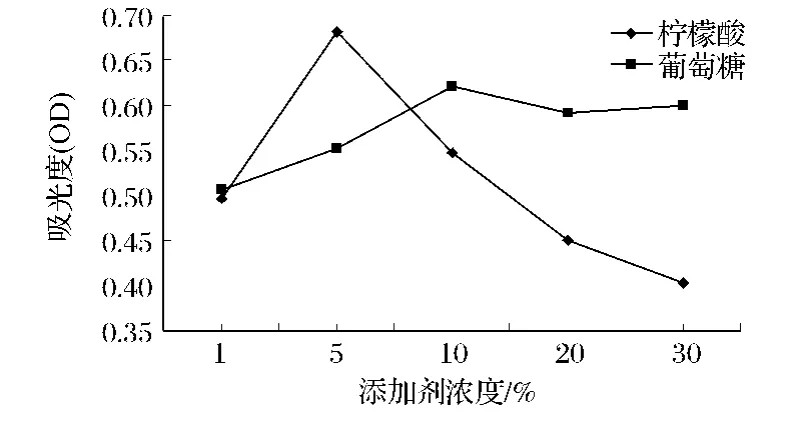
图8 食品添加剂对红菇色素稳定性的影响Fig.8 Effect of food additives on stability of Russula pigments
2.4.4 金属离子对色素稳定性的影响

图9 金属离子对红菇色素稳定性的影响Fig.9 Effect of metalions on on stability of Russula pigments
由图9可知,不同浓度的金属离子对红菇色素的稳定性有不同程度的影响,其中,不同浓度K+、Cu2+对红菇色素的稳定性影响较大,Mg2+、Zn2+、Ca2+浓度在超过0.010 moL/L时对红菇的稳定性影响较大,而Na+对红菇色素的稳定性影响均较小。这可能是这些金属离子与红菇色素中的某个基团结合后,可使色素的结构更加稳定,并且具有相当大的增色效果[18]。说明在红菇色素生产和使用过程中要尽量避免含铜、镁等容器接触,以及对溶剂中的钾、锌、钙含量的要求也比较高。
2.5 红菇色素的抗氧化性
2.5.1 羟自由基(·OH)的清除
由图10可知,红菇色素对羟自由基有较强的清除作用,清除率随着色素浓度的提高而增大。当红菇色素溶液浓度达到0.1 mg/mL时其清除率为43.2%,而当其浓度为0.3 mg/mL时,其清除率达68.5%,表明了红菇色素表现出了较好的清除羟自由基的效果。

图10 红菇色素对羟自由基清除作用Fig.10 Scavenging effects of Russula pigment on hydroxy radical
2.5.2 超氧阴离子自由基(O2-·)的清除
由图11可知,红菇色素对邻苯三酚自氧化具有较强的抑制作用,超氧阴离子自由基清除率随色素浓度的增加而升高,但当浓度增大到一定值时,清除率的变化幅度会变小。红菇色素在此体系表现出很好的清除超氧阴离子自由基的作用,当其浓度为0.1 mg/mL时,对超氧阴离子自由基的清除率达82.3%。

图11 红菇色素对超氧阴离子自由基清除作用Fig.11 Scavenging effects of Russula pigment on superoxide anion radical
2.5.3 DPPH·的清除
由图12可知,红菇色素溶液具有一定的清除DPPH自由基的能力,清除率随浓度的增大而增大,当红菇色素溶液浓度0.02 mg/mL时,清除率就达13.3%,而当红菇色素浓度达到0.1 mg/mL时,清除率就达43.2%,说明红菇色素能有效的清除DPPH自由基。

图12 红菇色素对DPPH自由基的清除作用Fig.12 Scavenging effects of Russula pigment on DPPH radical
4 结论
(1)红菇色素为浅红色,溶于酸性乙醇,最大吸收波长为201 nm。根据单因素试验和正交试验得出最佳提取工艺条件:料液比1∶40(g∶mL),超声时间60 min,乙醇体积分数45%,超声功率550 W。
(2)红菇色素光稳定性较差,60℃以下比较稳定;葡萄糖对红菇色素稳定性的影响较小,而随着浓度的增加,柠檬酸对红菇色素稳定性的影响明显增大,说明柠檬酸对色素的减色作用明显;不同浓度的金属离子对色素稳定性有显著影响。
(3)红菇色素对羟基自由基、超氧阴离子自由基、DPPH自由基均具有良好的清除作用。
[1] 周新萍,芦琴,王小平,等.红菇研究进展[J].食用菌,2010,32(10):1-2.
[2] 陈旭健,张原琪.红菇多糖的提取及其降血糖、血脂作用研究[J].食品科学,2010,31(9):255-258.
[3] 甘耀坤,陈晓白,曾诗媛,等.红菇提取液抗运动性疲劳作用的研究[J].食用菌,2010,32(1):66-67.
[4] 赵丰丽,张云鸽,宁良丹.红菇多糖的提取分离及其抗氧化活性的研究[J].中国酿造,2009,28(11):98-101.
[5] 孙灵慧,钱珍,刘晓宇.白灵菇和红椎菌的成分分析研究[J].食品科技,2009,34(11):101-104.
[6] Rita Froede,Martin,Bert,et al.A novel type of triterpenoid quinone methide pigment from thr toadstool Russula flavida(Agricales)original research article[J].Tetrahedron,1995,51(9):2 553-2 560.
[7] 荀兰,郁建平.超声辅助提取樱花色素工艺优化[J].食品工业科技,2013,4(4):256-258,262.
[8] 张广文,李爱梅,葛婧,等.正交试验优化超声波辅助乙醇法提取米团花黄色素工艺[J].食品科学,2013,34(10):27-30.
[9] 阳晖,曾召银.超声波辅助法提取胭脂萝卜色素的工艺研究[J].食品工业科技,2012,33(24):325-328.
[10] 李艳梅,李国银,赵福顺,等.玫瑰香葡萄皮色素的提取及其抗氧化活性研究[J].食品工业科技,2011,32(7):164-177.
[11] 杨晓玲,郭彦东.野豌豆花色素的体外抗氧化性及抑菌性[J].食品科学,2012,33(33):129-132.
[12] BIAO S W,BIAN S L,QING X Z,et al.Antioxidant and free radical scavenging activities of pigments extracted from molasses alcohol wastewater[J].Food Chemistry,2008,107:1198-1204.
[13] 闫宁环.黑莓色素超声波提取、纯化及特性研究[D].咸阳:西北农林科技大学,2007.
[14] 余昆,李勇,陈玲,等.响应面分析法优化枸杞皮渣中色素的超声波辅助提取工艺[J].食品工业科技,2013,34(2):299-302.
[15] 谢秋涛,李高阳.超声波辅助乙醇提取法提取玫瑰色素[J].食品与机械,2012,28(3):148-150.
[16] 孙海涛,邵信儒.超声波辅助提取刺五加浆果色素工艺优化[J].食品科学,2011,32(22):109-113.
[17] 张瑞,邢军,毛居代·亚尔买买提,等.红苋菜天然红色素的提取及其稳定性[J].食品与发酵工业,2013,39(1):208-214.
[18] 卜晓英,陈晓华,麻明友.野生异叶爬山虎果皮红色素提取及稳定性研究[J].食品科学,2010,31(2):17-21.

