啤酒花抗性机制的研究进展
李宪臻, 王 伟, 蒋宝航, 杨 超, 孙 珍, 堵国成
(1.江南大学 生物工程学院,江苏 无锡 214122;2.大连工业大学 生物工程学院,辽宁 大连 116034)
·大家专版·
啤酒花抗性机制的研究进展
李宪臻1,2, 王 伟1,2, 蒋宝航2, 杨 超2, 孙 珍2, 堵国成1
(1.江南大学 生物工程学院,江苏 无锡 214122;2.大连工业大学 生物工程学院,辽宁 大连 116034)
酒花苦味酸是构成啤酒风味的重要组分,也是啤酒生产过程中的天然抑菌剂,酒花苦味酸通过降低pH梯度而抑制啤酒花敏感菌生长。研究发现,啤酒花抗性菌是通过膜上转运蛋白将酒花苦味酸泵出细胞外,以降低膜上的质子流速,维持了细胞内的pH梯度。结合近年来酒花抗性相关研究结果,讨论了细胞膜上酒花抗性相关组分与酒花抗性间的关系,提出了酒花抗性机制的模型。
啤酒;啤酒花;啤酒微生物;污染;苦味酸;酒花抗性
啤酒是一种微生物稳定性饮料,但这并不能保证啤酒不被微生物污染,事实上,啤酒生产过程中常伴有某些特殊微生物污染,这些微生物的一个典型特征是具有啤酒花抗性[1]。虽然啤酒花抗性机制还不是很清楚,但大量研究已经开始关注酒花抗性机制,本文对该领域研究的最新进展进行综述。
1 啤酒花抑制微生物生长机制
啤酒花是一种含有复杂组分的天然产物,其中的α-酸由3种同系物组成、β-酸含有5种同系物,都是弱酸,较难溶于水[2]。异α-酸是影响啤酒微生物生长的主要因素,pKa为3.0,是在麦汁煮沸过程中由 α-酸异构化形成的,与α-酸和β-酸合称为酒花苦味酸[3-4]。
酒花苦味酸是啤酒酿造中的天然杀菌剂,通过破坏细胞跨膜pH梯度而抑制微生物生长[5]。但是,这种pH梯度破坏不是因为抑制了ATP产生或质子转运ATPase酶活性,而是由于酒花苦味酸可自由过膜进入细胞,导致质子跨膜梯度破坏,因此,酒花苦味酸被定义为质子载体[6]。酒花苦味酸的杀菌作用是由于其作为质子载体,通过破坏影响质子移动势(Proton motive force, PMF)的跨膜pH梯度,使胞内pH降低而影响细胞营养转运和代谢过程,进而抑制啤酒花敏感菌的生长[7]。
微生物的啤酒花抗性具有种间差异性,即使是同一种菌,也并非全部菌株都具有啤酒花抗性[8]。Schurr等[6]研究了酒花苦味酸抗微生物活性的分子机理以及质子载体活性与锰结合上调抑制能力的关系。啤酒花化合物的关键成分是弱酸,为响应细胞跨膜pH梯度,能以未解离酒花苦味酸Hop-H形式通过细胞质膜进入细胞[7,9],在胞内高pH环境下解离为酒花阴离子Hop-和质子H+,Hop-在细胞内捕捉到二价阳离子如Mn2+,并与之结合形成Hop-Mn-Hop复合物后,扩散出细胞,通过细胞质膜上的H+/Mn2+交换产生质子流。所释放的质子H+降低了胞内pH并导致跨膜pH梯度散失和质子移动势PMF降低[7,9],结果妨碍了细胞内必需的生理代谢,阻碍了PMF-驱动的营养吸收,使细胞死亡[9]。所以,啤酒花抑制是由于酒花苦味酸作为质子载体,将质子H+与胞内二价阳离子(如Mn2+)交换,驱散了跨膜pH梯度,降低了质子驱动力PMF,导致啤酒花敏感菌株细胞死亡[7],为此,可以将啤酒花抑制微生物生长的机制总结如图1所示。

图1 啤酒花敏感菌的酒花抑制模型Fig.1 Hop inhibiting mechanism in hop-sensitive bacteria
锰等二价阳离子在啤酒花的抑制机制中具有非常重要的作用,在啤酒花胁迫环境中,胞内的二价阳离子Mn2+等与解离的酒花阴离子Hop-结合后渗出细胞,导致胞内二价阳离子浓度下降,从而使细胞代谢速度逐渐降低[10]。事实上,啤酒花胁迫抗性机制就是处理胞内酸化和能量产生的机制,在酒花苦味酸胁迫条件下,除了ATP能量降低和PMF消散,胞内二价阳离子库的耗尽也是酒花胁迫的一个开关因子,使调控潜力消失,但啤酒花抗性细胞则能够通过代谢变化和细胞壁成分改变等绕过或补偿调控潜力的不足[10]。所以,影响酒花苦味酸抑菌活性的主要因素是pH值和酒花结合到阳离子上的能力,低pH值能够提高未解离酒花苦味酸在细胞质膜上的容量,作为弱酸调节质子流,而锰的作用是使解离的酒花苦味酸从膜内返回到膜外,释放二价离子并将另一个质子转运到胞内[11]。
2 影响啤酒花抗性机制的膜组分
啤酒花抗性是多因子性状,但迄今仅有少数膜组分被发现与酒花抗性有关,如horA、horB、horC和hitA等基因编码的膜蛋白[12]。由于啤酒花是通过质子载体功能破坏细胞跨膜pH梯度和降低质子移动势PMF,所以这些基因编码的膜转运蛋白将酒花苦味酸泵出胞外以防止其在胞内空间积累,赋予微生物细胞啤酒花抗性。但是,这些啤酒花抗性相关基因并非存在于所有啤酒花抗性微生物细胞中,且其表达水平也因抗性菌株和啤酒花浓度等不同而有所差异[12],表达双基因的细菌明显快于表达单基因细菌的生长速度[13]。
2.1 ATP-/PMF-依赖多药抗性转运蛋白HorA和HorC
Sami等[14]首先在Lactobacillusbrevis啤酒花抗性突变株中发现有3个与啤酒花抗性相关的基因horA、horB和horC,几乎存在于所有啤酒腐败乳酸菌中,并赋予乳酸菌啤酒花抗性。
基因horA编码膜上ATP-依赖多药抗性转运蛋白,属于ATP结合盒超级家族,含有1个ATP-结合结构域、6个跨膜结构域、1个位于细胞质中的ATP结合盒转运蛋白保守序列,起多药抗性泵的作用,在啤酒花苦味酸存在时,HorA能将胞内积累的酒花苦味酸或其他毒性分子由胞内排出细胞外[15]。
另外一个基因horC属于抗瘤细胞分裂超级家族,也编码一个多药抗性转运蛋白[15],但与HorA相反,HorC不是ATP-依赖型的,它能利用质子移动势PMF驱动,将酒花苦味酸外排,其表达水平受转录调控子HorB控制[16]。与horA基因一样,也含有1个ATP结合结构域和6个跨膜结构域,因为典型的ATP结合盒转运蛋白有2个ATP结合结构域和2套跨膜结构域,因此HorA和HorC也叫半转运蛋白。
基因horA和horC不是缺乏酒花苦味酸时生长所必需的,因此不是啤酒腐败菌的天生遗传因素。当在渐降啤酒花浓度的培养基中亚培养啤酒腐败菌时,很多啤酒腐败乳酸菌会自发丢失啤酒腐败能力,并与horA和horC基因的丢失相伴随[15]。因此,HorA和HorC的功能是降低未解离酒花苦味酸进入细胞质膜的流速。
2.2 二价阳离子转运蛋白HitA
Hayashi等[11]首次提出基因hitA编码蛋白是酒花抗性的调节因子,在啤酒花抗性中的作用是作为二价阳离子转运蛋白,将胞内二价阳离子Mn2+等泵出细胞外,通过与胞内二价阳离子如Mn2+交换酒花苦味酸的质子,实现质子H+和Mn2+在膜上的交换,从而降低了跨膜二价阳离子梯度。
2.3 质子转运H+-ATPase酶
由于较高的胞内pH值,当酒花苦味酸进入细胞后发生解离而释放质子H+,驱散了跨膜pH梯度,因此,当遭遇高质子流时,微生物会增加其在细胞质膜中的质子移动势PMF,提高将质子排出胞外的速度[7]。事实上,啤酒花抗性微生物确实保有比啤酒花敏感菌更高的跨膜pH梯度,而且一旦适应酒花苦味酸,啤酒花抗性菌中的质子转运H+-ATPase酶活性就会增加[6],因此,膜上质子转运H+-ATPase酶的功能是通过排出质子以抵消酒花苦味酸的质子转运作用,协助啤酒花抗性菌维持跨膜pH梯度。实验也证实,当啤酒花抗性突变株适应酒花苦味酸后,质子转运H+-ATPase酶的表达量增加[6]。而当适应啤酒花胁迫的细胞在没有酒花苦味酸存在时进一步培养后,则H+-ATPase酶活性和表达水平又下降到适应前水平[6],因此由H+-ATPase驱动的质子泵是抗酒花苦味酸的重要因子。
2.4 ATP生成系统
无论是HorA与HorC多药抗性转运蛋白,还是质子转运H+-ATPase酶,都需要通过消耗能量以破坏pH梯度的方式增加啤酒花抗性。但是啤酒是一种营养贫乏培养基,难以支持细胞生理代谢,而酒花苦味酸的质子转运反应又抑制了细胞的营养吸收,说明啤酒花抗性菌还有其他ATP产生途径[17]。事实上,啤酒花抗性菌能够通过消耗啤酒中的柠檬酸、丙酮酸、苹果酸和精氨酸等进行生长,并产生大量ATP[17],其中,苹果酸进入细胞经脱羧反应产生乳酸和CO2后,排出胞外而形成质子移动势PMF,导致ATP合成;在柠檬酸代谢过程中,通过柠檬酸阴离子单相运输和质子消耗形成质子移动势PMF,产生ATP;丙酮酸在糖代谢途径中通过形成乙酰磷酸高能化合物产生ATP;精氨酸脱亚胺酶途径广泛存在于乳酸菌,当精氨酸被代谢为鸟氨酸、CO2和氨时产生ATP。虽然酒花苦味酸抑制营养吸收,但却未发现大幅抑制上述物质的吸收,因为它们并不依靠跨膜pH梯度进行运输。
2.5 磷壁酸
酒花苦味酸的靶点是细胞膜,在酒花苦味酸胁迫下,由于膜脂组分的变化,降低了酒花苦味酸的膜渗透能力[18]。磷壁酸是存在于细胞壁S-层蛋白下的一种与酒花抗性相关的表面特征结构,半乳糖苷基甘油磷壁酸能增加细胞壁对酒花苦味酸的过膜障碍,抑制酒花苦味酸进出细胞[6,18]。研究发现,在啤酒花抗性菌细胞壁中有半乳糖基甘油磷壁酸存在,而酒花适应啤酒腐败菌细胞壁中磷壁酸的含量也有明显增加,且酒花抗性突变株细胞膜上的ATP能量池和ATPase酶活性也是增加的[19]。
3 多药抗性转运蛋白
微生物抵抗毒性化合物反应和快速适应周围环境变化的能力,很大程度上是由于药物抗性系统的强化表达,专一性使一种或一组密切相关药物失活[20]。预防药物进入细胞的通用策略,是通过多药抗性膜转运蛋白消耗代谢能量,逆浓度梯度将药物跨膜排出。根据跨膜运输所偶联的能量模式,可将多药抗性转运蛋白分为两类[21]:属于ATP结合盒超级家族的ATP-驱动转运蛋白、质子移动势PMF-驱动的第二转运蛋白。后者是作为药物/H+逆向转运蛋白发挥功能,依据其氨基酸序列同源性又可进一步分为主要促进家族MFS、小多药抗性家族SMR、抗瘤细胞分裂家族RND、多药和毒性化合物排泄家族MATE[20]。
ATP结合盒超级家族含有参与吸收或分泌的各种转运蛋白,也包括不参与转运但在细胞过程中发挥作用的ATPase酶,是一种与广范围底物吸收和分泌相关的膜蛋白,参与营养吸收、外源性保护、细胞废弃物排泄、渗透胁迫、脂质转运、生物合成过程中的大分子排出等[21]。
以Lactococcuslactis啤酒腐败菌为例,膜上有3种转运蛋白。LmrA是ATP结合盒家族的同型二聚体,LmrCD是ATP结合盒家族的异型二聚体,LmrP是主要促进家族MFS的第二转运蛋白。LmrA被称为乳球菌多药抗性蛋白[22],LmrA的表达能够赋予E.coli抗多种抗生素能力。LmrC和LmrD是由同一个小操纵子上的基因编码的2个ATP结合盒转运蛋白,能够被分离为一个具有较高内源ATPase酶活性的化学复合物[23]。
4 啤酒花抗性机制模型
迄今,已经有多种啤酒花组分抑制机理被报道,包括细胞壁渗透性改变、细胞质泄露及随后的DNA、RNA、蛋白质合成抑制、亮氨酸吸收和质子载体活性变化等[9],所有这些抑制作用都与胞内pH值、二价阳离子如Mn2+等密切相关。
研究发现,当在Lactococcuslactis菌中表达外源horA基因时,可以将酒花抗性提高1倍,说明酒花抗性受HorA蛋白调控,并证实HorA能够从膜上分泌亲脂性酒花化合物到细胞外[24],因此,HorA膜转运蛋白能通过消耗ATP将酒花苦味酸泵出细胞,以恢复跨膜pH梯度。
当将缺失HorA的L.brevis菌置于酒花苦味酸环境中时,发现仍具有酒花抗性,这是因为酒花苦味酸作为质子载体在进入细胞过程中,使质子移动势PMF增加,带动PMF-驱动的HorC转运蛋白在缺失HorA的条件下,将酒花苦味酸泵出细胞,解除对跨膜pH梯度驱散的危害[15]。
但是,HorA和HorC的转运活性会引起酒花苦味酸进入细胞质的质子流降低,从而限制PMF-驱动的酒花苦味酸驱散作用。然而,L.brevis菌的抗性能够响应很高的啤酒花浓度,因此,功能性表达HorA和HorC不足以赋予其这种高啤酒花抗性[17]。事实上,L.brevis菌强烈依赖于膜上的质子转运H+-ATPase酶,当L.brevis菌适应酒花苦味酸时,质子转运H+-ATPase酶活性增加,而去除酒花时的ATPase酶功能性表达又逐渐下降,这种增加的表达量能够允许L.brevis菌保持质子移动势PMF活性和pH梯度[6]。所以,尽管HorA和HorC降低了质子流速,但H+-ATPase酶通过将更多质子泵出细胞而补偿了PMF散失和pH降低作用,ATP-驱动HorA和PMF-驱动HorC与H+-ATPase的联合反应,使L.brevis菌对啤酒花具有抗性[6]。
综合啤酒花抗性机制相关研究成果,可以给出啤酒花抗性机制模型如图2所示。在啤酒花抗性细胞中,当未解离的酒花苦味酸Hop-H渗入细胞质膜后,能够被细胞膜上的ATP-驱动HorA和PMF-驱动HorC多药抗性转运蛋白从细胞质膜中逐出胞外。但是,也有部分Hop-H避开转运蛋白进入胞浆,并受胞内高pH值影响而解离为阴离子Hop-和质子H+,同时,胞外H+也能通过HorC反应与Hop-H逆向运输进入胞内,导致跨膜pH梯度的下降。为了防止胞浆酸化并维持跨膜pH梯度,质子转运H+-ATPase酶过表达而将H+排出胞外。跨膜pH梯度和PMF的维持需要消耗能量,在啤酒花抗性细胞中,这些啤酒花抗性机制的能源来源于柠檬酸、丙酮酸、苹果酸和精氨酸等代谢产生的ATP,在某些情况下,可发酵糖如麦芽三糖等也能被用于产生ATP。因此,在啤酒花抗性细胞中,由ATP/PMF驱动的多药抗性转运蛋白组成的质子分泌系统,将酒花苦味酸分泌到胞外介质中以保持胞内pH,而柠檬酸代谢等提供的ATP为细胞生长提供能量[7]。在啤酒抗性菌细胞壁中,半乳糖基甘油磷壁酸和细胞质膜中脂成分的变化也增加了酒花苦味酸的过膜障碍,降低了酒花苦味酸进入细胞的速度[17]。二价阳离子转运蛋白HitA通过泵出阳离子,使Hop-无法形成复合物而停留在细胞中,从而降低酒花苦味酸进入胞内的速度,以维持跨膜pH梯度[11]。同时,质子载体反应并不严格受控于pH梯度[9],因为在低质子梯度时,细胞为了存活而改变了所需要的膜上离子梯度,亦即在啤酒花胁迫下从质子梯度到作为驱动力的钠/钾梯度的改变。
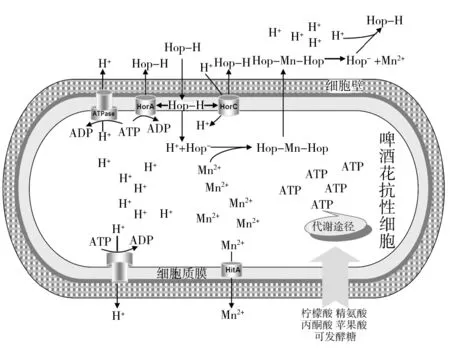
图2 啤酒花抗性菌的啤酒花抗性机制模型Fig.2 Hop resistance mechanism modes in beer spoilage bacteria
5 啤酒花抗性的其他机制
5.1 谷氨酸脱羧酶系GAD酒花抗性机制
多因素响应对处理能够影响微生物生长的啤酒复杂条件是必需的[25],其中谷氨酸脱羧酶GAD系统的酸胁迫耐受机制对于酒花耐受和胞内pH维持具有重要贡献,是啤酒花抗性菌中重要的酸胁迫减缓系统[7]。L.brevis菌中的谷氨酸脱羧酶GAD系统是由1个转录调控因子(Gad-tr)、1个谷氨酰γ-氨基丁酸转运蛋白(GadC)和2个谷氨酸脱羧酶(GadB1, GadB2)组成[7]。为了评估GAD同工酶的特异性作用,Schurr等[7]在代谢和转录水平上比较了酒花苦味酸对L.brevis菌中GAD系统的影响。在酒花胁迫条件下,当有谷氨酸存在时啤酒花耐受菌能很好地维持胞内pH。啤酒花抗性菌和啤酒花敏感菌中的gad-tr、gadB1和gadC基因表达分别被上调和下调。因为gadB2基因表达非常稳定,啤酒花敏感菌在酸胁迫下采用2个GAD同工酶,而啤酒花抗性菌则设法在只有一个同工酶(GadB2)时生存,因此可以通过诱导gadB1表达而控制额外的酒花胁迫。
GAD是基于由谷氨酸脱羧酶(GadB)催化的质子消耗谷氨酸脱羧反应和随后的通过膜上转运蛋白(GadC)进行胞外谷氨酸和γ-氨基丁酸(GABA)催化的不依赖能量的逆向转运[7],这种过程的净作用是将质子从细胞质中排出,导致胞内pH增加和PMF产生。合成的脱羧反应产物如GABA的3倍量排出可以证明啤酒花抗性菌细胞有足够的PMF用于H+-ATPase介导ATP生成[26]。
5.2 氧胁迫诱导的酒花抗性机制
低pH环境与Mn2+存在时,会引发酒花苦味酸的跨膜氧化还原反应,导致胞内氧化损伤,因此,氧化剂抗性是酒花胁迫下细胞存活所必需的[18]。锰依赖跨膜氧化还原反应在啤酒花抑制中起决定性作用[6],因为锰和酒花苦味酸都是高氧化还原活性底物,Mn2+-酒花苦味酸复合物与酒花苦味酸自身一样,能够参与跨膜氧化还原反应,锰在抗菌机制中的作用是强烈加强电荷过膜渗透性[9]。
锰的氧化还原属性因pH环境而改变[18],碱性pH时Mn(II)是还原剂,酸性pH时Mn(III)是氧化剂[18],同样,酒花苦味酸的氧化还原属性也因pH而改变。MnCl2的存在能够提高酒花苦味酸的氧化和还原能力,说明膜上的pH和MnCl2梯度能驱动酒花苦味酸介导的跨膜氧化还原反应[18]。代谢组学研究发现,酒花胁迫条件下的氧胁迫相关蛋白包括环丙烷脂肪酰基磷脂合成酶CFA、HitA和几种氧化还原酶,说明跨膜氧化还原反应是由酒花苦味酸介导,所形成的锰复合物会引起胞内氧胁迫性[10]。事实上,在细菌中,因较高的胞内pH和高浓度Mn2+,酒花苦味酸渗入细胞质膜后与Mn2+在膜-液内界面形成Mn2+-酒花苦味酸复合物电子供体(还原态),并过膜转移给膜-液外界面的电子受体酒花苦味酸(氧化态),因为氧化还原反应是可逆的,被氧化的锰-酒花苦味酸复合物留在胞内作为电子受体,产生氧化胁迫[18]。因此,作为一个多因素动态特性,啤酒花抗性至少对两种不同的啤酒花抑制机制(质子载体诱导和氧化应激机制)具有不同的抗性水平[10]。
5.3 酵母酒花抗性机制
酒花苦味酸的反应模型研究迄今几乎只限于乳酸菌,Hazelwood等[27]则研究了Saccharomycescerevisiae抗酒花苦味酸的分子机制,其细胞生长的酒花苦味酸浓度高于啤酒花抗性的原核细胞。酵母抗酒花苦味酸反应一般包括3个主要过程:液泡型ATPase酶驱动的质子主动运输将酒花苦味酸泵入并封存在液泡中、改变细胞壁结构、将酒花苦味酸转运过质膜。而且,酒花苦味酸作为强的锌和铁螯合剂能够影响胞内金属离子平衡,由液泡-ATPase酶引起的液泡酸化为酒花苦味酸积累提供了驱动力[27]。
S.cerevisiae采用互补细胞机制保护自身免受酒花苦味酸的干扰,消耗细胞质中的酒花苦味酸是酒花抗性所必需的。首先,酵母菌为响应酒花苦味酸而改变细胞壁组分,减少酒花苦味酸的接触;然后将酒花苦味酸转出细胞质到胞外介质、甚至是液泡中;最后,Zn2+和Fe2+水平的胞内平衡上调Aft1p-和Zap1p-调剂基因,抵消了酒花苦味酸对金属离子的螯合[28]。
6 展 望
由于啤酒工厂的长期生产和大气环境的恶化,不仅已发现的乳酸菌污染啤酒的频率在增加,其他各种非乳酸菌污染也时有发生。酒花苦味酸的抑菌机制与膜转运蛋白及细胞膜组分改变密切相关,但为什么酒花抗性存在种间差异,为什么同一种菌中并非所有的菌株都具有酒花抗性,酒花苦味酸如何启动膜上转运蛋白过表达,很多问题尚待揭示。随着现代分子生物学研究的进展,转录组学、蛋白组学、代谢组学等技术手段逐渐引入酒花抗性机制研究,并将为酒花抗性机制研究提供重要的研究手段,为啤酒安全生产奠定理论基础。
[1] Sakamoto K, Konings W N. Beer spoilage bacteria and hop resistance[J]. Int J Food Microbiol, 2003, 89(2-3): 105-124.
[2] Moir M. Hops: A millennium review[J]. J Am Soc Brew Chem, 2000, 58(4): 131-146.
[3] Intelmann D, Hofmann T. On the autoxidation of bitter-tasting iso-alpha-acids in beer[J]. J Agric Food Chem, 2010, 58 (8): 5059-5067.
[4] Intelmann D, Haseleu G, Dunkel A, et al. Comprehensive sensomics analysis of hop-derived bitter compounds during storage of beer[J]. J Agric Food Chem, 2011, 59 (5): 1939-1953.
[5] Leite IR, Faria JR, Marquez L D S, et al. Evaluation of hop extract as a natural antibacterial agent in contaminated fuel ethanol fermentations[J]. Fuel Process Technol, 2013, 106(2): 611-618.
[6] Schurr B C, Hahne H, Kuster B, et al. Molecular mechanisms behind the antimicrobial activity of hop iso-acids inLactobacillusbrevis[J]. Food Microbiol, 2015, 46(46): 553-563.
[7] Schurr B C, Behr J, Vogel R F. Role of the GAD system in hop tolerance ofLactobacillusbrevis[J]. Eur Food Res Technol, 2013, 237 (2): 199-207.
[8] Preissler P, Behr J, Vogel R F. Detection of beer-spoilageLactobacillusbrevisstrains by reduction of resazurin[J]. J Inst Brew, 2010, 116(4): 399-405.
[9] Behr J, Vogel R F. Mechanisms of hop inhibition: hop ionophores[J]. J Agric Food Chem, 2009, 57 (14): 6074-6081.

[11] Hayashi N, Ito M, Horiike S, et al. Molecular cloning of a putative divalent-cation transporter gene as a new genetic marker for the identification ofLactobacillusbrevisstrains capable of growing in beer[J]. Appl Microbiol Biotechnol, 2001, 55(5): 596-603.
[12]Bergsveinson J, Pittet V, Ziola B. RT-qPCR analysis of putative beer-spoilage gene expression during growth ofLactobacillusbrevisBSO 464 andPediococcusclausseniiATCC BAA-344T in beer[J]. Appl Microbiol Biotechnol, 2012, 96(2): 461-470.
[13]Haakensen M, Schubert A, Ziola B. Multiplex PCR for putativeLactobacillusandPediococcusbeer-spoilage genes and ability of gene presence to predict growth in beer[J]. J Am Soc Brew Chem, 2008, 66(2): 63-70.
[14]Sami M, Yamashita H, Hirono T, et al. Hop-resistantLactobacilhsbreviscontains a novel plasmid harboring a multidrug resistance-like gene[J]. J Ferment Bioengineer, 1997, 84(1): l-6.
[15]Suzuki K, Iijima K, Ozaki K, et al. Isolation of a hop sensitive variant ofLactobacilluslindneriand identification of genetic markers for beer spoilage ability of lactic acid bacteria[J]. Appl Environ Microbiol, 2005, 71(9): 5089-5097.
[16]Iijima K, Suzuki K, Ozaki K, et al.horC confers beer spoilage ability on hop-sensitiveLactobacillusbrevisABBC45cc[J]. J Appl Microbiol, 2006, 100(6): 1282-1288.
[17]Suzuki K, Iijima K, Ozaki K. et al. Study on ATP production of lactic acid bacteria in beer and development of a rapid screening method for beer-spoilage bacteria[J]. J Inst Brew, 2005, 111(3): 328-335.
[18]Behr J, Vogel R F. Mechanisms of hop inhibition include the transmembrane redox reaction[J]. Appl Environ Microbiol, 2010, 76 (1): 142-149.
[19]Behr J, Geiβler A J, Preissler P, et al. Identification of ecotype-specific marker genes for categorization of beer-spoilingLactobacillusbrevis[J]. Food Microbiol, 2015, 51: 130-138.
[20]Li X Z, Nikaido H. Efflux-mediated drug resistance in bacteria: an update[J]. Drugs, 2009, 69(12): 1555-1623.
[21]Lubelski J, Konings W N, Driessen A J M. Distribution and physiology of ABC-type transporters contributing to multidrug resistance in bacteria[J]. Microbiol Mol Biol Rev, 2007, 71(3): 463-476.
[22]Velamakanni S, Lau C H F, Gutmann D A P, et al. A multidrug ABC transporter with a taste for salt[J]. PLoS One,2009, 4(7): e6137.
[23] Lubelski J, Mazurkiewicz P, van Merkerk R, et al.ydaG andydbA ofLactococcuslactisencode a heterodimeric ATP-binding cassette-type multidrug transporter[J]. J Biol Chem, 2004, 279(33): 34449-34455.
[24]Sakamoto K, Margolles A, van Veen H W, et al. Hop resistance in the beer spoilage bacteriumLactobacillusbrevisis mediated by the ATP-binding cassette multidrug transporter HorA[J]. J Bacteriol, 2001, 183(18): 5371-5375.
[25]Pittet V, Phister T G, Ziola B. Transcriptome sequence and plasmid copy number analysis of the brewery isolatePediococcusclausseniiATCC BAA-344T during growth in beer[J]. Plos One, 2013, 8(9): e73627.
[26]Ma D, Lu P, Yan C, et al. Structure and mechanism of a glutamate-GABA antiporter[J]. Nature, 2012, 483(7391): 632-636.
[27]Hazelwood L A, Walsh M C, Pronk J T, et al. Involvement of vacuolar sequestration and active transport in tolerance ofSaccharomycescerevisiaeto hop iso-acids[J]. Appl Environ Microbiol, 2010, 76(1): 318-328.
[28]Blanco C A, Caballero I, Rojas A, et al. Chelation of aqueous iron(III) by 2-acetyl-1,3-cyclohexanedione and beer ageing[J]. Food Chem, 2003, 81(4): 561-568.
Advance in hop resistance in beer spoilage microbes
LI Xian-zhen1,2, WANG Wei1,2, JIANG Bao-hang2, YANG Chao2, SUN Zhen2, DU Guo-cheng1
(1.SchoolofBiotechnology,JiangnanUniversity,Wuxi214122; 2.SchoolofBiologicalEngineering,DalianPolytechnicUniversity,Dalian116034)
Hop bitter acid is an important constituent in beer flavor and a natural antibacterial agent for beer brewing. Hop-sensitive bacteria were inhibited by decreasing intracellular pH gradient caused by hop bitter acid. It has been confirmed that hop bitter acid could be bumped out cell via membrane-bound transporters in hop-resistance bacteria, leading to the decrease in proton influx, to keep pH gradient. The advance in hop resistance in beer spoilage bacteria was reviewed in this paper, in which the relationship of membrane components and hop resistance was discussed and the hop resistance mechanisms were proposed.
beer; hop; spoilage microorganism; contamination; bitter acid; hop-resistance
一直从事微生物学和生物催化方面研究,主持国家自然科学基金、公益性行业专项等研究工作,所带领团队为辽宁省高等学校创新团队,发表论文80余篇,其中SCI收录论文40篇,被其他SCI论文引用次数300余篇次,受国际著名出版社邀请撰写学术专著3部。作为第一完成人,获大连市科技进步一等奖1项,辽宁省科技进步二等奖1项,辽宁省自然科学二等奖1项,中国轻工业联合会科技进步一等奖1项。在生物催化领域的研究成果被国内外专家所关注。近年的主要学术成果和贡献: 发现国际上未知的5种具有重要生物活性的微生物新菌;证明天然纤维素的降解过程是由小分子纤维起始酶启动的;所开发的高纯异麦芽酮糖清洁生产技术已列入国家发改委第五批国家重点节能技术推荐目录。
国家自然科学基金项目(31371742);公益性行业(农业)科研专项(201303095);大连市科技计划项目(2013B11NC078)
李宪臻 男,教授,博士生导师。研究方向为微生物与生物催化。Tel: 0411-86323717,E-mail: xianzhen@dlpu.edu.cn
2015-05-03;
2015-05-16
Q93
A
1005-7021(2015)05-0001-07
10.3969/j.issn.1005-7021.2015.05.001
李宪臻,大连工业大学二级教授、博士生导师,国务院特殊津贴专家,入选辽宁省百千万人才工程百人层次,大连市首批领军人才。兼任中国发酵工业协会理事、中国食品科技学会酶制剂分会理事、中国酿酒协会理事、中国微生物学会基础微生物学专业委员会委员、中国微生物学会工业微生物学专业委员会委员、辽宁省生物化学会常务理事、辽宁省微生物学会常务理事。