盐霉素钠纳米脂质体的制备及表征
·论著·
盐霉素钠纳米脂质体的制备及表征
巩志荣1,何文婷1,孙治国1,郭海霞2,钟延强1,鲁莹1(1.第二军医大学药学院,上海 200433;2.解放军266医院,河北 承德 067000)
[摘要]目的 制备并表征盐霉素钠纳米脂质体(SLN)。方法采用薄膜分散法制备盐霉素钠纳米脂质体,通过调节脂质体中胆固醇比例,以盐霉素钠包封率为评价指标,筛选盐霉素钠纳米脂质体的优化处方。结果透射电镜显示盐霉素钠纳米脂质体形态圆整,分散性良好,激光粒度仪显示盐霉素钠纳米脂质体平均粒径为99.0 nm,Zeta电位为-33.5 mV,包封率为85.7%,载药量为6.7%。通过脂质体包裹,盐霉素钠在水中的最高浓度可提高15倍,并证明其具有一定缓释效果。结论笔者得到了粒径大小在100 nm左右,形态均一,包封率和载药量较高的盐霉素钠纳米脂质体,为进一步测定其杀伤肿瘤活性奠定了坚实的制剂学基础。
[关键词]肿瘤干细胞;盐霉素钠;脂质体;包封率;处方优化
[作者简介]巩志荣,硕士研究生.研究方向:药物缓控释系统研究.E-mail:shedegongzr@163.com
[通讯作者]鲁莹,博士,副教授.研究方向:药物缓控释系统研究.E-mail:acuace@163.com
[中图分类号]R945[文献标志码]A
DOI[]10.3969/j.issn.1006-0111.2015.01.009
[收稿日期]2014-09-27[修回日期]2014-11-16
Preparation and characterization of salinomycin sodium loaded nano liposomes
GONG Zhirong1,HE Wenting1,SUN Zhiguo1,GUO Haixia2,ZHONG Yanqiang1,LU Ying1(1.School of Pharmacy,Second Military Medical University,Shanghai 200433,China;2.No.266 Hospital of PLA,Chengde 067000,China)
Abstract[]ObjectiveTo prepare and characterize salinomycin sodium-loaded nano liposomes(SLN).MethodsThe nano liposomes were prepared by a thin-film dispersion method.The formula of SLN was optimized by regulating the cholesterol ratio of the nano liposomes,using the encapsulation efficacy (EE) of SLN as the primary outcome measure.ResultsTransmission electron microscope (TEM) showed that SLN was round and had a good dispersion.Dynamic laser scatter (DLS) showed that SLN was of a desired size of 99 nm,and zeta potential of -33.5 mV.EE of SLN was 85.7% and drug loading of 6.7%.According to the formulation of nano liposomes,the concentration of salinomycin sodium in water was greatly improved by 15 folds.Additionally,the nano liposomes were observed to exhibit sustained release characteristics.ConclusionSalinomycin sodium-loaded nanoliposomes of a desired size of about 100 nm were obtained,which were well dispersion,and high EE and drug loading.Solid pharmaceutics foundation for the activity examination of SLN was provided in this research.
[Key words]cancer stem cells;salinomycin sodium;liposomes;entrapment efficiency;optimization of preparation
肿瘤干细胞(cancer stem cells)是具有干细胞特性的一个肿瘤细胞亚群,在肿瘤的发生、发展、耐药、转移和复发中起关键作用[1],消灭肿瘤干细胞有望能彻底治愈肿瘤。因此,许多研究都集中在如何发现和开发能靶向肿瘤干细胞的药物[2]。盐霉素(salinomycin)是一种环醚类的离子载体抗生素,2009年Gupta等[3]首次证实盐霉素能有效靶向乳腺癌干细胞,其消灭乳腺癌干细胞的能力要比传统化疗药物紫杉醇强100倍。后续研究发现,盐霉素能作用于多种肿瘤干细胞(如骨肉瘤、白血病干细胞等)[4],其作用效果已经得到广泛关注[5]。但是,盐霉素及其钠盐的水溶解度较低,导致其在血液中的浓度难以达到治疗浓度,因此亟需通过制剂途径来提高其血液中的浓度以期获得更好的治疗效果。
纳米药物是指在疾病治疗、诊断、监控以及生物系统控制等方面应用纳米技术而研制的药物,能显著提高传统药物在血液中的浓度,改善药物的药动学、组织分布,提高药物对靶部位的靶向性[6]。纳米脂质体是一种粒径100 nm左右、由磷脂双分子层构成的具有水相内核的脂质微囊,它是一种研究最多和最成熟的纳米药物。纳米脂质体作为药物载体,具有良好的生物相容性,可以包载亲水性药物和疏水性药物,将其作为多种药物尤其是抗肿瘤药物的载体,这已在临床上有所应用[7]。目前FDA已经批准多种纳米脂质体用于临床的肿瘤治疗[8,9]。
在本研究中,笔者选用氢化大豆卵磷脂、胆固醇和磷脂酰乙醇胺-聚乙二醇2000作为脂质体材料,利用薄膜分散法制备盐霉素钠脂质体,通过调节脂质体中的胆固醇比例,以盐霉素钠包封率为评价指标,筛选盐霉素钠纳米脂质体的优选处方。
1仪器与材料
1.1 仪器
高效液相色谱仪LC-20A(日本岛津公司),C18反相色谱柱(迪马公司,250 mm×4.6 mm,5 μm),旋转蒸发仪(上海申生科技有限公司),薄膜挤出器(加拿大AVESTIN公司),透射电子显微镜(日本JEOL公司),Zetasizer nano ZS激光粒度分析仪(英国Malvern公司),超声波细胞粉碎机(宁波新芝生物科技股份有限公司),超纯水系统(美国Barnstead公司)。
1.2 材料
盐霉素钠原料药(美国TEKU-E公司),氢化大豆卵磷脂HSPC(德国Lipoid公司),胆固醇CHOL(美国Sigma公司),磷脂酰乙醇胺-聚乙二醇2000 DSPE-PEG-2K(德国Lipoid公司)。
2方法
2.1 盐霉素钠脂质体的制备
盐霉素钠脂质体的制备工艺采用传统的薄膜分散法[10]。具体步骤为:称取处方中一定比例的各脂质化合物(HSPC∶CHOL∶DSPE-PEG-2K=85∶10∶5,摩尔比)于3 ml三氯甲烷中溶解,按药脂比1∶10(摩尔比)称取盐霉素钠溶于甲醇,将二者混匀旋蒸为均匀薄膜后,用5 ml HEPES缓冲液水化,即得脂质体溶液粗品。将该粗品超声震荡10 min,依次通过0.4、0.2 μm聚碳酸酯膜,即得到盐霉素钠脂质体。
2.2 脂质体的表征
采用透射电子显微镜观察脂质体的形态和粒径。采用激光粒度分析仪考察脂质体的粒径分布与Zeta电位分布。将新鲜制备的脂质体进行粒径、Zeta电位测定后,置4 ℃冰箱存放14 d,重新对其粒径、Zeta电位进行测定,考察脂质体是否发生聚集。
2.3 色谱条件
色谱柱:C18反相色谱柱(迪马公司, 250 mm×4.6 mm,5 μm);流动相:乙腈∶水∶四氢呋喃THF∶磷酸H3PO4=85∶10∶5∶0.1 (V/V);流速:1.5 ml/min;柱温:30 ℃;进样量:20 μl;检测波长:206 nm。
2.4 盐霉素钠的特异性
分别制备以下样品:A:空白脂质体提取液;B:盐霉素钠(SAL-Na)的甲醇标准液;C:空白脂质体加SAL-Na提取液。按2.3项下条件进样分析,考察SAL-Na提取方法的特异性。
2.5 盐霉素钠HPLC-DAD测定方法的建立
精密吸取SAL-Na标准储备液,用甲醇减半稀释,分别制备成7.82、15.63、31.25、62.5、125、250、500、1 000 μg/ml的标准系列样品。按2.3项下条件进样分析,以峰面积A为纵坐标,样品浓度C为横坐标,绘制标准曲线。分别配制500、125、31.25 μg/ml 3个浓度的SAL-Na甲醇溶液,按2.3项下条件连续进样5次,考察日内、日间精密度。分别配制500、125、31.25 μg/ml 3个浓度的SAL-Na脂质体混合液,使用甲醇破乳后按2.3项下条件进样分析,代入标准曲线计算脂质体中药物的提取回收率。
2.6 包封率、载药量的测定
采用微型柱离心-HPLC法[11]测定盐霉素钠脂质体的包封率和载药量。微型柱的填充材料为葡聚糖凝胶G-50,根据分子筛原理,其对游离药物盐霉素钠的吸附远高于盐霉素钠脂质体。具体操作为,取50 μl脂质体样品进行微型柱上样,离心3次,得到除去游离盐霉素钠的脂质体。该脂质体经甲醇破乳,过膜后按2.3项下条件进样分析。
2.7 盐霉素钠脂质体的处方优化
固定DSPE-PEG-2K的比例为5%,调节脂质组成中胆固醇的比例分别为40%、20%、10%,按药脂比为1∶10投药制备盐霉素钠脂质体,以包封率为评价指标,筛选出盐霉素钠脂质体的最优处方。
2.8 盐霉素钠脂质体体外释放的考察
分别取1 ml游离盐霉素钠和盐霉素钠脂质体置于截留相对分子质量为10 000的透析管中,释放介质为100 ml磷酸盐缓冲液(PBS:pH=7.4,10 mmol/L),在37 ℃、100 r/min条件下,于规定时间点各取2 ml 释放介质样品。样品经浓缩后,按2.3项下条件进行盐霉素钠含量测定。
3结果
3.1 胆固醇比例对盐霉素钠包封率的影响
如表1所示,随着处方中胆固醇比例的降低,盐霉素钠的包封率升高。但是过低的胆固醇,会导致脂质体膜结构流动性过高而降解[12],不利于药物的释放和脂质体的稳定。因此,本实验选择10%的胆固醇比例作为最优处方, 此时盐霉素钠脂质体的包封率可达85%,载药量为6.7%,盐霉素钠的浓度可达1.5 mg/ml,其浓度约提高15倍。

表1 胆固醇比例对盐霉素钠脂质体包封率的影响
3.2 盐霉素钠脂质体的表征
图1为脂质体的透射电镜(TEM)图片。如图所示,脂质体表观圆整,脂质双分子层清晰可见,分布均匀,粒径约为100 nm。

图1 脂质体TEM图(×20 000) A.空白脂质体;B.盐霉素钠脂质体
图2为脂质体的粒径大小、分散性和Zeta电位典型图例。由图可见,脂质体的平均粒径在100 nm左右,Zeta电位分布在-35 mV附近,显示该脂质体带负电,且其绝对值大于25 mV,说明该脂质体稳定性好。以氢化大豆卵磷脂作为脂质材料,其相变温度为55 ℃,在低于此温度时,该脂质体的流动性较低。因此,该脂质体可在体温条件下较长时间内保持其形态,从而保持其稳定性。
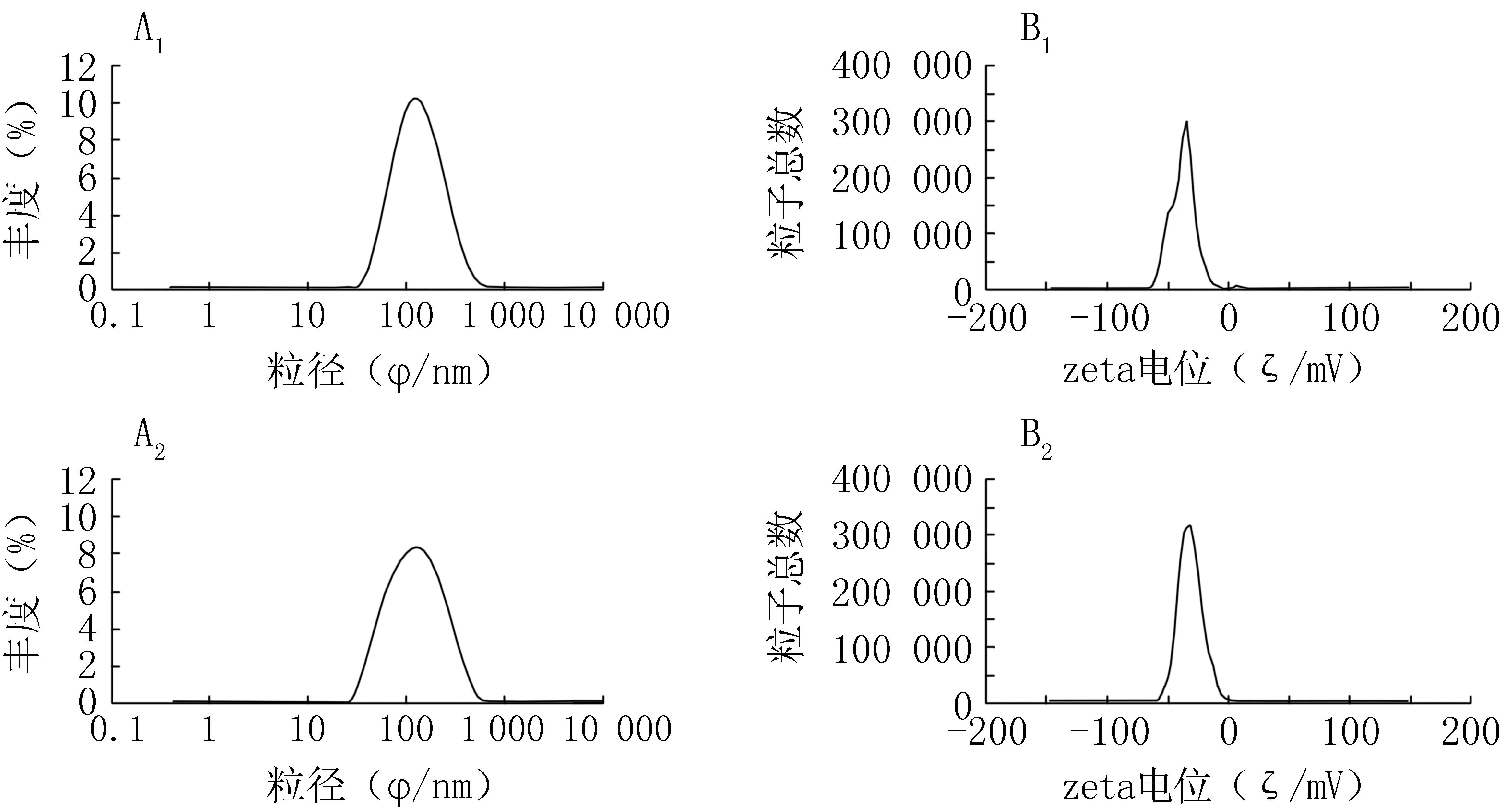
图2 脂质体的粒径分布图和Zeta电位图 A 1、B 1.空白脂质体的粒径分布和Zeta电位分布图;A 2、B 2.盐霉素钠脂质体的粒径分布和Zeta电位分布图
表2为新鲜制备的空白脂质体和盐霉素钠脂质体以及其在4 ℃冰箱放置14 d后,其粒径、电位分布的变化。从表中数据可知,脂质体在4 ℃条件下,分散性良好,无聚集现象发生。

表2 脂质体的稳定性考察
3.3 盐霉素钠特异性
图3为盐霉素钠特异性代表性图谱,盐霉素钠的出峰时间为11.68 min。结果显示,脂质体材料对盐霉素钠的测定无干扰。
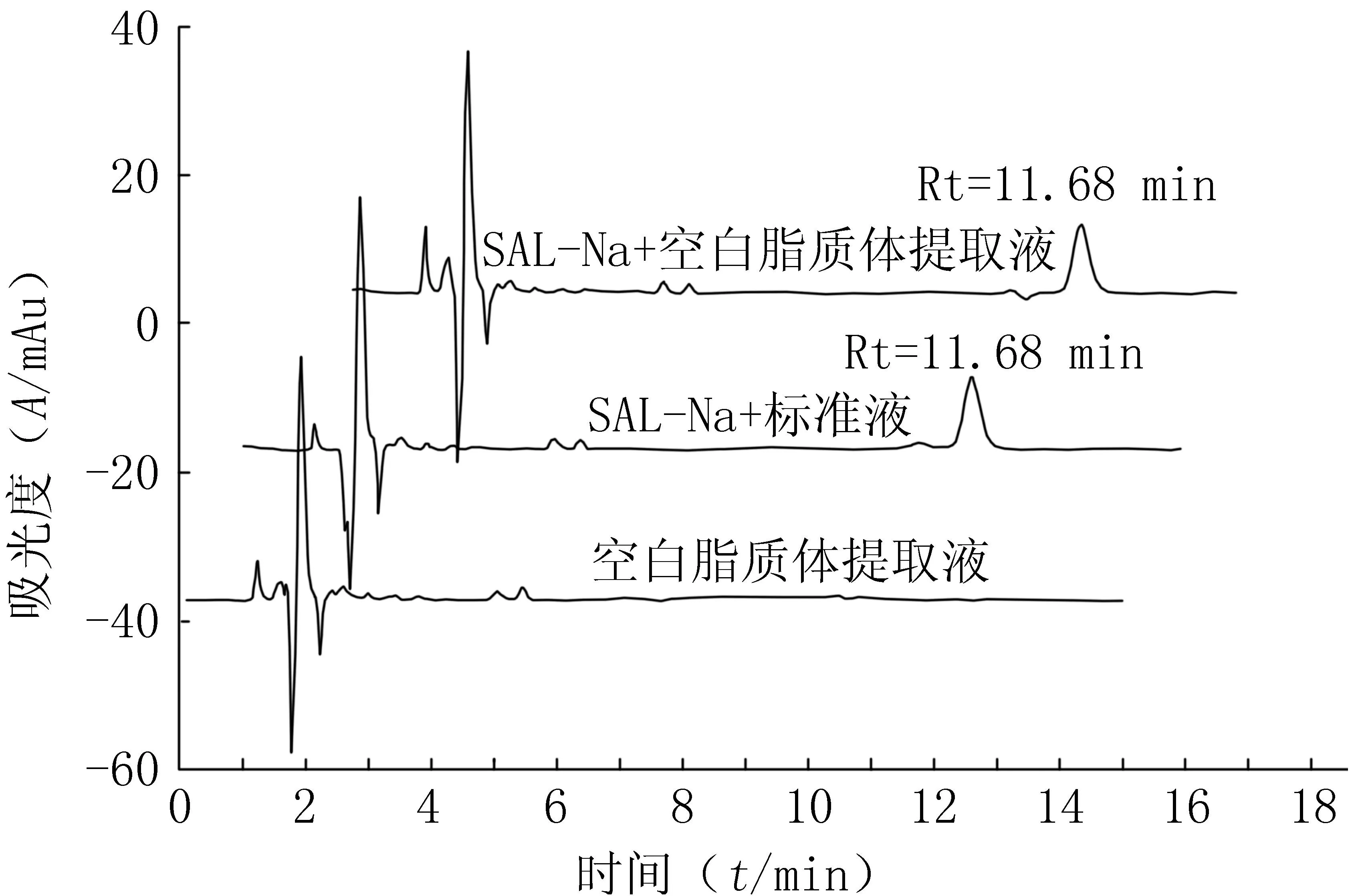
图3 盐霉素钠特异性图谱
3.4 盐霉素钠HPLC-DAD测定方法
如图4所示,盐霉素钠质量浓度在7.8~1 000 μg/ml范围内线性良好,线性方程为A=419.4C-226.7(r=0.999 7)。如表3、表4所示,盐霉素钠的日内、日间精密度均小于5%,回收率为99%~107%,符合定量测定要求。盐霉素钠在脂质体中的提取回收率为96%~113%,且RSD<5%,因此该破乳条件和测定条件满足盐霉素钠脂质体包封率和载药量的体外定量测定要求。

图4 盐霉素钠的标准曲线
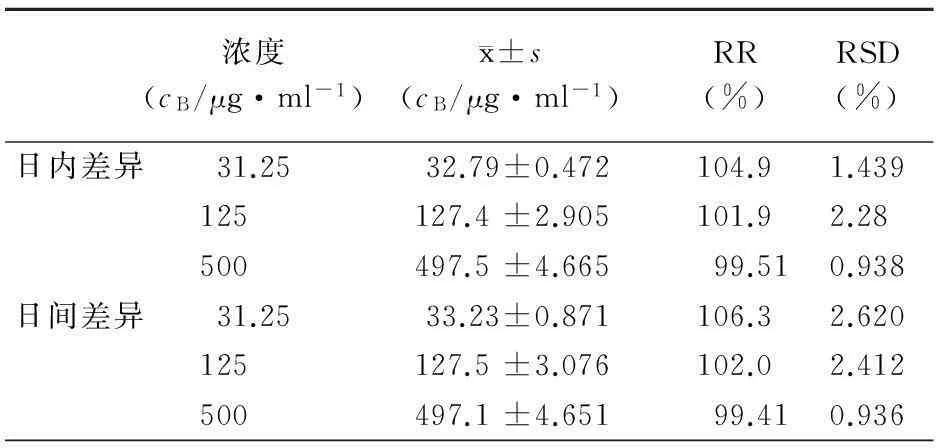
表3 盐霉素钠日内、日间精密度以及回收率

表4 盐霉素钠的提取回收率
3.5 盐霉素钠脂质体包封率和载药量的测定
如图5所示, 对空白脂质体和游离盐霉素钠在微型柱上的吸附性进行考察。采用浊度法[13]于500 nm处测定上柱前后空白脂质体的吸光度,按2.6项下条件离心处理,结果显示4次洗脱离心后,空白脂质体可以被完全洗脱下来。另将游离盐霉素钠上样于微型柱中,按2.6项下条件离心处理,收集所得溶液按2.3项下条件处理并测定药物含量,计算游离盐霉素钠的洗脱百分数。结果显示,经4次洗脱后,只有不到3%的游离药物被冲出。因此,利用微型柱离心-HPLC法测定盐霉素钠脂质体的包封率及载药量的结果准确可靠。最终测得优选处方中盐霉素钠脂质体的包封率为85.7%,载药量为6.7%。

图5 微柱对空白脂质体(A)和游离盐霉素钠(B)的洗脱曲线
3.6 游离盐霉素钠和盐霉素钠脂质体的体外释放度考察
图6为游离盐霉素钠和盐霉素钠脂质体在PBS(pH=7.4)中的释放曲线,结果显示,盐霉素钠经脂质体包裹后,具有一定缓释效果,在48 h内累计释放量为70%。
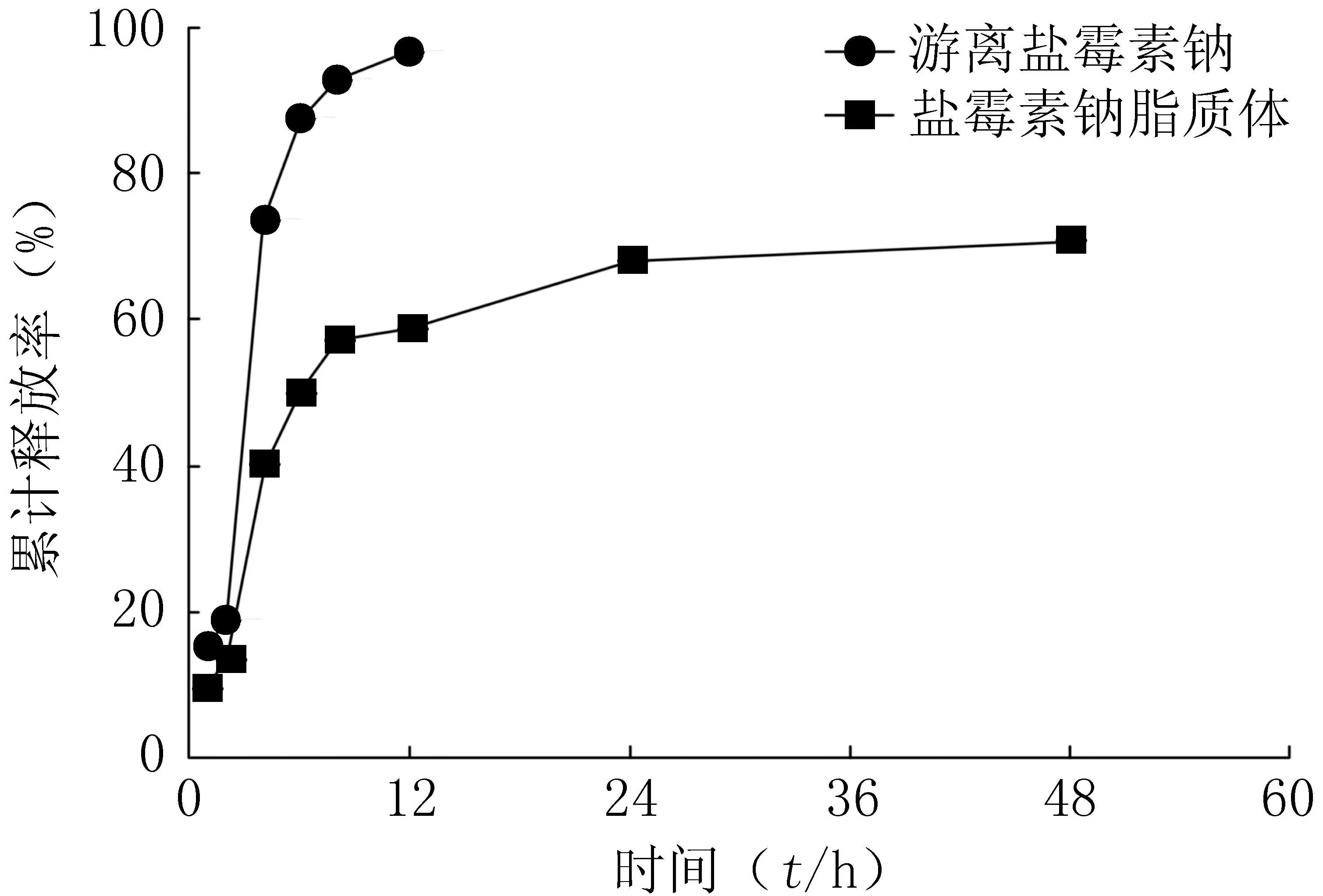
图6 游离盐霉素钠和盐霉素钠 脂质体的体外释放曲线
4讨论
采取哪种策略来优化药物的吸收、分布、代谢、排泄/毒性(ADME/Tox),药物的类药性质是关键。首先,笔者利用ACD在线软件(https//ilab.acdlabs.com/iLab2/)对盐霉素钠的类药性质进行了分析,发现盐霉素钠亲脂性较高,渗透性良好,溶解性较低,吸收程度差。对于这些问题通常可通过制剂途径来解决。笔者选择纳米脂质体的原因在于它是目前最为成熟的纳米药物剂型,具有良好的应用前景。通过纳米脂质体包裹,将盐霉素钠在水溶液中的最高浓度提高了15倍,预期能改善盐霉素钠的ADME/Tox。
包裹药物的性质、胆固醇与磷脂的比例和制备方法是脂质体处方工艺的3大要素。① 药物的log P对选择何种制备方法至关重要。在本研究中,盐霉素钠的油水分配系数log P为6.1,为脂溶性药物,因此笔者选择较为简单的薄膜分散法来制备盐霉素钠脂质体。② 胆固醇被称为“流动性缓冲剂”,在相变温度之下,磷脂中加胆固醇可使膜减少有序排列而增加膜流动性;在相变温度之上,酰链自由度减小导致膜压缩、表面积变小、
包装紧密性和流动性
降低。在研究中发现,由于盐霉素钠为脂溶性药物,低胆固醇的脂质组成更易于包载盐霉素钠。原因可能有以下两点:一是盐霉素钠与胆固醇均为脂溶性物质,对于脂质体的脂质双分子层的疏水空间具有竞争性;二是高比例的胆固醇脂质组成使得脂质中的烃链流动性降低,从而干扰盐霉素钠进入脂质双分子层[14]。③ 磷脂是生物膜的主要结构成分,选择氢化大豆卵磷脂HSPC作为脂质体的磷脂膜材是由于其较高的相变温度(Tm=55 ℃),在常温下可以保持脂质体的稳定性。长循环脂质体的制备可以通过在脂质体双分子层中加入PEG化脂质,或者用嵌段共聚物对囊泡的表面进行修饰。因此,在脂质体中掺入一定比例的DSPE-PEG-2K以期增加脂质体的稳定性,延长脂质体的循环时间。由于DSPE-PEG-2K是一种表面活性剂,其比例超过40%有可能破坏脂质体结构[15],形成胶束结构。因此,本实验在脂质体中只掺入5% DSPE-PEG-2K。
文献中盐霉素钠的测定方法多为柱前衍生化法[16],该方法操作复杂、稳定性差。为解决这些问题,本实验中盐霉素钠采用HPLC-DAD的测定方法,该方法操作简单,测定方法的准确度和稳定性能满足体外盐霉素钠的定量要求。
综上,本实验得到了粒径大小在100 nm左右,形态均一,包封率和载药量较高的盐霉素钠纳米脂质体,为进一步测定其杀伤肿瘤活性奠定了坚实的制剂学基础。
【参考文献】
[1]Reya T,Morrison SJ,Clarke MF,etal.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
[2]Dean M,Fojo T,Bates S.Tumour stem cells and drug resistance[J].Nat Rev Cancer,2005,5(4):275-284.
[3]Gupta PB,Onder TT,Jiang G,etal.Identification of selective inhibitors of cancer stem cells by high-throughput screening[J].Cell,2009,138(4):645-659.
[4]Naujokat C,Steinhart R.Salinomycin as a drug for targeting human cancer stem cells[J].Biomed Res Int,2012,2012:1-17.
[5]Huczynski A.Salinomycin:a new cancer drug candidate[J].Chem Biol Drug Des,2012,79(3):235-238.
[6]Liu Y,Miyoshi H,Nakamura M.Nanomedicine for drug delivery and imaging:a promising avenue for cancer therapy and diagnosis using targeted functional nanoparticles[J].Int J Cancer,2007,120(12):2527-2537.
[7]Chang H,Yeh M.Clinical development of liposome-based drugs:formulation,characterization,and therapeutic efficacy[J].Int J Nanomed,2012,7:49-60.
[8]Barenholz YC.Doxil -the first FDA-approved nano-drug:lessons learned[J].J Control Release,2012,160(2):117-134.
[9]Farokhzad OC,Langer R.Nanomedicine:developing smarter therapeutic and diagnostic modalities[J].Adv Drug Deliver Rev,2006,58(14):1456-1459.
[10]Mayer LD,Hope MJ,Cullis PR.Vesicles of variable sizes produced by a rapid extrusion procedure[J].BBA-Biomembranes 1986,858(1):161-168.
[11]Mayer LD,Harasym TO,Tardi PG,etal.Ratiometric dosing of anticancer drug combinations:controlling drug ratios after systemic administration regulates therapeutic activity in tumor-bearing mice[J].Mol Cancer Ther,2006,5(7):1854-1863.
[12]Damen J,Regts J,Scherphof G.Transfer and exchange of phospholipid between small unilamellar liposomes and rat plasma high density lipoproteins Dependence on cholesterol content and phospholipid composition[J].Biochim Biophys Acta,1981,665(3):538-545.
[13]朱会琴, 逄涣欢,胡昌勤,等.浊度法测定两性霉素B及其脂质体的效价[J].中国抗生素杂志,2006,30(12):752-755.
[14]Wong M,Chiu GN.Simultaneous liposomal delivery of quercetin and vincristine for enhanced estrogen-receptor-negative breast cancer treatment[J].Anticancer Drugs,2010,21(4):401-410.
[15]Lasic DD,Woodle MC,Martin FJ,etal.Phase-behavior of stealth-lipid-lecithin mixtures[J].Period Biol,1991,93(2):287-290.
[16]Dusi G,Gamba V.Liquid chromatography with ultraviolet detection of lasalocid,monensin,salinomycin and narasin in poultry feeds using pre-column derivatization[J].J Chromatogr A,1999,835(1-2):243-246. T,Morrison SJ,Clarke MF,etal.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
[本文编辑]顾文华

