香菇菌富硒液体发酵及三种胞外酶活性变化
王艳梅,吴 艳,王雅珍,李彩霞
(1.黑龙江工业学院环境工程系,黑龙江鸡西158100;2.江苏宿迁经贸高等职业技术学院社会服务系,江苏沭阳223600)
硒是人体必需微量元素,是GSHPx(谷胱甘肽过氧化物酶)和TrxR(硫氧还蛋白还原酶)等含硒酶重要组成部分[1],具有提高人体机体免疫能力、抗肿瘤、缓解体内重金属蓄积、抗衰老和防止心脑血管疾病等活性[2]。人体只能从食物中获取硒,从谷物和蔬菜摄入硒占总量的85%左右。我国72%地区为不同程度缺硒区,低硒地带造成农产品硒含量低,使当地居民膳食硒摄入量远低于中国营养学会推荐硒摄入量最低值50μg·d-1,因此提高日常食品硒含量尤为重要。有机硒比无机硒具有较高生物活性和较低毒性,成为当今研究热点[3]。香菇菌丝体对无机硒有较强富集和转化作用[4],香菇又具有增强免疫力、抗肿瘤、降血脂、抗血栓、健胃保肝、预防佝偻病和防治贫血等功能[5],因此,生产研发富硒香菇对健康饮食有重要意义。
本文研究香菇菌在添加不同浓度Na2SeO3的发酵液中,对硒的富集及转化能力,同时检测发酵6天后淀粉酶、羧甲基纤维素酶(CMC)、漆酶活性,为药食同源富硒香菇的开发利用提供参考。
1 材料与试剂
1.1 实验材料
香菇菌购于黑龙江五常市东北食用菌研究所。
1.2 培养基
(1)斜面种子培养基(PDA) 马铃薯浸出液200g·L-1,葡萄糖20g·L-1,琼脂15 g·L-1,酵母粉 5 g·L-1,pH自然。
(2)液体种子培养基 马铃薯浸出液 200g·L-1,葡萄糖 20g·L-1,酵母粉 5 g·L-1,KH2PO41g·L-1,MgSO4·7H2O,0.5 g·L-1,pH=6.5;(3)摇瓶发酵培养基:糊精[6]20g·L-1,酵母粉 5 g·L-1,KH2PO41g·L-1,FeSO4[6]0.5 g·L-1,CaCl20.5g·L-1,pH=6.5。
2 实验方法
2.1 香菇菌富硒培养
2.1.1 种子斜面培养
PDA琼脂培养基做好后分装进试管,120℃、0.12Mpa灭菌30min,趁热摆斜面;待培养基冷却至室温,原种试管中取出约1cm2菌丝块接种于斜面培养基,置25℃培养箱中培养12d,4℃低温保藏。
2.1.2 菌种活化
取4℃保藏的菌种斜面,25℃培养箱活化12h。
2.1.3 液体种子培养
从以活化好的香菇试管菌中1cm2接入80mL(500mL三角瓶)分别含有Na2SeO3的10、20、30、40、50 μg·mL-1的液体培养基中,25℃、150r·min-1摇床培养6d制备成种子培养液,以不添加Na2SeO3液体培养基为对照。
2.1.4 液体发酵培养
以8%接种量将种子培养液转接入 100mL(500mL三角瓶)分别含 Na2SeO3的60、70、80、90、100 μg·mL-1液体培养基中,25℃、150 r·min-1摇床6d发酵培养,以不添加Na2SeO3液体培养基为空白对照。
2.2 香菇菌丝体干生物量及菌球直径测定
收集100mL发酵液菌丝体,5000r·min-1离心10min,蒸馏水洗三次得菌丝体。用移液管取1mL发酵液,显微观察测定,以随机抽取10个菌球直径算术平均值作为菌球直径[7]。将菌丝体置60℃恒温真空干燥箱,烘干至恒重,电子天平称重,即为菌丝体干生物量[8]。
2.3 样品有机硒含量测定
2.3.1 绘制硒标准曲线
准确称量2.194g干燥的Na2SeO3,蒸馏水溶解并定容至1L,制备成含硒1g·L-1的标准溶液储备液。取此储备液 1mL,加蒸馏水定容至 200 mL,此硒标准应用液含硒 5μg·mL-1。分别取0、2、4、6、8、10 mL 硒标准应用液,置于125mL分液漏斗中,用水稀释成40mL,用1:1的HCl调节pH2~3,加入EDTA-2Na溶液2mL,再加入3,3,–二氨基联苯胺溶液2mL,摇匀。置暗处50min,取出,用10%NaOH 调节 pH7.0~7.5,准确加10mL甲苯,摇荡3min,静置分层,甲苯层置于分光光度计波长420nm处测定其吸光度[9],绘制标准曲线。
2.3.2 样品无机硒的去除
准确称取烘干菌丝体0.2g,加入pH=8.6三羟甲基氨基甲烷-盐酸-甘油缓冲溶液,加入适量SiO2充分研磨,显微镜检,待细胞完全破碎后装入MD34-3500[10]透析袋内,于去离子水中透析。取透析外液,加入15%(质量比)半胱氨酸溶液摇匀静置,加1~2滴亚甲基蓝溶液,30~60s不褪色[11]证明无机硒已除净。
2.3.3 样品有机硒含量测定
完全转移透析内液于锥形瓶中,加入(VHNO3:VHClO4)混合酸5 mL,于可控温电热板上加热,及时补加混酸,当消化至样液呈无色通明为止。冷却,消化液转入烧杯,调pH为7.0,最后将溶液定容到50mL容量瓶中,按2.3.1的方法测样品有机硒含量。
2.3.4 样品总硒含量测定
准确称取烘干菌丝体0.2g,按2.3.4方法测总硒含量。
2.4 三种酶活性测定
香菇是木腐菌,对多糖物质的降解主要依赖纤维素酶和木质素酶[12],这些酶活性强弱一定程度上决定菌丝体对培养基物料的生物转化[13],取培养6天发酵液5mL,于4℃以下以4000 r·min-1离心10min,上清液即为粗酶液[14],漆酶活性测定采用ABTS法[15],淀粉酶、羧甲基纤维素酶活性测定参照回晶的方法进行[16]。
3 结果与分析
3.1 标准曲线绘制
以硒标准液浓度为横坐标,吸光度为纵坐标,绘制硒标曲线如图1,回归曲线线性方程为:
y=0.089x -0.005,回归系数 R2=0.9966。
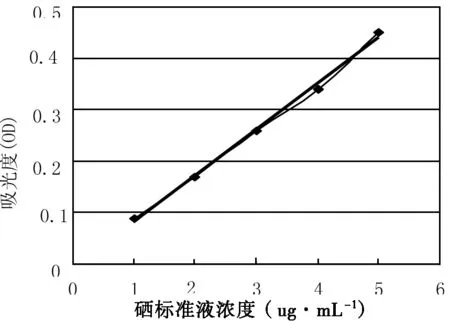
图1 硒标准曲线
3.2 不同Na2SeO3浓度对香菇液体种子培养生物量的影响
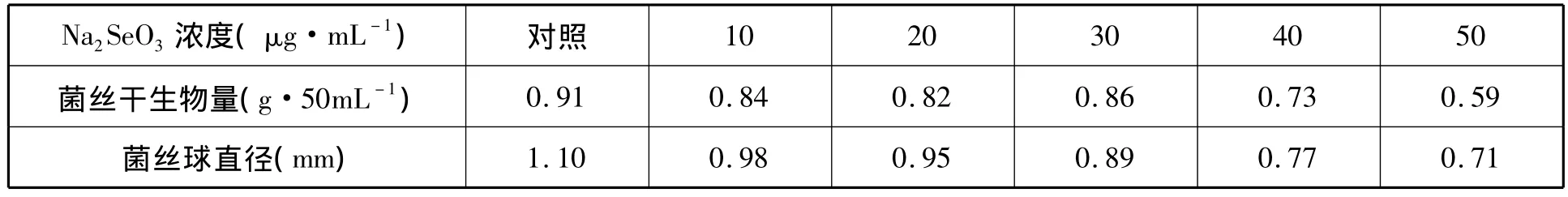
表1 不同Na2SeO3浓度对香菇液体种子培养生物量的影响
从表1可以看出,发酵液中添加Na2SeO3,无论浓度多大,对液体种子生长都抑制;其中Na2SeO3为30μg·mL-1菌丝体生物量最大,为 0.86 g·50mL-1,Na2SeO3为 10μg·mL-1菌丝球直径最大,为 0.98mm。
镜检观察,当Na2SeO3为30μg·mL-1,菌球边缘菌丝分支细密,菌丝粗壮。综合菌丝直径与菌丝干生物量,选
Na2SeO3为30μg·mL-1液体种子为继续发酵用。
3.3 发酵液中添加不同浓度Na2SeO3对香菇菌富硒效果的影响
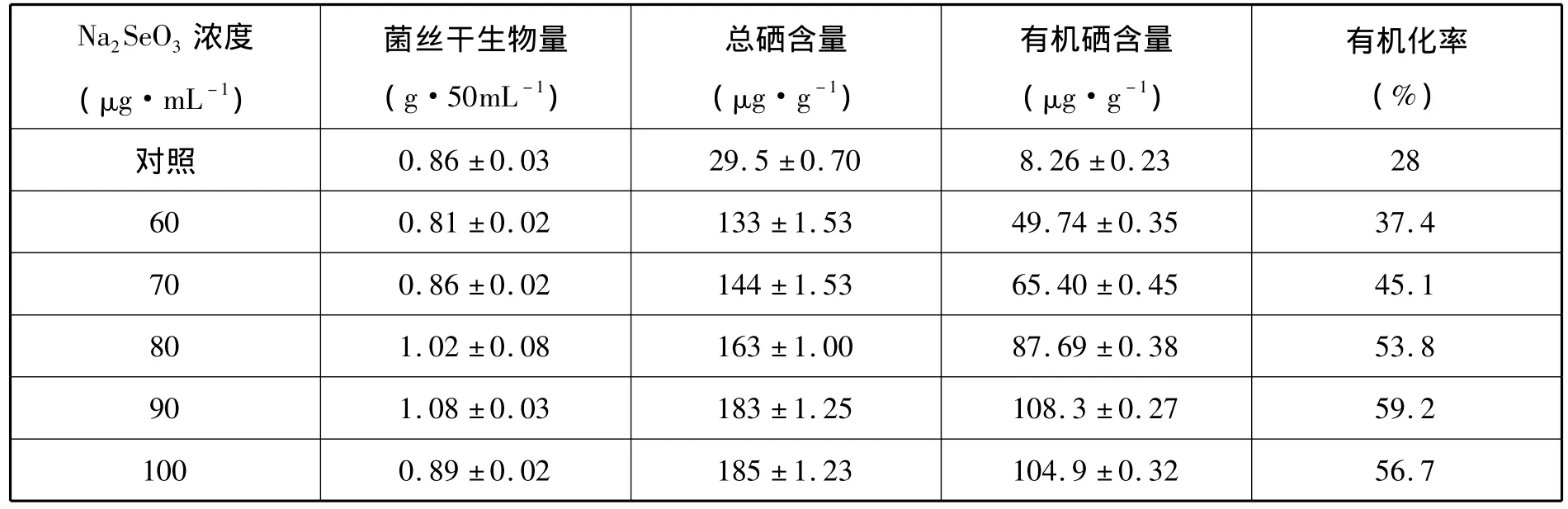
表2 不同Na2SeO3浓度对香菇菌液体发酵富硒效果的影响(X ±SD,n=3)
从表2中可以看出,添加Na2SeO3对菌丝干生物量、总硒含量、有机硒含量、有机化率都有促进作用,比不添加Na2SeO3相应的各量都大。总硒含量一直随Na2SeO3添加量增大而增大,但在Na2SeO3浓度大于100μg·mL-1时,菌丝干生物量明显减小,发酵液稍显浑浊,菌丝生长受到抑制,有机硒化率也开始降低。所以 90μg·mL-1为最佳添加量。
3.4 发酵液添加不同浓度Na2SeO3对香菇菌3种胞外酶活性影响
从图2可以看出,发酵液中添加浓度为60~90μg·mL-1的Na2SeO3,对淀粉酶、羧甲基纤维素酶、漆酶的活性起都起促进作用;当Na2SeO3浓度超过100μg·mL-1时三种酶活性被抑制,小于对照组;在Na2SeO3浓度60~90μg·mL-1三种酶活性先是随浓度增高而增大,但当在Na2SeO3浓度超过一定范围时,对三种酶的活性随浓度增大而降低。其中,Na2SeO3为 90μg·mL-1时,淀粉酶活性最大为 14.7U;Na2SeO3为 80μg·mL-1时,羧甲基纤维素酶活性为18.7U;Na2SeO3为90μg·mL-1时,漆酶活性最大为0.44U。
4 结论

图2 香菇菌液体发酵液中添加不同浓度Na2SeO3对3种胞外酶活性影响
通过实验可以确定90μg·mL-1的Na2SeO3为最佳添加量,此时总硒含量、有机硒含量分别为183 μg·g-1、108.3 μg·g-1,有机化率为59.2%;此时淀粉酶、漆酶活性活性也达到最大,分别为14.7U、0.44U。综上可以看出硒元素能促进香菇菌生长发育,这可能与含硒元素酶的活性有关。硒在微生物中以含硒酶和硒蛋白的功能形式存在[17],含硒的GPx(谷胱甘肽过氧化物酶)家族催化超氧化物还原,防止细胞膜的氧化损伤;含硒的硫氧还蛋白还原酶(TDR)为细胞生长和分化所必需;硒还以硒代半胱氨酸(Sec)形式存在于甲酸脱氢酶、甘氨酸还原酶、氢化酶等含硒酶的活性中心,并为酶催化活性所必需。香菇菌内硒元素含量增加,这些含硒酶活性都可能提高,由此促进了香菇菌的生长发育。
[1]Kieliszek M,Blazejak,S.Selenium:Significance and outlook for supplementation[J].Nutrion 2013,29(5):713 -718.
[2]Berry MJ.Insights into the hierechy of selenium incorporation[J].Nature Genetics,2005,37:1162 -1163.
[3]Qin Hai-bo Qin,Jian-ming Zhu,Liang-liang.The bioavailability of selenium and risk assessment for human selenium poisoning in high-Se areas,hina[J].Environment International 2013,52:66 -74.
[4]林琳,谢必峰,施巧琴.富哂香菇的深层培养及其特性[J].福建师范大学学报,1998(3):77-81.
[5]曾智平.高纯度香菇多糖的分离提取及其分级研究[D].西安:西安建筑科技大学,2007.
[6]香菇多糖的深层发酵与分离纯化研究[D].杭州:浙江农业大学,2010.
[7]吴俐.油茶枝液体培养茶树菇代谢产物的抗氧化活性[D].福州:福建农林大学,2009.
[8]邓百万,陈文强.云芝液体培养及富硒研究[J].氨基酸及生物资源,2000,22(4):21-24.
[9]王连芳,窦春霞,张连富,胡蔚红.有机物中微量元素硒的测定[J].食品与机械,2007,2(1):115 -117,147.
[10]梁淑轩,马二红,徐成燕,等.枸杞多糖的硒化及其对人宫颈癌细胞的抑制作用[J].食品科学,2010,31(9):243-246.
[11]郝素娥,滕冰.硒酵母中有机硒及硒代氨基酸含量测定方法[J].分析测试学报,1999,18(3):72-74.
[12]贾新成,李喜梅,李磊,等.平菇培养中纤维素半纤维素的降解及其酶活性变化[J].华北农学报,1994(9):92-95.
[13]陈建军,杨清香,王栋,等.不同生长阶段平菇漆酶、纤维素酶活性研究[J].西北农业学报,2007,16(1):87-89.
[14]杨舒贻,杨晖,闾琼妮.香菇液体培养过程中3中胞外酶酶活的变化[J].湖北农业科学,2013,52(14):3391-3393.
[15]赵爽,刘宇,许峰,等.姬松茸4个品种菌丝体的生物酶活性测定[J].中国食用菌,2010,29(3):32-33.
[16]回晶,赵文静,邹志远,等.金耳液体培养过程中几种胞外酶活性的变化规律[J].食用菌学报,2007,14(3):29-32.
[17]黄峙,郭宝江.含硒酶与非酶作用机制[J].生命科学,2002,14(2):100 -102.

